Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
1
Nouveaux composés, leur utilisation comme médicaments, et leur procédé de
préparation.
L'invention concerne de nouveaux composés, leur utilisation comme médicaments
et leur
procédé de préparation.
De nombreuses molécules ayant une activité anti-infectieuse (antiseptiques
et/ou
antibiotiques) sont connues et commercialisées, par exemple l'hexamidine et la
chlorhexidine.
Cependant, l'apparition de phénomènes de résistance à ces molécules a été
constatée, et par
conséquent, à terme, il est plus que probable que ces produits deviennent non
utilisables car
inefficaces.
Actuellement, les infections nosocomiales (IN) constituent un problème majeur
de santé
publique. Les agents responsables d'IN peuvent être des bactéries, des virus
ou des
champignons.
On désigne par IN toute infection survenant dans un délai d'au moins 48 h
(pour les
infections bactériennes) ou dans un délai correspondant à la période
d'incubation du germe
(pour les infections virales et fongiques) après l'admission ou à la suite
d'une hospitalisation,
et si elle était absente à l'admission à l'hôpital. Le caractère nosocomial
d'une infection du
site opératoire est affirmé si elle survient dans les 30 jours suivant
l'intervention, ou dans
l'année s'il s'agit de l'implantation de matériel étranger (prothèse,
implant), et ceci bien que
le malade ne soit plus hospitalisé.
Les IN sont préoccupantes de part leur morbidité importante, de la mortalité
associée, du
surcoût hospitalier non négligeable et de l'émergence de bactéries résistantes
à plusieurs
familles d'antibiotiques (BMR : Bactéries Multi-Résistantes).
Les IN les plus fréquemment rencontrées sont les infections urinaires (30%),
les infections
respiratoires (15%), les infections du site opératoire (14%) et les infections
de la peau et des
tissus mous (10%).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
2
Parmi les germes responsables d'IN, les bactéries apparaissent en première
ligne. Les plus
souvent en cause sont Escherichia coli (25%) (bactérie de la flore commensale
intestinale,
responsable d'infections urinaires), Staphylococcus aureus (19%) (bactérie de
la flore
commensale cutanée et nasale, responsable d'infections cutanées et du site
opératoire),
Pseudomonas aeruginosa (10%) (bactérie opportuniste, responsable de pneumonies
graves et
d'infections cutanées), Enterococcus spp (6%) (bactérie de la flore commensale
intestinale et
responsable essentiellement d'infections urinaires).
De façon globale, le taux de résistance aux antibiotiques des bactéries
responsables d'IN
est élevé et la proportion de BMR observée en France est parmi les plus
importantes
d'Europe ; les pays d'Europe du Nord (Danemark, Pays Bas, Norvège...) étant
caractérisés
par un très faible taux de multi-résistance aux antibiotiques. Cette situation
préoccupante est
liée à un usage excessif et souvent inadapté des antibiotiques : prescriptions
inappropriées,
doses inadéquates, durée de traitement inadaptée, ...
A l'heure actuelle, 52% des Staphylococcus aureus isolés à l'hôpital au cours
d'IN sont
résistants à la méticilline (on parle de SARM : Staphylococcus aureus
Résistant à la
Méticilline), cet antibiotique de la famille des pénicillines constituant le
traitement de
référence des staphylocoques. A cela s'ajoute l'émergence de souches de SARM
résistantes à
de nombreuses autres familles d'antibiotiques : macrolides, aminosides,
fluoroquinolones,
voire glycopeptides (antibiotiques de choix dans le traitement des infections
à staphylocoques,
souvent dernier recours en cas d'infection sévère). D'autres germes
hospitaliers multi-
résistants posent problème :
(i) les entérobactéries résistantes aux (3 lactamines (15%) (on parle de EBLSE
Entérobactéries à J3-Lactamase à Spectre Etendu, les (3 lactamases étant des
enzymes responsables de la dégradation des (3-Lactamines),
(ii) les entérocoques résistants aux glycopeptides (10%) (on parle d'ERV
Entérocoques Résistants à la Vancomycine, la vancomycine étant avec la
teicoplanine un des membres de la famille des glycopeptides),
(iii) Pseudomonas aeruginosa résistant aux céphalosporines de 3ème génération
(25%),...
Le danger est de se retrouver face à une impasse thérapeutique :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
3
- soit aucun composé n'est plus disponible à des fins de traitement
d'infections
nosocomiales, généralement graves puisque touchant des patients fragilisés,
- soit les composés restant à disposition présentent une toxicité telle que
leur usage est
limité, voire non envisageable.
Par conséquent, il est essentiel de proposer de nouvelles molécules
alternatives ayant une
activité anti-infectieuse.
Un des aspects de l'invention est de fournir de nouveaux composés pour lutter
contre les
infections bactériennes, virales, fongiques et parasitaires.
Un des aspects de l'invention concerne l'utilisation de composés pour la
préparation d'un
médicament destiné au traitement d'infections bactériennes, virales, fongiques
et parasitaires.
De façon générale, l'invention concerne l'utilisation d'au moins un composé de
formule
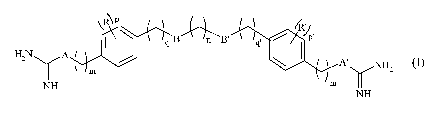
(I) suivante :
~R1p~ /R'
q B n\B' 4', PHZNyA \ A' NH2
y (I)
NH m m'
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 8,
notamment 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
4
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
Par groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié , on
désigne les
groupes méthyle, éthyle, n-propyle et isopropyle.
L'expression sel d'acide physiologiquement acceptable signifie que les
composés de la
formule (I), définie ci-dessus, peuvent exister sous forme d'amidinium
(lorsque A et/ou A'
représente(nt) -CH2-) ou de guanidinium (lorsque A et/ou A' représente(nt) NH
ou NR") par
réaction d'un acide inorganique ou d'un acide organique, sur un composé de
formule (I).
Des exemples d'acides inorganiques permettant l'obtention de sels
physiologiquement
acceptables incluent sans être limités à ceux-ci, l'acide chlorhydrique,
l'acide bromhydrique,
l'acide nitrique, l'acide carbonique, l'acide formique, l'acide
monohydrogénocarbonique,
l'acide phosphorique, l'acide monohydrogénophosphorique, l'acide dihydrogéno-
phosphorique, l'acide perchlorique, l'acide sulfurique, l'acide
monohydrogénosulfurique,
l'acide iodhydrique.
Des exemples d'acides organiques permettant l'obtention de sels
physiologiquement
acceptables incluent sans être limités à ceux-ci, l'acide acétique, l'acide
lactique, l'acide
propionique, l'acide butyrique, l'acide isobutyrique, l'acide palmique,
l'acide maléique,
l'acide glutamique, l'acide hydroxymaléique, l'acide malonique, l'acide
benzoïque, l'acide
succinique, l'acide glycolique, l'acide subérique, l'acide fumarique, l'acide
mandélique,
l'acide phthalique, l'acide salicylique, l'acide benzènesulfonique, l'acide p-
toluènesulfonique,
l'acide citrique, l'acide tartrique, l'acide méthanesulfonique, l'acide
hydroxynaphthoïque.
Les sels d'acides aminés, tels que les arginates et leurs équivalents sont
également inclus
ainsi que les sels d'acides organiques tels que l'acide glucuronique ou
l'acide galacturonique
et leurs équivalents (voir, par exemple, Berge et al, "Pharmaceutical Salts",
Journal of
Pharmaceutical Science, 1977, 66, 1-19).
Les termes n représente un nombre entier compris de 1 à 12 désignent tous
les
nombres entiers 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 et 12. Cette définition
s'applique à la formule
(I) mais également aux autres formules ci-dessous.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
Les termes m et m' représentent indépendamment l'un de l'autre des nombres
entiers de
0 à 8 désignent tous les nombres entiers 0, 1, 2, 3, 4, 5, 6, 7 et 8. Cette
définition s'applique
à la formule (I) mais également aux autres formules ci-dessous.
5 Les termes q et q' représentent indépendamment l'un de l'autre des nombres
entiers de
0 à 2 désignent les nombres entiers 0, 1 et 2. Cette définition s'applique à
la formule (I)
mais également aux autres formules ci-dessous.
Les termes p et p' représentent indépendamment l'un de l'autre des nombres
entiers de 0
à 4 désignent les nombres entiers 0, 1, 2, 3 et 4. Cette définition
s'applique à la formule (I)
mais également aux autres formules ci-dessous.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
p /R'
qB n\13' q, P
HZNy A m A'
NHZ
NH MI (I)
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
6
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
~R1p /R'
qB n\B' q, P
HZNA M A'
YNHZ NH MI (I)
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' sont égaux à 2,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
~R1p /R~ --, q B \B' 1
HZN A A'
YNHz (I)
NH m m'
NH
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
7
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 8,
notamment 1 à 8,
- q et q' sont égaux à 0,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante :
~R1p~ /R'
qB n\B' q P
HzNyA
A' NH2
NH m m' y
NH (1)
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 8,
notamment 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- pet p' sont égaux à 0,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
8
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
P /R/
qB n~B' 4 / P'
HZNyA A'
NHZ
NH MI y (1)
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' sont égaux à 2,
- q et q' sont égaux à 0,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
9
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
~R1p /R'
qB n\B' q P
HZN A A'
YNHZ
M (I)
NH MI
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' sont égaux à 2,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' sont égaux à 0,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
~R1p\ /'R'
qB n\B' q P
HZNyA A'
YNHZ
(I)
NH MI
NH
dans laquelle :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 8,
notamment 1 à 8,
- q et q' sont égaux à 0,
5 - pet p' sont égaux à 0,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
10 groupe CH2,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(I)
suivante
~R1p\ /'R'
q B n\B' 4~ PHZNyA A'
YNHZ
(I)
NH MI
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' sont égaux à 2,
- q et q' sont égaux à 0,
- pet p' sont égaux à 0,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
11
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
L'invention concerne également l'utilisation d'au moins un composé de formule
(la)
suivante
p~ /R'
qB n\B' q P
HZN A A'
YNH2
M (la)
NH MI
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 8,
notamment 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
pour la préparation d'un médicament destiné au traitement de pathologies
associées à des
infections bactériennes, virales, fongiques et parasitaires.
Les composés de formule (la) correspondent aux composés de formule (I) dans
lesquels A
et A' représentent indépendamment l'un de l'autre un groupe NH ou un groupe
NR".
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
12
Selon un mode de réalisation avantageux de l'invention, la formule des
composés pour
l'utilisation telle que définie ci-dessus est la formule (II) suivante :
NH2
HzN R)p (RI) p'
A, (II)
RN B ri MI NH
m
dans laquelle :
- B, B', R, R', m, m', n, p, p' sont tels que définis ci-dessus, et,
- A et A' représentent indépendamment l'un de l'autre un groupe CH2, un groupe
NH
ou un groupe NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(II) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (II) correspond à la formule (I), dans
laquelle q et q'
sont égaux à 0.
Selon un mode de réalisation particulier de l'invention, la formule des
composés pour
l'utilisation telle que définie ci-dessus est la formule (II') suivante :
H2N ~ R) p (RI) p' A, NH2
B ri MI NH
RN
m
(II')
dans laquelle :
- B, B', R, R', m, m', n, p, p' sont tels que définis ci-dessus, et,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(II') tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
13
La formule des composés de formule (II') correspond à la formule (la), dans
laquelle q et
q' sont égaux à 0.
Selon un mode de réalisation avantageux de l'invention, la formule des
composés pour
l'utilisation telle que définie ci-dessus est la formule (III) suivante :
HZN P (R) p A NHZ
B n B M NH
RN
m
(III)
dans laquelle :
- B, R, m, n, p sont tels que définis ci-dessus, et,
- A représente un groupe CH2, un groupe NH ou un groupe NR", dans lequel R"
est un
groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(III) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (III) correspond à la formule (II), dans
laquelle :
- m et m' d'une part, et p et p' d'autre part, sont égaux, et,
- A et A' d'une part, et B et B' d'autre part, représentent le même atome ou
groupe.
Dans ce mode de réalisation, les composés de formule (III) sont symétriques.
L'avantage des molécules de formule (III) est que le procédé de préparation
est facilité du
fait que ces molécules sont symétriques.
Selon un mode de réalisation avantageux de l'invention, la formule des
composés pour
l'utilisation telle que définie ci-dessus est la formule (III') suivante :
HZN )P (R) NHZ
B n B M NH
RN
m
(III')
dans laquelle :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
14
- B, R, m, n, p sont tels que définis ci-dessus, et,
- A représente un groupe NH ou un groupe NR", dans lequel R" est un groupe
alkyle
de 1 à 3 atomes de carbone, linéaire ou ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(III) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (III') correspond à la formule (II'), dans
laquelle :
- m et m' d'une part, et p et p' d'autre part, sont égaux, et,
- A et A' d'une part, et B et B' d'autre part, représentent le même atome ou
groupe.
Dans ce mode de réalisation, les composés de formule (III') sont symétriques.
Selon un mode de réalisation avantageux de l'invention, la formule du composé
pour
l'utilisation telle que définie ci-dessus est la formule (IV) suivante :
H2N O nO NHz (IV)
NH
N N
H H
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(IV)
La formule des composés de formule (IV) correspond à la formule (III), dans
laquelle A
représente un groupe NH, B un atome d'oxygène, p est égal à 0 et m est égal à
2. Dans ce
mode de réalisation, les composés de formule (IV) sont symétriques.
L'avantage des molécules de formule (IV) est que le procédé de préparation est
facilité du
fait que ces molécules sont symétriques.
Selon un mode de réalisation avantageux de l'invention, la formule du composé
pour
l'utilisation telle que définie ci-dessus est la formule 6 suivante :
NH ~
HZN_~ O 6 0 / \ %_NHZ 6
N N
H H
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
6 tel qu'un
chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
La formule des composés de formule 6 correspond à la formule (IV), dans
laquelle n est
égal à 6. Dans ce mode de réalisation, le composé de formule 6 est symétrique.
Selon un autre mode de réalisation de l'invention, la formule du composé pour
5 l'utilisation telle que définie ci-dessus est la formule (II) telle que
définie ci-dessus dans
laquelle :
- m est différent de m', et/ou,
- p est différent de p', et/ou,
- R est différent de R', et/ou,
10 - A est différent de A', et/ou,
- B est différent de B'.
Dans ce mode de réalisation, les composés ayant une telle formule ne sont pas
symétriques.
Selon un mode de réalisation particulier, les composés de l'invention sont
impliqués dans
le traitement de pathologies causées par les bactéries du tableau 1.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
16
Bactéries aérobies / aérobies-anaérobies
facultatives Anaérobies Autres
à Gram positif à Gram négatif
Staphylococcus spp. Escherichia coli Clostridium spp. Mycobacterium spp.
dont C. difficile dont M. tuberculosis
Streptococcus spp. Salmonella spp. Bacteroïdes spp. Treponema spp.
dont T. pallidum
Streptococcus Shigella Legionella spp.
pneumoniae gella spp. acnes dont L. pneumophila
Enterococcus spp. Proteus spp. Prevotella spp. Listeria spp.
dont L. monocytogenes
Bacillus spp. Klebsiella spp. Porphyromonas Chlamydia spp.
dont B. anthracis spp.
Corynebacterium spp. Enterobacter spp. Fusobacterium spp. Chlamydophila spp.
C. diphteriae '
Erysipelothrix Citrobacter spp. Bifidobacterium Borrelia spp.
rhusopathiae spp.
Serratia spp. Eubacterium spp. Brucella spp.
Providencia spp. Peptococcus spp. Mycoplasma spp.
Morganella spp. Peptostreptococcus Ureaplasma spp.
spp.
Yersinia spp. Veillonella spp. Leptospira spp.
Vibrio spp. Actinomyces spp. Rickettsia spp.
dont V. cholerae
Campylobacter spp. Francisella tularensis
Pasteurella spp. Nocardia spp.
Haemophilus spp. Coxiella burnetii
Bordetella spp.
dont B. pertussis Bartonella spp.
Neisseria spp.
dont N. gonorrhoeae
et N. meningitidis
Moraxella
catarrhalis
Helicobacter pylori
Pseudomonas spp.
Burkholderia spp.
Stenotrophomonas
maltophilia
Acinetobacter spp.
Aeromonas spp.
Tableau 1 . Bactéries à l'origine de pathologies traitées par les composés
selon l'invention.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
17
Selon un autre mode de réalisation, les composés de l'invention sont impliqués
dans le
traitement de pathologies dues à des bactéries multirésistantes (BMR)
responsables
d'infections nosocomiales et/ou communautaires.
Selon un autre mode de réalisation, les composés de l'invention sont impliqués
dans le
traitement de pathologies causées par des virus appartenant à différentes
familles, telles que :
hépatites virales A, B & D, C (Familles des Picornaviridae, Hepadnaviridae,
Flaviviridae) ,
le SIDA, leucémie, cancer... (Famille des Retroviridae) ; la variole...
(Famille des
Poxviridae) ; l'herpès buccal et/ou génital, varicelle, zona, mononucléose,
rosélose,
lymphome... (Famille des Herpesviridae) ; le SRAS, rhume... (Famille des
Coronaviridae) ;
l'érythème infectieux (Famille des Parvoviridae) ; certains cancers...
(Familles des
Papovavirus, Polyoviridae & Papillomaviridae) ; la poliomyélite et méningite,
hépatite virale
A (Famille des Picornaviridae) ; la grippe (Famille des Orthomyxoviridae) ;
des arboviroses
(Familles des Flaviviridae, Togaviridae, Rhabdoviridae, Reoviridae) ; la
fièvre de Lassa...
(Famille des Arenaviridae), les fièvres hémorragiques (Famille des
Bunyaviridae)...
Selon un autre mode de réalisation, les composés de l'invention sont impliqués
dans le
traitement de pathologies causées par des champignons, en particulier les
champignons
suivants: Candida spp., Aspergillus spp., Epidermophyton spp., Trichophyton
spp.,
Microsporum spp. et Pneumocystisjiroveci.
Selon un autre mode de réalisation, les composés de l'invention sont impliqués
dans le
traitement de pathologies causées par les parasites du tableau 2.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
18
Zoonoses Plathelminthes Némathelminthes
Entamoeba spp. Fasciola hepatica Ancylostoma duodenalis
Pseudolimax spp. Dicrocoelum dendriticum Necator americanus
Endolimax spp. Schistosoma spp. Ascaris lumbricoïdes
Dientamoeba spp. Echinococcus spp. Trichuris trichiura
Balantidium coli Taenia spp. Trichocephalus trichiurus
Giardia intestinalis Anisakis spp.
Trichomonas spp. Toxocara spp.
Trypanosoma spp. Wuchereria spp.
Toxoplasma gondii Brugia spp.
Plasmodium spp. Loa loa
Leishmania spp. Onchocerca volvulus
Cryptosporidium spp. Dracunculus medinensis
Encephalitozoon spp. Mansonella spp.
Enterocytozoon spp. Strongyloïdes spp.
Cyclospora cayetanensis Trichinella spp.
Isospora belli Enterobius vermicularis
Sarcocystis spp.
Babesia spp.
Tableau 2 : Parasites à l'origine de pathologies traitées par les composés
selon l'invention.
Les dites pathologies causées par des parasites peuvent par exemple être les
maladies
parasitaires dues à des protozoaires ou à des vers, la gale, les myases et les
pédiculoses.
Selon un autre aspect, l'invention concerne le composé de formule (VI)
suivante :
~R1p\ /'R'
qB n B' q', p
R"NH A
\ A' NHR"'
(VI)
NR'" MI
NR"'
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
19
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- R" représente un hydrogène ou un groupe protecteur de la fonction amine
notamment choisis parmi les groupes Boc, Fmoc, Bn, Z,
- si A et A' représentent indépendamment l'un de l'autre un groupe CH2, alors
m et
m' représentent indépendamment l'un de l'autre des nombres entiers de 1 à 8,
- si A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié, alors m et m' représentent indépendamment l'un de l'autre des nombres
entiers de 2 à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(VI) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
les composés de formules suivantes étant exclus:
H H
H N N
N O O N
O N N J_O
O O~ ~O O
O
H H
N N
2
H2N__~ O O NH
NH HN HCl
HCl
H H
7
HZN O NH
O 2
CF3COOH NH RN CF3COOH
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
Les composés de formule (VI), à l'exclusion des deux composés ci-dessus, sont
nouveaux.
5 Par groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié , on
désigne les
groupes méthyle, éthyle, n-propyle et isopropyle.
L'expression sel d'acide physiologiquement acceptable signifie que les
composés de
la formule (I), définie ci-dessus, peuvent exister sous forme d'amidinium
(lorsque A et/ou A'
10 représente(nt) -CH2-) ou de guanidinium (lorsque A et/ou A' représente(nt)
NH ou NR") par
réaction d'un acide inorganique ou d'un acide organique, sur un composé de
formule (I).
Des exemples d'acides inorganiques permettant l'obtention de sels
physiologiquement
acceptables incluent sans être limités à ceux-ci l'acide chlorhydrique,
l'acide bromhydrique,
l'acide nitrique, l'acide carbonique, l'acide formique, l'acide
monohydrogénocarbonique,
15 l'acide phosphorique, l'acide monohydrogénophosphorique, l'acide
dihydrogéno-
phosphorique, l'acide perchlorique, l'acide sulfurique, l'acide
monohydrogénosulfurique,
l'acide iodhydrique.
Des exemples d'acides organiques permettant l'obtention de sels
physiologiquement
acceptables incluent sans être limités à ceux-ci l'acide acétique, l'acide
lactique, l'acide
20 propionique, l'acide butyrique, l'acide isobutyrique, l'acide palmique,
l'acide maléique,
l'acide glutamique, l'acide hydroxymaléique, l'acide malonique, l'acide
benzoïque, l'acide
succinique, l'acide glycolique, l'acide subérique, l'acide fumarique, l'acide
mandélique,
l'acide phthalique, l'acide salicylique, l'acide benzènesulfonique, l'acide p-
toluènesulfonique,
l'acide citrique, l'acide tartrique, l'acide méthanesulfonique, l'acide
hydroxynaphthoïque.
Les sels d'acides aminés, tels que les arginates et leurs équivalents sont
également inclus
ainsi que les sels d'acides organiques tels que l'acide glucuronique ou
l'acide galacturonique
et leurs équivalents (voir, par exemple, Berge et al, "Pharmaceutical Salts",
Journal of
Pharmaceutical Science, 1977, 66, 1-19).
Rappelons que les groupes Boc (ou boc), Fmoc, Bn, Z représentent
respectivement les
groupes t-butoxycarbonyle, fluorenyl-9-methoxycarbonyle, benzyle et
benzyloxycarbonyle.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
21
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2 à
8.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
m et m' sont égaux à 2.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
q et q' sont égaux à 0.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
p et p' sont égaux à 0.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
m et m' sont égaux à 2, et
g et q' sont égaux à 0 à 2.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
m et m' sont égaux à 2, et
pet p' sont égaux à 0.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
q et q' sont égaux à 0, et
p et p' sont égaux à 0.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
m et m' sont égaux à 2,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
22
q et q' sont égaux à 0, et
p et p' sont égaux à 0.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
n représente un nombre entier compris de 6 à 12, notamment de 8 à 10.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
R, R' représentent indépendamment l'un de l'autre un groupe alkyle de 1 à 3
atomes de
carbone, linéaire ou ramifié.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
p et p' sont égaux à 0.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
n représente un nombre entier compris de 6 à 12, notamment de 8 à 10, et
R, R' représentent indépendamment l'un de l'autre un groupe alkyle de 1 à 3
atomes de
carbone, linéaire ou ramifié.
Selon un mode de réalisation avantageux, l'invention concerne le composé de
formule
(VI) définie ci-dessus, dans laquelle
n représente un nombre entier compris de 6 à 12, notamment de 8 à 10, et
p et p' sont égaux à 0.
L'invention concerne également le composé de formule (VI') suivante :
~R~ p
/'R/
~-k 1
I q B n B' q, / P
R NHA A'
NHR"'
NR'" MI (VIS)
NR"'
dans laquelle :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
23
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- R" représente un hydrogène ou un groupe protecteur de la fonction amine
notamment choisis parmi les groupes Boc, Fmoc, Bn, Z,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié, alors m et m' représentent indépendamment l'un de l'autre des nombres
entiers de 2 à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(VI) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
les composés de formules suivantes étant exclus :
H H
H N N
N O O
O N N N
0
O O-J\ O 0 O
H H
N N
2
H2N__~ O O NH
HCl NH HN HCl
H N
HZN O NH
O 2
CF3COOH NH RN CF3COOH
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
24
La formule des composés de formule (VI') correspond à la formule (VI) avec A
et A'
représentant indépendamment l'un de l'autre un groupe NH ou un groupe NR".
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(I) suivante
~R1p /R'
qB n\B' q P
H N A
A' NHz (I)
NH M,
~ M
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- si A et A' représentent indépendamment l'un de l'autre un groupe CH2, alors
m et
m' représentent indépendamment l'un de l'autre des nombres entiers de 1 à 8,
- si A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié, alors m et m' représentent indépendamment l'un de l'autre des nombres
entiers de 2 à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(I) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
les composés de formules suivantes étant exclus :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
H N
N ~~5
H2N O O NH2
HCl NH HN HC1
H N
HzN O O NHa
CF3COOH NH RN CF3COOH
La formule des composés de formule (I) correspond à la formule (VI), dans
laquelle R"
représente un hydrogène. Les composés de formule (I) ci-dessus, à l'exclusion
des deux
10 composés ci-dessus, sont nouveaux.
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
L'invention concerne également des composés de formule (la) suivante :
15 p /R'
qB n\B' q P
HZN A A'
YNHZ
M
NH m' (la)
NH
dans laquelle :
20 - n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
25 NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone,
linéaire ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2, - R et R' sont indépendamment l'un de l'autre un halogène, tel que
les
atomes de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone, linéaire ou ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(la) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
les composés de formules suivantes étant exclus :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
26
H N
N ~~5
H2N O O NH2
HCl NH HN HC1
H H
N ~ ~ ~ ~ N
HzN O O NHa
CF3COOH NH RN CF3COOH
La formule des composés de formule (la) correspond à la formule (VI'), dans
laquelle R"
représente un hydrogène. La formule des composés de formule (la) correspond à
la formule
(I), dans laquelle A et A' représentent indépendamment l'un de l'autre un
groupe NH ou un
groupe NR".
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
L'invention concerne également des composés de formule (Ib) suivante :
~R1p\ /R'
qB n q, P
HZN
NH
M 2 (1b)
NH MI
NH
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 1
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2, - R et R' sont indépendamment l'un de l'autre un halogène, tel que
les
atomes de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone, linéaire ou ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(1b) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (Ib) correspond à la formule (I), dans
laquelle A et
A' représentent un groupe CH2.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
27
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(II) suivante :
HzN )p (RI) NH
A,
B n MI NH (II)
RN
m
dans laquelle :
- B, B', R, R', n, p, p' sont tels que définis ci-dessus, et,
- si A et A' représentent indépendamment l'un de l'autre un groupe CH2, alors
m et
m' représentent indépendamment l'un de l'autre des nombres entiers de 1 à 8,
- si A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié, alors m et m' représentent indépendamment l'un de l'autre des nombres
entiers de 2 à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(II) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (II) correspond à la formule (I), dans
laquelle q et q'
sont égaux à 0. Les composés de formule (II) ci-dessus, à l'exclusion des deux
composés ci-
dessus, sont nouveaux.
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(II') suivante
HzN ) p (RI) p' A, NHa
B n MI NH
RN
m
(II')
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
28
dans laquelle :
- B, B', R, R', n, p, p' sont tels que définis ci-dessus, et,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(II') tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (II') correspond à la formule (la), dans
laquelle q et
q' sont égaux à 0. La formule des composés (II') correspond à la formule (II),
dans laquelle A
et A' représentent indépendamment l'un de l'autre un groupe NH ou un groupe
NR".
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(III) suivante :
H2N ~ R) (R) NH2
NH (III)
RN B n B M
M
dans laquelle :
- B, R, n, p sont tels que définis ci-dessus, et,
- si A représente un groupe CH2, alors m représente un nombre entier de 1 à 8,
- si A un groupe NH ou un groupe NR", dans lequel R" est un groupe alkyle de 1
à 3
atomes de carbone, linéaire ou ramifié, alors m représente un nombre entier de
2 à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(III) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (III) correspond à la formule (II), dans
laquelle :
- m et m' d'une part, et p et p' d'autre part, sont égaux, et,
- A et A' d'une part, et B et B' d'autre part, représentent le même atome ou
groupe.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
29
Dans ce mode de réalisation, les composés de formule (III) sont symétriques.
Les
composés de formule (III) ci-dessus (à l'exclusion des deux composés ci-
dessus) sont
nouveaux.
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(III') suivante :
H2N )P (R) NH2
RN B nB m NH (III')
M
dans laquelle :
- B, R, n, p sont tels que définis ci-dessus, et
- A représente un groupe NH ou un groupe NR", dans lequel R" est un groupe
alkyle
de 1 à 3 atomes de carbone, linéaire ou ramifié, et
- m représente un nombre entier de 2 à 8,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(III') tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (III') correspond à la formule (II'), dans
laquelle :
- m et m' d'une part, et p et p' d'autre part, sont égaux, et,
- A et A' d'une part, et B et B' d'autre part, représentent le même atome ou
groupe.
La formule des composés (III') correspond à la formule (III), dans laquelle A
et A'
représentent indépendamment l'un de l'autre un groupe NH ou un groupe NR".
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(IV) suivante :
HZN NH O n0 / \ HN NH2
~ (IV)
N N
H H
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(IV) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule (IV) correspond à la formule (III), dans
laquelle A
5 représente un groupe NH, B un atome d'oxygène, p est égal à 0 et m est égal
à 2. Dans ce
mode de réalisation, les composés de formule (IV) sont symétriques. Les
composés de
formule (IV) ci-dessus (à l'exclusion des deux composés ci-dessus) sont
nouveaux.
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule 6
suivante :
NH RN
H2N 6 0 NHZ 6
N N
H H
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
6 tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
La formule des composés de formule 6 correspond à la formule (IV), dans
laquelle n est
égal à 6. Dans ce mode de réalisation, le composé de formule 6 est symétrique.
Le composé
de formule 6 ci-dessus est nouveau.
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un mode de réalisation avantageux, l'invention concerne des composés de
formule
(II) telle que définie ci-dessus, dans laquelle :
- m est différent de m', et/ou,
- p est différent de p', et/ou,
- R est différent de R', et/ou,
- A est différent de A', et/ou,
- B est différent de B'.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
31
Dans ce mode de réalisation, les composés ayant une telle formule ne sont pas
symétriques. Les composés de formule (II) avec les caractéristiques définies
ci-dessus sont
nouveaux.
Les nouveaux composés définis ci-dessus peuvent être utilisés selon la
présente invention.
Selon un autre aspect, l'invention concerne une composition pharmaceutique
comprenant
comme substance active au moins un composé tel que défini ci-dessus, en
association avec un
véhicule pharmaceutiquement acceptable.
Dans un mode de réalisation particulier, la composition pharmaceutique
comprend comme
substance active :
- un composé tel que défini ci-dessus, pour lequel la somme m + m' + n est
inférieure
ou égale à 10, ou,
- un composé tel que défini, pour lequel la somme 2m + n est inférieure ou
égale à 10,
- la dite composition pharmaceutique étant formulée en solution aqueuse.
Le premier cas (somme m + m' + n) correspond aux composés de formules (VI),
(I) et
(II). Le second cas (somme 2m + n) correspond aux composés de formules (III),
(IV) et 6,
pour lesquelles m est égal à m'. Ces composés sont solubles en solution
aqueuse.
Dans un autre mode de réalisation particulier, la composition pharmaceutique
comprend
comme substance active :
- un composé tel que défini ci-dessus, notamment pour lequel la somme m + m' +
n est
supérieure à 10, ou,
- un composé tel que défini ci-dessus, pour lequel la somme 2m + n est
supérieure à 10,
la dite composition pharmaceutique étant formulée en solution hydroalcoolique.
Le premier cas (somme m + m' + n) correspond aux composés de formules (VI),
(I) et
(II).Le second cas (somme 2m + n) correspond aux composés de formules (III),
(IV) et 6,
pour lesquelles m est égal à m'. Lorsque ces sommes sont supérieures à 10, les
composés sont
riches en carbone, donc peu solubles dans l'eau et plus lipophiles.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
32
L'expression solution hydroalcoolique désigne un mélange d'eau et d'au moins
un
alcool, notamment choisi parmi l'éthanol, l'alcool isopropylique et l'alcool
benzylique.
Dans un mode de réalisation particulier de l'invention, la composition
pharmaceutique
telle que définie ci-dessus est administrable par voie orale, et dans la dite
composition
pharmaceutique, la substance active est à la concentration d'environ 0,1 à
environ 5 mg/kg de
poids corporel.
Dans un autre mode de réalisation avantageux, la composition pharmaceutique
telle que
définie ci-dessus est administrable par voie topique, et dans la dite
composition
pharmaceutique, la substance active est à la concentration d'environ 0,1% à
environ 1% par
rapport au poids total dans la composition pharmaceutique.
L'expression par voie topique signifie que la composition pharmaceutique
est
appliquée à des endroits localisés, par exemple la peau ou une muqueuse.
Diverses formulations sont possibles pour les dites compositions
pharmaceutiques : sous
forme de gélule, comprimé, poudre, crème, lotion, solution aqueuse ou
hydroalcoolique,
collutoire, collyre, lait, mousse, gel, spray ou poudre par exemple.
L'invention concerne également le procédé de préparation d'un composé de
formule (la)
comprenant les étapes suivantes de :
a) une étape de clivage des groupements protecteurs Y d'un composé de formule
(X')
suivante :
R P A4 /R/
q B n B' q, P, (X')
YA
~11_1 A'Y
m
MI
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
33
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- Y représente un groupement protecteur des amines, notamment Boc ou Fmoc.
pour obtenir :
* un composé de formule (XI') suivante :
~R~ P /R'
q B nq, P
HA A'H (XI')
MI
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
ou,
* un sel d'acide dérivé d'un composé de formule (XI') tel qu'un chlorhydrate,
un
formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
34
b) une étape de réaction du composé de formule (XI') formé lors de l'étape a)
avec un
composé de formule (XII) suivante : YN GP
y (XII)
NHY
dans laquelle GP représente un Groupe Partant tel que -SR, -NTf ou -N
et Y représente un groupement protecteur des amines, notamment Boc ou Fmoc,
pour obtenir un composé de formule (XIII') suivante :
~R~p /R/
q B n q, p (XIII' )
YNH A A
~NHY
NY m m
NY
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- Y représente un groupement protecteur des amines, notamment Boc ou Fmoc.
c) une étape de déprotection des fonctions amines du composé de formule
(XIII') obtenu à
l'étape b) pour obtenir :
* un composé de formule (la) suivante :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
P /R51
-4 -' -1 ,
qB n,B' q, p
HZNyA A'
y NHZ
NH MI (la)
NH
5 dans laquelle n :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
10 - A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2, - R et R' sont indépendamment l'un de l'autre un halogène, tel que
les
15 atomes de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes
de
carbone, linéaire ou ramifié, ou,
* un sel d'acide dérivé d'un composé de formule (la) tel qu'un chlorhydrate,
un formiate,
un trifluoroacétate ou un oxalate (HOOCCOOH).
Par groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié , on
désigne les
groupes méthyle, éthyle, n-propyle et isopropyle.
Des procédures de clivage, ou déprotection, de groupements protecteurs des
fonctions
amines protégées tels que mis en oeuvre dans les étapes a) et c) sont décrites
dans Greene's
Protective Groups in Organic Synthesis Peter G. M. Wuts, Theodora W. Greene,
Wiley . Le
clivage des groupements boc peut en particulier être effectué en milieu acide,
par exemple :
- avec de l'acide chlorhydrique en solution aqueuse ou en solvant organique
(par
exemple le dioxane ou l'éther) (dans ce cas, le composé est obtenu sous forme
du
chlorhydrate), ou,
- avec de l'acide trifluoroacétique, en particulier dans le dichlorométhane
(dans ce cas,
le composé est obtenu sous forme de trifluoroacétate).
Lorsque ces étapes sont réalisées en milieu acide, la forme neutre du composé
peut être
obtenue en neutralisant le milieu après réaction. Cependant, l'isolement des
composés est
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
36
facilité lorsque les composés de formule (la), et en particulier (XI'), sont
sous la forme de sels
d'acide.
L'étape b) permet de former de la fonction guanidine. Cette étape est
généralement
réalisée en présence d'une base, par exemple la triéthylamine ou la
diisopropyléthylamine, et
en solvant organique, tel que le dichlorométhane, bien que l'utilisation
d'autres solvants
organiques soient également possible, par exemple le THF, le méthanol,
l'acétonitrile, le
dioxane, ou un mélange de ces solvants.
Selon un mode de réalisation avantageux, le procédé de préparation, tel que
défini ci-
dessus, d'un composé de formule (IV) comprend:
a) une étape de clivage des groupements protecteurs Y d'un composé de formule
(XX)
suivante
YNH NHY
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12, et Y
représente un
groupement protecteur des amines, notamment Boc ou Fmoc.
pour obtenir :
* un composé de formule (XXI) suivante :
(XXI)
HzN NHz
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12, ou,
* un sel d'acide dérivé d'un composé de formule (XXI) tel qu'un chlorhydrate,
un
formiate, un trifluoroacétate ou un oxalate (HOOCCOOH),
b) une étape de réaction du composé de formule (XXI) formé lors de l'étape a)
avec un
composé de formule (XII) suivante :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
37
YNyGP (XII)
NHY
N
dans laquelle GP représente un Groupe Partant tel que -SR, -NTf ou -N
et Y représente un groupement protecteur des amines, notamment Boc ou Fmoc,
pour obtenir un composé de formule (XXII) suivante :
0 '_k 0
H H
N N
YNH NHY (XXII)
NY YN
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12, et Y
représente un
groupement protecteur des amines, notamment Boc ou Fmoc.
c) une étape de déprotection des fonctions amines du composé de formule (XXII)
obtenu à
l'étape b) pour obtenir :
* un composé de formule (IV) suivante :
i > on o r >
H _ _ H
N N
HzN NH2 (IV)
NH HN
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12, ou,
* un sel d'acide dérivé d'un composé de formule (IV) tel qu'un chlorhydrate,
un formiate,
un trifluoroacétate ou un oxalate (HOOCCOOH).
Les procédures pour les étapes a), b) et c) et leurs caractéristiques sont
telles que décrites
ci-dessus pour la préparation des composés de formule (la).
Selon un autre aspect, l'invention concerne le composé de formule (X')
suivante :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
38
P /R/
I qB n B' q' p
YA / A'Y (X')
m
MI
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 2
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- A et A' représentent indépendamment l'un de l'autre un groupe NH ou un
groupe
NR", dans lequel R" est un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- B et B' représentent indépendamment l'un de l'autre un atome d'oxygène ou un
groupe CH2,
- R et R' représentent indépendamment l'un de l'autre un halogène, tel que les
atomes
de chlore, brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de
carbone,
linéaire ou ramifié,
- Y représente un groupement protecteur des amines, notamment Boc ou Fmoc.
en particulier un composé de formule (XX) suivante :
_ ( )
YNH NHY
dans laquelle n représente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12, et Y
représente un
groupement protecteur des amines, notamment Boc ou Fmoc.
Par groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié , on
désigne les
groupes méthyle, éthyle, n-propyle et isopropyle.
Les composés de formule (X') et (XX) sont nouveaux.
Selon un mode de réalisation de l'invention, le composé de formule (X') telle
que définie
ci-dessus, est un intermédiaire pour la préparation des composés de formule
(I) telle que
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
39
définie ci-dessus, et le composé de formule (XX) telle que définie ci-dessus
est un
intermédiaire pour la préparation des composés de formule (IV) telle que
définie ci-dessus.
L'invention concerne également le procédé de préparation d'un composé de
formule (le),
correspondant à la formule (I) dans laquelle B = O , comprenant:
a) une étape de réaction entre un composé de formule (XXX) suivante :
XXX)
~_kxf (
dans laquelle X
- X et X' représentent indépendamment l'un de l'autre un halogène, notamment
un
chlore, un brome ou un iode,
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
avec un composé de formule (XXXI) suivante :
p
q OH (XXXI)
NC
dans laquelle :
- m représente un nombre entier de 1 à 8,
- q représente un nombre entier de 0 à 2,
- p représente un nombre entier de 0 à 4,
- R représente un halogène, tel que les atomes de chlore, brome, iode ou
fluor, ou un
groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié,
b) suivie d'une étape de réaction avec un composé de formule (XXXII) suivante
:
P
q, OH (XXXII)
NC
dans laquelle : m
- m' représente un nombre entier de 1 à 8,
- q' représente un nombre entier de 0 à 2,
- p' représente un nombre entier de 0 à 4,
- R' représente un halogène, tel que les atomes de chlore, brome, iode ou
fluor, ou un
groupe alkyle de 1 à 3 atomes de carbone, linéaire ou ramifié,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
les étapes a) et b) pouvant être effectuées simultanément (réaction one pot
) ou
successivement,
5 pour obtenir le composé de formule (XXXIII) suivante :
~R~p /R/
A.~
q O
n O q1 P, (XXXIII)
NC
M CN
dans laquelle : m'
10 - n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 1
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
15 brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone,
linéaire ou
ramifié,
c) suivie d'une étape de réaction de Pinner,
20 pour former un composé de formule (Ic) suivante :
A41 1
~R1p
/R~
qO n O P
HZN
NH
M 2
NH MI
NH (le)
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 1
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
41
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(le) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
Les étapes a) et b) ont notamment lieu en milieu basique.
La réaction de Pinner comprend deux étapes : une réaction de la fonction
nitrile avec
l'éthanol en présence d'acide, en particulier l'acide chlorhydrique, suivie
d'une réaction avec
l'ammoniac, pour aboutir à la formation de la fonction amidine.
L'invention concerne également le procédé de préparation d'un composé de
formule (Id)
correspondant à la formule (I) dans laquelle B = CH2, comprenant:
a) une étape d'alkylation d'un composé de formule (XXXIV) suivante :
R~ P /R'
n 4 / /p
(XXXIV)
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
pour obtenir un composé de formule (XXXV) suivante :
P /R'
q p (XXXV)
X
dans laquelle :
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
42
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
- X représente un groupe partant, notamment un atome halogène tel que les
atomes de
chlore, brome, iode
b) suivie d'une ou plusieurs étapes d'homologation pour obtenir le composé de
formule
(XXXVI) suivante
P 4R'
~qn 15 q~1I p(XXXVI)
NC
M CN
MI
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 1
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
c) suivie d'une une étape de réaction de Pinner,
pour former un composé de formule (Id) suivante :
~R~ P /R'
HZN
NH m MI NH 2 (Id)
NH
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
43
dans laquelle :
- n représente un nombre entier compris de 1 à 12, notamment de 1 à 8,
- m et m' représentent indépendamment l'un de l'autre des nombres entiers de 1
à 8,
- q et q' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 2,
- p et p' représentent indépendamment l'un de l'autre des nombres entiers de 0
à 4,
- R et R' sont indépendamment l'un de l'autre un halogène, tel que les atomes
de chlore,
brome, iode ou fluor, ou un groupe alkyle de 1 à 3 atomes de carbone, linéaire
ou
ramifié,
ou un sel d'acide physiologiquement acceptable dérivé d'un composé de formule
(Id) tel
qu'un chlorhydrate, un formiate, un trifluoroacétate ou un oxalate (HOOCCOOH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
44
EXEMPLES
A. Synthèse des composés utilisés comme substances actives
Exemple 1 : Synthèse du 1,6-bis(4-(2-Boc-aminoéthyl) phénoxy)hexane
a)_Synthèse_de_la N-(t-butoxy_çarbonyl)-2-(4-hydroxyphenyl)-ethylamine
O
HN
OH
La tyramine chlorhydrate (1,0 g ; 5,76 mmol ; 1 éq.) est mise en solution dans
un mélange
dioxane/H20 distillée (25/12 mL), puis une solution de NaOH (0,46 g ; 11,5
mmol) dans 10
mL d'eau distillée est ajoutée. L'ensemble est agité 10 min avant l'ajout du
di-tert-butyl-
dicarbonate (Boc2O) (1,26 g ; 5,76 mmol ; 2 éq.). La réaction est laissée une
nuit sous
agitation, sous argon et à température ambiante. Après évaporation du dioxane,
la phase
aqueuse résiduelle est additionnée de 40 mL d'AcOEt, et le pH du mélange est à
abaissé à 7-8
à l'aide d'une solution aqueuse de HC1 1 M. Les phases sont alors séparées et
la phase aqueuse
est lavée par AcOEt (2* 15 mL). Les phases organiques combinées sont ensuite
séchées sur
Na2SO4, filtrées et évaporées. Le brut est ensuite purifié par colonne
chromatographique
(A1203, CH2C12/Hex, 85:15) pour donner la N-(t-butoxycarbonyl)-2-(4-
hydroxyphenyl)-
ethylamine (0,98 g ; 73%).
F : 61-62 C.
IR (KBr) : 3378.9 (-OH; -CONH-) 1686.6 (CO).
UV-Vis (CH2C12) : 277 (1803).
1H-NMR (400 MHz, CDC13) : 1.441 (s, 9 H, tert) ; 2.703 (t, J = 7.9 Hz; 2 H,
CHzCHzN) ;
3.329 (m, 2 H, CHzCHzN) ; 4.602 (s large, 1 H, NH ou OH), 6.023 (s large, 1 H,
NH ou
OH);6.774(d,J=8.3Hz,2H;ArH);7.013 (d, J= 8.3 Hz,2H;ArH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
'3C-NMR (100 MHz, CDC13) : 28.84 (CMe3) ; 35.64 (CHzCHzN) ; 42.49 (CHzCHzN) ;
80.15
(CMe3); 115.97 (Cm); 130.18 (C ); 130.50 (Cv); 155.38 (C;ps ); 156.84 (CO).
Analyse élémentaire calculée pour C13H1903N (237.29): C : 65.80%; H : 8.07%; N
: 5.90%;
trouvée : C : 65.77% ; H : 8.09% ; N : 5.90%.
5 IE MS : 181 [M -(Me)3CO - H + Na] ; 107 [M -(Me)3000(O)NHCH2]*
b)_ Sy_nthèse_ du 116-bis(4--boc-aminoéthyl)hénoxy_)hexane
HN
o- NH o
La N-(t-butoxycarbonyl)-2-(4-hydroxyphenyl)-ethylamine (1,5 g ; 6,32 mmol ;
léq.) est
10 mise en solution dans CH3CN (fraîchement distillée sur CaH2) et additionnée
de K2CO3 (1,74
g ; 12,64 mmol ; 2 éq.). Le mélange est chauffé à reflux sous argon pendant
environ deux
heures avant l'ajout du dichloro-hexane (0,55 mL ; 3,79 mmol ; 0,6 éq.). Après
24 heures à
reflux, 0,3 équivalent de dichloro-hexane sont ajoutés. Après 48 h de
réaction, le retour à
température ambiante est suivi de l'évaporation du solvant. Le brut obtenu est
solubilisé dans
15 le CH2C12 et filtré sur verre fritté afin d'éliminer les impuretés
minérales. Le filtrat est alors
concentré jusqu'à un minimum de solvant et subit une précipitation par
addition de MeOH
accompagné d'une évaporation à froid. Le solide obtenu est alors filtré, rincé
au MeOH et
séché sous vide. Il correspond au composé attendu sous forme d'une poudre
blanche (0,52 g ;
30%).
20 Une variante utilisant le DMF ou un autre amide (diméthylacétamide, N-
methylpyrrolidone par exemple) comme solvant est applicable à température
ambiante.
F : 135-136 C.
IR (KBr) : 3367.7 (CONH) ; 1683.4 (HNCO) ; 1511.3 (NH).
25 UV-Vis (CH2C12): 230 (22884.6) ; 278 (5802.7).
RMN-'H (400 MHz, CDC13) :1.43 (s, 18 H, tert) ; 1.54 (m, 4 H, OCH2CH2CH2) ;
1.81 (t, J =
6.0 Hz, 4 H, OCH2CH2CH2) ; 2.73 (t, J= 6.6 Hz, 4 H, CHzCHzN) ; 3.34 (m, 4 H,
CHzCHzN) ;
3.95 (t, J = 6.5 Hz, 4 H, OCH2CH2CH2) ; 4.51 (s large, 2 H, NH) ; 6.84 (d, J =
8.6 Hz, 4 H,
ArH) ; 7.09 (d, J = 8.6 Hz, 4 H, ArH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
46
RMN-'3C (100 MHz, CDC13) : 26.27 (OCH2CH2CH2) ; 28.80 (CMe3) ; 29.65
(OCH2CH2CH2) ; 35.71 (CHzCHzN) ; 38.57 (CHzCHzN) ; 68.31 (OCH2CH2CH2) ; 76.62
(CMe3) ; 115.07 (C ou Cm) ; 130.06 (C ou Cm) ; 131.28 (Q, 156.26 (Cps ) ;
158.18 (Cgõa).
Analyse élémentaire calculée pour C32H4806N2 (556.73): C : 69.03%, H : 8.68% ;
N :
5.03%; trouvée: C: 68.98%; H: 8.57% ; N: 5.07%.
SM (ES-'-): 557.31 [M + H+]+
Exemple 2 : Synthèse du 1,6-bis(4-(2-guanidinoéthyl) phénoxy)hexane 6.
a)_Synthèse_du 1,6-bis(4-(2-aminoéthy l)_phénoxy_)hexane
CF3000H
H2N
0 \ / CF3000H
NH2
Le 1,6-bis(4-(2-boc-aminoéthyl) phénoxy)hexane (0,5 g ; 0,98 mmol) est mis en
solution
dans le CH2C12 anhydre (40 mL) et est additionné de TFA (5 mL). La réaction
reste sous
agitation et sous atmosphère inerte durant environ 3h30. Le mélange est alors
concentré pour
donner une huile translucide, laquelle est plusieurs fois reprise au
dichlorométhane et
concentrée pour éliminer le maximum de TFA résiduel. Le produit obtenu est
ensuite trituré
dans l'Et20 pour donner un solide blanc qui est alors filtré, lavé à l'Et20 et
séché sous vide. Il
s'agit du composé recherché sous forme de bis(trifluoroacétate) sous forme
d'une poudre
blanche (0,5 g ; 88%).
F :162-163 C.
IR (KBr) : 2956.5 (NH3-'-) ; 1676.7 (NH3+)
UV-Vis (H20) : 195 (9326.7) ; 221 (2238.7).
RMN-'H (400 MHz, DMSO-D6) : 1.46 (m, 4 H, OCH2CH2CH2) ; 1.72 (m, 4 H,
OCH2CH2CH2) ; 2.77 (t, J = 8.4 Hz, 4 H, CH2CH2N) ; 2.98 (m, 4 H, CH2CH2N) ;
3.94 (t, J =
6.3 Hz, 4 H, OCH2CH2CH2) ; 6.88 (d, J= 8.5 Hz, 4 H, ArH) ; 7.15 (d, J= 8.5 Hz,
4 H, ArH) ;
7.78 (s large, 4 H, NH2).
RMN-'3C (100 MHz, DMSO-D6) : 25.68 (OCH2CH2(7H2) ; 29.04 (OCH2CH2CH2) ; 32.56
(CH2CH2N) ; 40.59 (CH2CH2N) ; 67.79 (OCH2CH2CH2) ; 115.00 (C ou Cm) ; 129.34
(Cp) ;
130.01 (C ou Cm) ; 157.95 (Cps0).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
47
Analyse élémentaire calculée pour C26H3406N2F6, 0.5 H20 (593.44) : C : 52.62%
; H
5.94% ; N : 4.72% ; trouvée : C : 52.88% ; H : 6.06% ; N : 4.94%.
SM (ES-'-): 357.34 [M - 2 CF3COOH + H+]+
SM (ES-) : 696.98 [M + CF3COOH - H+]-.
b)_ Sy_nthèse_ du 116-bis~4-(2-(N,N'-di-Boc)guanidinoéthyl)hénoxy_)hexane,
o
o >--O
N
O HN
O NH
N--N \ / O NH O
O
O
Le bis(trifluoroacétate) du 1,6-bis(4-(2-aminoéthyl) phénoxy)hexane (0,3 g ;
0,51 mmol ;
1 éq.) est mis en suspension dans 20 mL de CH2C12 anhydre et solubilisé par
l'ajout d'un
minimum de MeOH. De la triéthylamine Et3N (0,43 mL ; 3,07 mmol ; 6 éq.) est
alors ajoutée,
ainsi que la N,N'-Bis(tert-butoxycarbonyl)-N"-triflylguanidine (0,4 g ; 1,02
mmol ; 2éq.) et le
tout est placé à température ambiante, sous atmosphère inerte et sous
agitation durant 3 h. Le
solvant est alors éliminé par évaporation sous vide. Le brut obtenu est
solubilisé par 30 mL de
CH2C12, lavé par une solution aqueuse de NaHSO4 2M, puis par une solution
aqueuse saturée
de NaHCO3. La phase organique est alors séchée sur Na2SO4, filtrée, concentrée
et séchée
sous vide pour donner le composé attendu sous forme d'une poudre blanche (0,43
g ; 100%).
F : 105-106 C.
IR (KBr) : 3341.7 (CONH) ; 1725.6 (NHCO) ; 1572.0 (NH).
RMN-'H (400 MHz, CDC13) : 1.47 (s, 18 H, tert) ; 1.50 (s, 18 H, tert) ; 1.52
(m, 4 H,
OCH2CH2CH2) ; 1.80 (t, J = 6.5 Hz, 4 H, OCH2CH2CH2) ; 2.80 (t, J = 7.3 Hz,
CHzCHzN) ;
3.62 (q, J = 7.3 Hz, 4 H, CHzCHzN) ; 3.94 (t, J = 6.4 Hz, 4 H, OCH2CH2CH2) ;
6.82 (d, J =
8.5 Hz, 4 H, ArH) ; 7.11 (d, J = 8.5 Hz, 4 H, ArH) ; 8.35 (m, 2 H, CH2CH2NH) ;
11.46 (s
large, 2 H, NH).
RMN-'3C (100 MHz, CDC13) : 26.29 (OCH2CH2CH2) ; 22.44 (CMe3) ; 28.71 (CMe3) ;
29.66
(OCH2CH2CH2) ; 34.82 (CHzCHzN) ; 42.85 (CHzCHzN) ; 68.30 (OCH2CH2CH2) ; 79.53
(CMe3) ; 83.33 (CMe3) ; 115.07 (C ou Cm) ; 130.08 (C ou Cm) ; 130.89 (Q,
153.57,
156.51, 158.23, 164.03 (CO, Cip, et Cgõa).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
48
Analyse élémentaire calculée pour C44H68010N6 (841.05) : C : 62.83% ; H :
8.14% ; N
9.99% ; trouvée : C : 61.26% ; H : 7.84% ; N : 9.99%.
SM (ES-'-): 841.11 [M + H+]+
0-Synthèsedu 1a6-bis(4-(2_guanidinoéthyl_)_phénoxy_)hexane_6.
HN
CF3000H HN O \ / _NH2
H2N~ \ / O NH CF3000H
NH
Le composé 1,6-bis(4-(2-(N,N'-di-Boc)guanidinoéthyl) phénoxy)hexane (0,45 g ;
0,53
mmol) est mis en solution dans le CH2C12 anhydre (30 mL) et est additionné de
TFA (3 mL).
La réaction reste sous agitation et sous atmosphère inerte durant environ 3 h.
Le mélange est
alors concentré pour donner une huile translucide, laquelle est plusieurs fois
reprise au
dichlorométhane et concentrée pour éliminer le maximum de TFA résiduel. Le
produit obtenu
est ensuite trituré dans l'Et20 pour donner un solide blanc qui est alors
filtré, lavé à l'Et20 et
séché sous vide. Il s'agit du composé recherché bis(trifluoroacétate) de 1,6-
bis(4-(2-
guanidinoéthyl) phénoxy)hexane sous forme d'une poudre blanche (0,28 g ; 79%).
F :99-100 C.
IR (KBr) : 2941.0 (NH3-'-) ; 1669.7 (NH3+)
UV-Vis (H20) : 196 (81810.5) ; 223 (19784.3).
RMN-'H (400 MHz, D20) : 1.5 (m, 4 H, OCH2CH2CH2) ; 1.78 (m, 4 H, OCH2CH2CH2) ;
2.80 (t, J= 6.8 Hz, CH2CH2N) ; 3.42 (t, J= 6.7 Hz, 4 H, CH2CH2N) ; 3.94 (t, J=
6.4 Hz, 4 H,
OCH2CH2CH2) ; 6.97 (d, J= 8.3 Hz, 4 H, ArH) ; 7.23 (d, J= 8.3 Hz, 4 H, ArH).
RMN-'H (400 MHz, DMSO-D6) : 1.47 (m, 4 H, OCH2CH2CH2) ; 1.70 (m, 4 H,
OCH2CH2CH2) ; 2.70 (t, J = 7.3 Hz, CHzCHzN) ; 3.32 (m, 4 H, CHzCHzN) ; 3.9 (t,
J = 6.4
Hz, 4 H, OCH2CH2CH2) ; 6.86 (d, J= 8.5 Hz, 4 H, ArH) ; 7.16 (d, J= 8.5 Hz, 4
H, ArH).
RMN-'3C (100 MHz, DMSO-D6) : 25.70 (OCH2CH2CH2) ; 27.93 (OCH2CH2CH2) ; 33.94
(CHzCHzN) ; 42.64 (CHzCHzN) ; 67.76 (OCH2CH2CH2) ; 114.77 (C ou Cm) ; 130.09
(C ou
Cm) ; 130.39 (Cp) ; 157.24, 157.74 (Cps et Cgõa).
Analyse élémentaire calculée pour C28H3806N6F6, 0.5 H20 (677.63) : C : 49.63%,
H :
5.80% ; N : 12.40% ; trouvée : C : 50.09% ; H : 5.50% ; N : 11.81 %.
SM (ES-'-): 555.17 [M - CF3COOH + H+]+ ; 442.31 [M - 2 CF3COOH + 2 H+]+
SM (ES-) : 780.93 [M + CF3COOH - 2 H+]- ; 667.07 [M - H+]-.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
49
Exemple 3 : Synthèse de 1,6-bis(4-(2-guanidinoéthyl) phénoxy)alcanes
Les composés suivants :
^ 1, 1 -bis(4-(2-guanidinoéthyl)phénoxy)méthane,
^ 1,3-bis(4-(2-guanidinoéthyl) phénoxy)propane,
^ 1,4-bis(4-(2-guanidinoéthyl) phénoxy)butane,
^ 1,5-bis(4-(2-guanidinoéthyl) phénoxy)pentane,
^ 1,7-bis(4-(2-guanidinoéthyl)phénoxy)heptane,
^ 1,8-bis(4-(2-guanidinoéthyl) phénoxy)octane,
^ 1,9-bis(4-(2-guanidinoéthyl)phénoxy)nonane
^ 1, 1 0-bis(4-(2-guanidinoéthyl) phénoxy)décane,
^ 1,12-bis(4-(2-guanidinoéthyl) phénoxy)dodécane
sont préparés selon en suivant les protocoles décrits ci-dessus pour aboutir
au 1,6-bis(4-(2-
guanidinoéthyl) phénoxy)hexane (en utilisant respectivement le diiodométhane,
le
dibromopropane, le dibromobutane, le dibromopentane, le dibromoheptane, le
dibromooctane,
le dibromononane, le dibromodécane et le dibromdodécane à la place du dichloro-
hexane), ou
les dichloro-, dibromo-, diiodo ou di-para-toluènes sulfonyl alcanes
correspondants.
Les caractéristiques de ces composés sont décrites ci-après.
1, 1 -bis(4-(2-guanidinoéthyl)phénoxy)méthane = composé 1
RMN-1H (400 MHz, D20) : 2.81(t, J = 6.54 Hz, 4 H, ArCH2CH2N) ; 3.39 (t, J =
6.54 Hz, 4
H, ArCH2CH2N) ; 5.76 (s, 2 H, ArCH2O) ; 7.05 (d, J = 8.32 Hz, 4 H, ArH) ; 7.21
(d, J = 8.28
Hz, 4 H, ArH).
Analyse élémentaire calculée pour Ci9H26N602, 2 CF3COOH (598.5) : C 46.16, H
4.72, N
14.04 ; trouvée : C 45.95, H 4.46, N 13.69.
1,3-bis(4-(2-guanidinoéthyl) phénoxy)propane = composé 3
RMN-1H (400 MHz, D20): 2.12 (t, J = 6.0 Hz, 2 H, CH2CH2CH2) ; 2.73 (t, J= 6.8
Hz, 4 H,
ArCH2CH2N) ; 3.32 (t, J = 6.8 Hz, 4 H, CH2CH2N) ; 4.14 (t, J = 6.0 Hz, 4 H,
ArOCH2CH2) ;
6.89(d,J=8.5Hz,4H,ArH);7.13(d,J=8.5Hz,4H,ArH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
Analyse élémentaire calculée pour C25H3206N6F6, 1/2 H20 (635.55): C 47.24, H
5.23, N
13.22 ; trouvée: C 47.20 ; H 5.57, N 13.52.
1,4-bis(4-(2-guanidinoéthyl) phénoxy)butane = composé 4
5 RMN-1H (400 MHz, D20): 1.83 (t large, 4 H, CH2CH2CH2CH2) ; 2.74 (t, J = 6.55
Hz, 4 H,
ArCH2CH2N) ; 3.32 (t, J= 6.8 Hz, 4 H, ArCH2CH2N) ; 4.04 (t large, 4 H, ArOCH2)
; 6.87 (d,
J=8.3Hz,4H,ArH);7.14(d,J=8.3Hz,4H,ArH).
Analyse élémentaire calculée pour C26H3406N6F6, H2O (658.59): C 47.42, H 5.5
1, N 12.76 ,
trouvée: C 46.98 ; H 5.74, N 13.37.
1,5-bis(4-(2-guanidinoéthyl) phénoxy)pentane = composé 5
RMN-1H (400 MHz, D20): 1.50 (quint, J = 6.55 Hz, 2 H, CH2CH2CH2CH2CH2); 1.72
(quint,
J = 7.0, 4 H, CH2CH2CH2CH2CH2) ; 2.73 (t, J= 6.55 Hz, 4 H, ArCH2CH2N) ; 3.32
(t, J= 6.8
Hz, 4 H, ArCH2CH2N) ; 3.98 (t, J = 6.55, 4 H, ArOCH2) ; 6.87 (d, J = 8.3 Hz, 4
H, ArH) ,
7.13 (d, J= 8.3 Hz, 4 H, ArH).
Analyse élémentaire calculée pour C27H3606N6F6, H2O (672.27): C 48.21, H 5.69,
N 12.49 ,
trouvée: C 48.57 ; H 5.77, N 12.23.
1,7-bis(4-(2-guanidinoéthyl)phénoxy)heptane = composé 7
RMN-1H (400 MHz, D20) : 1.42 (m, 6 H, OCH2CH2CH2) ; 1.72 (m, 4 H,
OCH2CH2CH2) ; 2.81 (t, J = 6.66 Hz, 4 H, ArCH2CH2N) ; 3.39 (t, J = 6.68 Hz, 4
H,
ArCH2CH2N) ; 4.02 (t, J = 6.42 Hz, 4 H, ArOCH2CH2) ; 6.94 (d, J = 8.32 Hz, 4
H, ArH) ;
7.21 (d, J = 8.56 Hz, 4 H, ArH)
Analyses élémentaire calculée pour C25H38N602, 2 CF3COOH (682.65) : C :
51.02%; H :
5.91 %; N : 12.31 % trouvée : C : 50.72%; H : 5.96%; N :12.24%.
1,8-bis(4-(2-guanidinoéthyl) phénoxy)octane = composé 8
RMN-1H (400 MHz, D20): 1.27 (m, 4 H, CH2CH2CH2CH2CH2CH2CH2CH2); 1.34 (m, 4 H,
CH2CH2CH2CH2CH2CH2CH2CH2) ; 1.65, (quint, J = 7.0, 4 H,
CH2CH2CH2CH2CH2CH2CH2CH2) ; 2.73 (t, J = 6.8 Hz, 4 H, ArCH2CH2N) ; 3.32 (t, J
= 6.8
Hz, 4 H, ArCH2CH2N) ; 3.96 (t, J = 6.3, 4 H, ArOCH2) ; 6.87 (d, J= 8.6 Hz, 4
H, ArH) ; 7.13
(d, J = 8.6 Hz, 4 H, ArH).
Analyse élémentaire calculée pour C3oH4206N6F6, 1/2H20 (705.69): C 51.06, H
6.14, N
11.91;trouvée: C51.41;H6.40,N11.56.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
51
1,9-bis(4-(2-guanidinoéthyl)phénoxy)nonane = composé 9
RMN-1H (400 MHz, DMSO-D6) : 1.32 (m, 6 H, OCH2(CH2)7CH2) ; 1.40 (m, 4 H,
CH2CH2CH2) ; 1.69 (m, 4 H, OCH2CH2CH2) ; 2.71 (t, J = 7.20 Hz, 4 H, ArCH2CH2N)
; 3.32
(m, 4 H, ArCH2CH2N) ; 3.92 (t, J = 6.40 Hz, 4 H, OCH2CH2CH2) ; 6,86 (d, J =
8,80 Hz, 4 H,
ArH) ; 7,16 (d, J = 8,40 Hz, 4 H, ArH) ; 7,52 (m, 2 H, NH)
Analyse élémentaire calculée pour C27H42N602, 2 CF3COOH (710,71) : C 52.39, H
6.24, N
11.82 ; trouvée : C 52.07, H 5.95, N 11.62.
1, 1 0-bis(4-(2-guanidinoéthyl) phénoxy)décane = composé 10
RMN-1H (400 MHz, D20): 1.21 (m, 8 H, CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2); 1.32
(m large, 4 H, CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2) ; 1.64, (quint, J = 7.0 Hz, 4
H,
CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2) ; 2.72 (t, J= 6.55 Hz, 4 H, ArCH2CH2N) ; 3.31
(t,
J = 6.55 Hz, 4 H, ArCH2CH2N) ; 3.96 (t, J = 6.54 Hz, 4 H, ArOCH2) ; 6.87 (d, J
= 8.6 Hz, 4
H,ArH);7.13(d,J=8.6Hz,4H,ArH).
Analyse élémentaire calculée pour C32H4606N6F6 (724,73): C 53.03, H 6.40, N
11.60;
trouvée: C 53.29, H 6.49, N 11.66.
1,12-bis(4-(2-guanidinoéthyl) phénoxy)dodécane = composé 12
RMN-1H (400 MHz, D20): 1.26 (m, 12 H, CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2); 1.37
(m large, 4 H, CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2) ; 1.67, (quint, J = 6.86 Hz, 4
H,
CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2) ; 2.70 (t, J= 7.30 Hz, 4 H, ArCH2CH2N) ; 3.29
(t,
J = 6.52 Hz, 4 H, ArCH2CH2N) ; 3.90 (t, J = 6.54 Hz, 4 H, ArOCH2) ; 6.87 (d, J
= 8.56 Hz, 4
H,ArH);7.15(t,J=5.56Hz,4H,ArH);7.56(t,J=5.30Hz,4H,ArH).
Analyses élémentaire calculée pour C3oH48N602, 2 CF3COOH (752.78) : C :
54.25%; H :
6.69%; N : 11.16% trouvée : C : 53.95%; H : 6.92%; N :l 1.07%.
Exemple 4 : Synthèse de bis(4-(amidinoalkyl) phénoxy)alcanes
1) bis(4-(cyanoalkyl)phénoxy)alcane
NC CN
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
52
Le 3-(4-hydroxyphényl)-propionitrile est mis en solution dans CH3CN
(fraîchement
distillée sur CaH2) et additionnée de K2C03. Le mélange est chauffé à reflux
sous argon
pendant environ deux heures avant l'ajout du dichloro-alcane. Après 24 heures
à reflux, 0,3
équivalent de dichloro-alcane est ajouté. Après 48 h de réaction, le retour à
température
ambiante est suivi de l'évaporation du solvant. Le brut obtenu est solubilisé
dans le CH2C12 et
filtré sur verre fritté afin d'éliminer les impuretés minérales. Le filtrat
est alors concentré
jusqu'à un minimum de solvant et subit une précipitation par addition de MeOH
accompagné
d'une évaporation à froid. Le solide obtenu est alors filtré, rincé au MeOH et
séché sous vide.
Autre protocole :
Le 3-(4-hydroxyphenyl)propionitrile [Heymans and coll.; Bioorg. Med. Chem.
2008, 13,
1989-2007] (léq. ) est mis en solution dans 15 mL de DMF (séchée sur CaSO4) et
additionné
de K2C03 (2 éq.) et porté à 70 C pendant 30 minutes avant ajout du
dihalogénoalcane (0.5
éq.). Après une nuit à 70 C, le retour à température ambiante est suivi de
l'addition du
mélange réactionnel à un large volume d'eau, entraînant la formation d'un
précipité blanc. Ce
dernier est alors filtré sur fritté, rincé à l'eau et séché sous vide. Le
solide obtenu est solubilisé
dans un minimum de CH2C12 et de nouveau précipité par l'ajout d'un excès de
MeOH. Après
filtration, lavage au MeOH et séchage on obtient le composé attendu pur, sous
forme de
paillettes blanches.
Des variantes utilisant le DMF en présence de NaH à 50 C ou CH3CN en présence
de
K2C03 à 90 C sont également applicables.
Les chaînes propionitriles de ce composé (bis(4-(cyanoalkyl)phénoxy)alcane)
peuvent être
homologuées grâce au protocole suivant :
a) Hydrolyse en milieu acide pour donner le diacide, puis estérification dans
l'éthanol en
présence d'acide sulfurique, pour donner le diester de formule suivante
Omo( ~O
n
0 0
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
53
Le bis-propionitrile précédemment obtenu est hydrolysé dans un mélange acide
acétique/acide sulfurique concentré/eau à environ 100 C. L'ajout d'eau froide
fait précipiter le
diacide qui est collecté par filtration, lavé à l'eau et séché sous vide. Ce
diacide est ensuite
transformé en diester éthylique par traitement par un mélange acide sulfurique
concentré/éthanol à reflux, suivi d'une précipitation par ajout d'eau,
filtration, lavage à l'eau et
séchage, puis chromatographie si nécessaire.
Une alternative à cette estérification peut être la réaction du diacide avec
deux équivalents
de KOH (ou de CsOH) dans l'eau, suivie d'une lyophilisation, donnant le double
sel de
potassium (ou de césium). Ce sel est mis en réaction avec environ deux
équivalents
d'halogénure (ou tosylate ou mésylate) d'éthyle dans la diméthylformamide
anhydre. Après
contrôle chromatographique de la fin de la réaction, un excès d'eau glacée est
ajouté, pour
donner un précipité du diester (ou une gomme) qui est séparé par filtration
(ou décantation).
Le diester bis(4-(2-(éthoxycarbonyl)-éthyl) phénoxy)alcane brut est purifié
par
chromatographie.
b) Réduction du diester par LiA1H4 pour donner le diol de formule suivante :
HO / / OH
Le diester éthylique précédemment obtenu est traité dans le THF (ou le
diéthyléther)
anhydre par un équivalent d'hydrure d'aluminium lithium. Un contrôle
chromatographique
intégrant un traitement de l'échantillon selon le standard de cette réaction
est effectué avant
l'arrêt de la réaction. L'excès d'hydrure est détruit par addition
précautionneuse d'eau, ou
d'acétate d'éthyle. Le résidu solide est éliminé par filtration, et
l'évaporation sous vide du
filtrat donne le bis(4-(hydroxypropyl) phénoxy)alcane recherché. Ce dernier
peut être purifié
sur une courte colonne de silice ou d'alumine.
c) Halogénation du diol par le tétrachlorure de carbone en présence de
triphénylphosphine
pour donner le composé dihalogèné de formule suivante :
Omo( j~O
n
ci ci
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
54
Le bis(4-(hydroxypropyl) phénoxy)alcane précédent est solubilisé dans le
dichlorométhane,
avec deux équivalent de triphénylphosphine. La solution est refroidie à 0 C,
et un excès de
tétrachlorure de carbone est ajouté. Le milieu réactionnel est agité à
température ambiante et
la réaction est suivie par chromatographie; quand tout le diol a disparu, les
solvants sont
évaporés et le résidu est chromatographié sur silice ou alumine pour donner le
bis(4-
(chloropropyl) phénoxy)alcane recherché.
Le dérivé dibromé peut être obtenu de façon similaire en remplaçant le
tétrachlorure de
carbone par le tétrabromure de carbone.
Une alternative de synthèse peut être l'addition d'un excès de chlorure de
thionyle à 0 C à
une solution de diol dans le dichlorométhane anhydre. La réaction est suivie
par
chromatographie. Lorsque l'alcool est consommé, le solvant et l'excès de
chlorure de thionyle
sont distillés ou évaporés sous vide, pour donner le dérivé dichloré brut, qui
peut être
chromatographié.
d) Substitution nucléophile par du NaCN sur le composé dihalogène dans un
solvant
favorisant la substitution, pour donner le bis(4-(cyanoalkyl)phénoxy)alcane
homologué de
formule suivante :
04nO
NC / / CN
Le bis(4-(chloropropyl) phénoxy)alcane précédent est dissout dans le
diméthylsulfoxyde
sec, et seize équivalents de cyanure de potassium (ou de sodium) sont ajoutés
en une fois. Le
mélange est chauffé sous atmosphère inerte à 80 C. La réaction est suivie par
chromatographie. Quand tout le dérivé dichloré a été consommé, le mélange est
refroidi à
température ambiante et de l'eau glacée est ajoutée pour donner un précipité
(ou une gomme),
isolé par filtration ou décantation. Après séchage, le solide ou la gomme
obtenu est
chromatographié pour donner le bis(4-(cyanopropyl) phénoxy)alcane recherché.
L'ensemble des étapes a-d est itératif.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
a) Exemple de Synthèse du 1,3-bis(4-(2-cyanoéthyl) phénoxy)propane
O-(CH2)3-O
NC CN
Le 3-(4-hydroxyphenyl)propionitrile [Heymans and coll.; Bioorg. Med. Chem.
2008, 13,
1989-2007(1,0 g, 6.79 mmol, léq. ) est mis en solution dans 15 mL de DMF
(séchée sur
5 CaSO4) et additionné de K2C03 (1.87 g, 13.58 mmol, 2 éq.) et porté à 70 C,
pendant 30
minutes avant ajout du dibromopropane (0.68 g, 3.39 mmol, 0.5 éq.). Après une
nuit à 70 C le
retour à température ambiante est suivi de l'addition du mélange réactionnel à
un large
volume d'eau, entraînant la formation d'un précipité blanc. Ce dernier est
alors filtré sur fritté,
rincé à l'eau et séché sous vide. Le solide obtenu est solubilisé dans un
minimum de CH2C12
10 et de nouveau précipité par l'ajout d'un excès de MeOH. Après filtration,
lavage au MeOH et
séchage on obtient le composé attendu pur, sous forme de paillettes blanches
(0.45 g, 41 %).
Des variantes utilisant le DMF en présence de NaH à 50 C ou CH3CN en présence
de
K2C03 à 90 C sont également applicables.
15 RMN-'H (400 MHz, CDC13): 2.24 (q, J = 6.1 Hz, 2 H, OCH2CH2) ; 2.57 (t, J =
7.3 Hz, 4 H,
CH2CH2CN) ; 2.88 (t, J = 6.3 Hz, 4 H, CH2CH2CN) ; 4.14 (t, J = 6.0 Hz, 4 H,
OCH2CH2) ;
6.88(d,J=8.6Hz,4H,ArH );7.14(d,J=8.6Hz,4H,ArHm).
RMN-'3C (100 MHz, CDC13): 19.67 (CHzCHzCN) ; 29.28 (OCH2CH2) ; 30.74
(CH2CH2CN)
64.44 (OCH2CH2) ; 114.84 (C ) ; 119.33 (CN) ; 129.38 (Cm) ; 130.28 (Q, 158.03
(Cps ).
20 Analyse élémentaire calculée pour C21H2202N2 (334.41): C: 75.42 % ; H: 6.63
%, N: 8.38 %
trouvée: C: 75.51 %, H: 6.70 %, N: 8.42 %.
SM (ES-'-): 335.17 [M + H+]+; 357.16 [M + Na+]+
b) Synthèse de composés analogues
25 Les composés
- 1,4-bis(4-(2-cyanoéthyl) phénoxy)butane,
- 1,5-bis(4-(2-cyanoéthyl) phénoxy)pentane,
- 1,6-bis(4-(2-cyanoéthyl) phénoxy)hexane,
- 1,7-bis(4-(2-cyanoéthyl) phénoxy)heptane,
30 - 1,8-bis(4-(2-cyanoéthyl) phénoxy)octane,
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
56
- 1,9-bis(4-(2-cyanoéthyl) phénoxy)nonane,
- 1, 1 0-bis(4-(2-cyanoéthyl) phénoxy)decane
sont préparés en suivant les protocoles décrits ci-dessus pour aboutir au 1,1-
bis(4-(2-
cyanoéthyl) phénoxy)méthane (en utilisant respectivement le dibromopropane, le
dibromobutane, le dibromopentane, le dibromohexane, le dibromoheptane, le
dibromooctane,
le dibromononane et le dichlorodécane à la place du dichlorométhane), ou les
dichloro- ou
diiodo ou di-para-toluènes sulfonyl alcanes correspondants.
Les caractéristiques de ces composés sont décrites ci-après.
1,4-bis(4-(2-cyanoéthyl) phénoxy)butane
RMN-'H (400 MHz, CDC13): 1.97 (m, 4 H, OCH2CH2) ; 2.57 (t, J = 7.3 Hz, 4 H,
CH2CH2CN) ; 2.89 (t, J = 7.3 Hz, 4 H, CH2CH2CN) ; 4.02 (t, J = 5.0 Hz, 4 H,
OCH2CH2) ;
6.87 (d,J=8.6Hz,4H,ArHo);7.15(d,J=8.6Hz,4H,ArHm).
RMN-'3C (100 MHz, CDC13): 19.67 (CHzCHzCN) ; 29.28 (OCH2CH2) ; 30.74
(CH2CH2CN)
64.44 (OCH2CH2) ; 114.84 (Q, 119.33 (CN) ; 129.38 (Cm) ; 130.28 (Cp) ; 158.03
(Cps0).
Analyse élémentaire calculée pour C21H2202N2 (348.44): C: 75.83 % ; H: 6.94 %,
N: 8.03 %
trouvée: C: 75.37 %, H: 6.88 %, N: 7.86 %.
1,5-bis(4-(2-cyanoéthyl) phénoxy)pentane
RMN-'H (400 MHz, CDC13): 1.63 (m, 2 H, OCH2CH2CH2) ; 1.86 (m, 4 H, OCH2CH2CH2)
;
2.58 (t, J= 7.3 Hz, 4 H, CH2CH2CN) ; 2.90 (t, J= 6.3 Hz, 4 H, CH2CH2CN) ; 3.97
(t, J= 6.3
Hz,2H,OCH2);6.86(d,J=8.3Hz,4H,ArH);7.14(d,J=8.6Hz,4H,ArH).
RMN-'3C (100 MHz, CDC13): 20.12 (CH2CH2CN) ; 23.15 (OCH2CH2CH2) ; 29.43
(OCH2CH2CH2) ; 31.18 (CH2CH2CN) ; 68.19 (OCH2) ; 115.23 (C) ; 119.71 (CN) ;
129.73
(Cm) ; 130.45 (Cp) ; 158.63 (Cps0).
Analyse élémentaire calculée pour C23H2602N2 (362.46): C: 76.21 % ; H: 7.23 %,
N: 7.73 %
trouvée: C: 76.16%; H: 7.19%; N: 7.84%.
1,6-bis(4-(2-cyanoéthyl) phénoxy)hexane
RMN-'H (400 MHz, CDC13): 1.54 (q, OCH2CH2CH2) ; 1.81 (m, 4 H, OCH2CH2CH2) ;
2.57
(t, J= 7.3 Hz, 4 H, CH2CH2CN) ; 2.89 (t, J= 7.3 Hz, 4 H, CH2CH2CN) ; 3.96 (t,
J= 5.0 Hz, 4
H,OCH2);6.86(d,J=8.6Hz,4H,ArHo); 7.14 (d, J= 8.6 Hz,4H,ArHm).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
57
RMN-13C (100 MHz, CDC13): 20.02 (CHz(7HzCN) ; 26.29, 26.62 (OCH2(7H2CH2 et
OCH2CH2CH2) ; 31.16 (CH2CH2CN) ; 68.27 (OCH2) ; 115.23 (C) ; 119.75 (CN) ;
129.74
(Cm) ; 130.44 (Q, 158.68 (Cps0).
Analyse élémentaire calculée pour C24H2802N2 (376.22): C: 76.56 % ; H: 7.46 %,
N: 7.44
; trouvée: C: 76.22 %, H: 7.42 %, N: 7.13 %.
1,7-bis(4-(2-cyanoéthyl) phénoxy)heptane
RMN-'H (400 MHz, CDC13): 1.46 (m, 6 H, OCH2CH2CH2CH2) ; 1.76 (m, 4 H,
OCH2CH2CH2CH2) ; 2.57 (t, J = 7.3 Hz, 4 H, CH2CH2CN) ; 2.89 (t, J = 7.3 Hz, 4
H,
CH2CH2CN) ; 3.94 (t, J = 6.5 Hz, 4 H, OCH2CH2) ; 6.86 (d, J = 8.6 Hz, 4 H,
ArH0) ; 7.13 (d,
J= 8.6 Hz,4H,ArHm).
RMN-13C (100 MHz, CDC13): 19.73 (CH2CH2CN) ; 26.04, 29.17, 29.24
(OCH2CH2CH2CH2)
30.82 (CHzCHzCN) ; 67.98 (OCH2) ; 114.85 (Co) ; 119.36 (CN) ; 129.35 (Cm) ;
130.02 (Q,
158.32 (Cps0).
Analyse élémentaire calculée pour C25H3002N2 (390.52): C: 76.89 % ; H: 7.74 %,
N: 7.17
trouvée: C: 75.94 %, H: 7.80 %, N: 7.07 %.
1,8-bis(4-(2-cyanoéthyl) phénoxy)octane
RMN-'H (400 MHz, CDC13): 1.40 (m, 4H, OCH2CH2CH2CH2) ; 1.46 (m, 4 H,
OCH2CH2CH2) ; 1.78 (m, 4 H, OCH2CH2) ; 2.57 (t, J = 7.3 Hz, 4 H, CH2CH2CN) ;
2.88 (t, J
= 7.3 Hz, 4 H, CH2CH2CN) ; 3.94 (t, J= 5.0 Hz, 4 H, OCH2) ; 6.56 (d, J= 8.6
Hz, 4 H, ArH)
7.14(d,J=8.6Hz,4H,ArH).
RMN-13C (100 MHz, CDC13): 19.70 (CHzCHzCN); 26.01 (OCH2CH2CH2CH2), 29.26,
29.32
(OCH2CH2CH2 et OCH2CH2CH2) ; 31.78 (CH2CH2CN) ; 67.99 (OCH2) ; 114.83 (C)
119.35 (CN) ; 129.33 (Cm) ; 129.99 (Q, 158.32 (Cps0).
Analyse élémentaire calculée pour C26H3202N2 (404.54): C: 77.19 % ; H: 7.97 %,
N: 6.92
trouvée: C: 76.75 %, H: 7.80 %, N: 7.66 %.
1,9-bis(4-(2-cyanoéthyl) phénoxy)nonane
RMN-'H (400 MHz, CDC13): 1.36 (m, 6 H, OCH2CH2CH2CH2CH2) ; 1.45 (m, 4 H,
OCH2CH2CH2) ; 1.78 (q, 4 H, OCH2CH2) ; 2.58 (t, J= 7.3 Hz, 4 H, CHzCHzCN) ;
2.89 (t, J=
7.3 Hz, 4 H, CH2CH2CN) ; 3.93 (t, J = 6.5 Hz, 4 H, OCH2CH2) ; 6.85 (d, J = 8.6
Hz, 4 H,
ArH);7.13(d,J=8.6Hz,4H,ArH).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
58
RMN-'3C (100 MHz, CDC13): 20.12 (CH2CH2CN) ; 26.44, 29.66, 29.71, 29.88
(OCH2CH2CH2CH2CH2) ; 31.19 (CH2CH2CN) ; 68.40 (OCH2) ; 115.22 (C ) ; 119.71
(CN) ,
129.70 (Cm) ; 130.34 (Q, 158.72 (Cps ).
Analyse élémentaire calculée pour C27H3402N2 (418.57): C: 77.48 %, H: 8.19 % ;
N: 6.69 %
;trouvée: C: 77.35%;H:8.12%;N:6.76%.
1,10-bis(4-(2-cyanoéthyl) phénoxy)décane
RMN-'H (400 MHz, CDC13): 1.33 (m, 8 H, OCH2CH2CH2CH2CH2) ; 1.45 (m, 4 H,
OCH2CH2CH2) ; 1.78 (q, 4 H, OCH2CH2) ; 2.58 (t, J= 7.4 Hz, 4 H, CH2CH2CN) ;
2.89 (t, J=
7.4 Hz, 4 H, CH2CH2CN) ; 3.93 (t, J = 6.5 Hz, 4 H, OCH2CH2) ; 6.85 (d, J = 8.6
Hz, 4 H,
ArH);7.13(d,J=8.6Hz,4H,ArH).
RMN-'3C (100 MHz, CDC13): 19.75 (CH2CH2CN) ; 26.10, 29.32, 29.42, 29.55
(OCH2CH2CH2CH2CH2) ; 30.83 (CH2CH2CN) ; 68.08 (OCH2) ; 114.88 (C ) ; 119.37
(CN),
129.35 (Cm) ; 130.00 (Q, 158.38 (Cps ).
Analyse élémentaire calculée pour C28H3602N2, 1/6 CH2C12 (446.75): C: 75.72 %
; H: 8.19
%, N: 6.27 %, trouvée: C: 75.66 %, H: 8.17 %, N: 6.21 %.
2) bis(4-(amidinoalkyl) phénoxy)alcane
lue/ n
H2N NH2
M~
NH NH
Une solution de dérivé bis(4-(cyanoalkyl) phénoxy)alcane dans un mélange
d'éthanol et de
benzène anhydre est refroidie à 0 C, puis est traitée par barbotage d'acide
chlorhydrique
gazeux durant 1 heure environ. La solution acide est conservée à 4 C durant
plusieurs jours.
La part volatile d'acide chlorhydrique est éliminée par barbotage d'azote sec,
et la solution
dégazée est évaporée à sec sous pression réduite. Le résidu d'évaporation,
contenant le
dichlorhydrate de bis(4-(éthyl)imidatoalkyl) phénoxy)alcane est repris par une
solution 1M
d'ammoniac dans l'éthanol. Le mélange est chauffé à 50-60 C en conditions
anhydres durant
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
59
2-3h, puis est laissé sous agitation à température ambiante durant la nuit. Le
milieu résultant
est filtré, puis du diéthyléther est additionné, provoquant la précipitation
du dichlorhydrate de
bis(4-(amidinoalkyl) phénoxy)alcane recherché.
Autre protocole en deux étapes, isolant les composés imidates intermédiaires
EtO OO OEt
n
m
HCI ; HN NH ; HCI
Le composé bis(4-(cyanoalkyl)phénoxy)alcane est mis en solution dans un
mélange
EtOH/benzène et l'on y fait buller, sous agitation à 4 C, HC1 gaz pendant
environ deux
heures. Le mélange est ensuite laissé sous agitation, à température ambiante
pendant 48h
avant l'évaporation sous vide des solvants. L'huile obtenue est ensuite
solubilisée dans un
minimum d'EtOH et le bis-imidate attendu est précipité par ajout d'un large
excès d'Et20. Le
précipité blanc est alors filtré sur fritté, lavé à l'Et20 et séché sous vide.
On obtient le
composé recherché sous forme d'une poudre blanche.
Le bis-chlorhydrate du bis(4-[(imidato)alkyl) phénoxy)alcane est mis en
solution dans
EtOH et l'on y fait buller NH3 gazeux pendant environ lh30. Le milieu est
ensuite passé à
reflux sous argon pendant 5 à 6 h. Le retour à température ambiante est suivi
de la
précipitation du sel de bis-amidine par ajout d'un excès d'Et20 dans le
milieu. Le précipité est
filtré, lavé à l'éther et séché sous vide. On obtient le produit attendu sous
forme d'une poudre
blanche.
a) Exemples de synthèse de composés imidates
* 1,3-bis(4-(3-(éthyl-propanimidoate) phénoxy)propane, bis chlorhydrate
EtO O_(CH2~-0 OEt
3
HCI ; HN NH; HCI
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
Le composé 1,3-bis(4-(2-cyanoéthyl) phénoxy)propane (0.24 g, 0.72 mmol) est
mis en
solution dans un mélange EtOH/benzène (7/15 mL) et l'on y fait buller, sous
agitation à 4 C,
HC1 gaz pendant environ deux heures. Le mélange est ensuite laissé sous
agitation, à
température ambiante pendant 48h avant l'évaporation sous vide des solvants.
L'huile
5 obtenue est ensuite solubilisée dans un minimum d'EtOH et le bis-imidate
attendu est
précipité par ajout d'un large excès d'Et20. Le précipité blanc est alors
filtré sur fritté, lavé à
l'Et20 et séché sous vide. On obtient le composé recherché sous forme d'une
poudre blanche
(0.24 g, 67%).
RMN-'H (400 MHz, DMSO-D6): 1.31 (t, J = 6.9 Hz, 6 H, OCH2CH3) ; 2.14 (m, 4 H,
10 OCH2CH2) ; 2.88 (s large, 8 H, ArCH2CH2) ; 4.09 (t, J= 6.1 Hz, 4 H, OCH2) ;
4.36 (q, J= 6.8
Hz, 4H,OCH2CH3);6.90(d,J=8.6Hz,4H,ArH); 7.16(d,J=8.6Hz,4H,ArH);11.06,
11.79 (s large, 4 H, NH2C1).
Analyse élémentaire calculée pour C25H3604N2C12, 0.75 H20 (512.98): C: 58.53 %
; H: 7.36
%, N: 5.46 %, trouvée: C: 58.62 %, H: 7.26 %, N: 5.54 %.
* Composés analogues
Les composés suivants :
- 1,4-bis(4-(3-(éthyl-propanimidoate) phénoxy)butane, bis chlorhydrate
- 1,5-bis(4-(3-(éthyl-propanimidoate) phénoxy)pentane, bis chlorhydrate
- 1,6-bis(4-(3-(éthyl-propanimidoate) phénoxy)hexane, bis chlorhydrate
- 1,7-bis(4-(3-(éthyl-propanimidoate) phénoxy)heptane, bis chlorhydrate
- 1,8-bis(4-(3-(éthyl-propanimidoate) phénoxy)octane, bis chlorhydrate
- 1,9-bis(4-(3-(éthyl-propanimidoate) phénoxy)nonane, bis chlorhydrate
- 1, 1 0-bis(4-(3 -(éthyl-propanimidoate) phénoxy)decane, bis chlorhydrate
sont préparés en suivant les protocoles décrits ci-dessus pour aboutir au 1,3-
bis(4-(3-(éthyl-
propanimidoate) phénoxy)propane, bis chlorhydrate.
Les caractéristiques de ces composés sont décrites ci-après.
1,4-bis(4-(3-(éthyl-propanimidoate) phénoxy)butane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.32 (t, J = 7.1 Hz, 6 H, OCH2CH3) ; 1.85 (s large,
4 H,
OCH2CH2) ; 2.88 (s large, 8 H, ArCH2CH2) ; 4.00 (s large, 4 H, OCH2) ; 4.36
(q, J= 6.8 Hz,
4H,OCH2CH3);6.88(d,J=8.6Hz,4H,ArH); 7.15 (d, J= 8.6 Hz,4H,ArH);10.98,
11.68 (s larges, NH2C1).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
61
Analyse élémentaire calculée pour C26H3804N2C12, 1.5 H20 (540.53): C: 57.77 %
; H: 7.64
%;N:5.18%;trouvée: C: 57.89%; H: 7.50%; N: 5.22%.
1,5-bis(4-(3-(éthyl-propanimidoate) phénoxy)pentane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.32 (t, J = 7.1 Hz, 6 H, OCH2CH3) ; 1.56 (m, 2 H,
OCH2CH2CH2) ; 1.76 (q, 4 H, OCH2CH2) ; 2.88 (s large, 8 H, ArCH2CH2) ; 3.95
(t, J = 6.3
Hz, 4 H, OCH2) ; 4.36 (q, J = 7.1 Hz, 4 H, OCH2CH3) ; 6.87 (d, J = 8.6 Hz, 4
H, ArH) ; 7.14
(d, J= 8.6 Hz, 4 H, ArH) ; 10.96, 11.72 (s large, 4 H, NH2C1).
Analyse élémentaire calculée pour C27H4004N2C12, 0.5 H20 (536.53): C: 60.44 %
; H: 7.70
%, N: 5.22 %, trouvée: C: 60.40 %, H: 7.67 %, N: 5.41 %.
1,6-bis(4-(3-(éthyl-propanimidoate) phénoxy)hexane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.32 (t, J = 7.1 Hz, 6 H, OCH2CH3) ; 1.46 (s large,
4 H,
OCH2CH2CH2) ; 1.70 (m, 4 H, OCH2CH2) ; 2.87 (s large, 8 H, ArCH2CH2) ; 3.93
(t, J = 6.3
Hz, 4 H, OCH2) ; 4.36 (q, J = 7.1 Hz, 4 H, OCH2CH3) ; 6.87 (d, J = 8.6 Hz, 4
H, ArH) ; 7.14
(d, J= 8.6 Hz, 4 H, ArH) ; 11.04, 11.64 (s large, 4 H, NH2C1).
Analyse élémentaire calculée pour C28H4204N2C12, 0.5 H20 (550.56): C: 61.09 %
; H: 7.87
%, N: 5.08 %, trouvée: C: 60.91 %, H: 7.77 %, N: 5.20 %.
1,7-bis(4-(3-(éthyl-propanimidoate) phénoxy)heptane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.32 (t, J = 7.0 Hz, 6 H, OCH2CH3) ; 1.40 (s large,
6 H,
OCH2CH2CH2CH2) ; 1.70 (m, 4 H, OCH2CH2) ; 2.88 (s large, 8 H, ArCH2CH2) ; 3.93
(t, J =
6.4 Hz, 4 H, OCH2) ; 4.36 (q, J = 7.1 Hz, 4 H, OCH2CH3) ; 6.86 (d, J = 8.6 Hz,
4 H, ArH) ;
7.14 (d, J= 8.6 Hz, 4 H, ArH) ; 11.14, 11.58 (s large, 4 H, NH2C1).
Analyse élémentaire calculée pour C29H4404N2C12, 0.75 H20 (568.99): C: 61.21 %
; H: 8.05
% ; N: 4.92 % ; trouvée: C: 64.41 % ; H: 7.95 % ; N: 5.11 %.
1,8-bis(4-(3-(éthyl-propanimidoate) phénoxy)octane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.32 (t, J = 7.1 Hz, 6 H, OCH2CH3) ; 1.33 (s large,
4 H,
OCH2CH2CH2CH2) ; 1.41 (s large, 4 H, OCH2CH2CH2) ; 1.69 (q, 4 H, OCH2CH2) ;
2.88 (s
large, 8 H, ArCH2CH2) ; 3.92 (t, J = 6.4 Hz, 4 H, OCH2) ; 4.36 (q, J = 7.1 Hz,
4 H,
OCH2CH3);6.86(d,J=8.3Hz,4H,ArH);7.14(d,J=8.6Hz,4H,ArH);10.99,11.73(s
large, 4 H, NH2C1).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
62
Analyse élémentaire calculée pour C2oH4604N2C12, 0.5 H20 (578.61): C: 62.27 %
; H: 8.18
% ; N: 4.84 %, trouvée: C: 62.23 %, H: 8.09 % ; N: 5.05 %.
1,9-bis(4-(3-(éthyl-propanimidoate) phénoxy)nonane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.32 (m, 12 H, OCH2CH2CH2CH2CH2 et OCH2CH3) ; 1.40
(m, 4 H, OCH2CH2CH2) ; 1.69 (q, 4 H, OCH2CH2) ; 2.87 (s large, 8 H, ArCH2CH2)
; 3.92 (t, J
=6.4Hz,4H,OCH2);4.35(q,J=7.1Hz,4H,OCH2CH3);6.86(d,J=8.6Hz,4H,ArH);
7.14 (d, J= 8.6 Hz, 4 H, ArH) ; 10.91, 11.48 (s large, 4 H, NH2C1).
Analyse élémentaire calculée pour C31H4804N2C12, 0.25 H20 (588.13): C: 63.30 %
; H: 8.31
%;N:4.76% ; trouvée: C: 63.42%;H: 8.23 %, N: 4.95 %.
1,10-bis(4-(3-(éthyl-propanimidoate) phénoxy)decane, bis chlorhydrate
RMN-'H (400 MHz, DMSO-D6): 1.30 (s large, 6 H, OCH2CH2CH2CH2CH2) ; 1.32 (t, J=
7.1
Hz, 6 H, OCH2CH3) ; 1.40 (m, 4 H, OCH2CH2CH2) ; 1.68 (q, 4 H, OCH2CH2) ; 2.87
(s large,
8 H, ArCH2CH2) ; 3.91 (t, J = 6.4 Hz, 4 H, OCH2) ; 4.35 (q, J = 7.1 Hz, 4 H,
OCH2CH3) ,
6.86 (d, J = 8.6 Hz, 4 H, ArH) ; 7.14 (d, J = 8.6 Hz, 4 H, ArH) ; 10.92, 11.65
(s large, 4 H,
NH2C1).
Analyse élémentaire calculée pour C32H5004N2C12, 0.5 H20 (606.67): C: 63.35 %
; H: 8.47
%, N: 4.61 %, trouvée: C: 63.20 %, H: 8.47 %, N: 4.61 %.
b) Exemples de synthèse de composés amidines
* 1,3-bis(4-(2-(amidino)éthyl)phénoxy)propane, bis chlorhydrate; composé 103
HCI ; HZN O+HZ~-O / \ NHZ ; HCI
3
HN NH
Le bis-chlorhydrate du 1,3-bis(4-(3-(éthy_l-propanimidoate)phénoxy_)propane
(0.17 g,
0.34 mmol) est mis en solution dans 15 mL d'EtOH et l'on y fait buller NH3
pendant environ
lh30. Le milieu est ensuite passé à reflux sous argon pendant 5 à 6 h. Le
retour à température
ambiante est suivi de la précipitation du bis-amidine par ajout d'un excès
d'Et20 dans le
milieu. Le précipité est filtré, lavé à l'éther et séché sous vide. On obtient
le produit attendu
sous forme d'une poudre blanche (0.13 g, 88%).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
63
RMN-'H (400 MHz, DMSO-D6): 2.15 (t, J= 6.1 Hz, 2 H, OCH2CH2) ; 2.64 (t, J= 7.8
Hz, 4
H, ArCH2CH2 ou ArCH2CH2) ; 2.88 (t, J= 7.8 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ;
3.32 (s,
2H,NH);4.10(t,J=6.3Hz,4H,OCH2);6.90(d,J=8.6Hz,4H,ArH);7.16(d,J=8.6
Hz, 4 H, ArH) ; 8.64, 9.04 (s larges, 6 H, NH3).
RMN-'H (400 MHz, D20): 2.06 (t, J = 5.8 Hz, 2 H, OCH2CH2) ; 2.63 (t, J = 7.3
Hz, 4 H,
ArCH2CH2 ou ArCH2CH2) ; 2.85 (t, J = 7.2 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 4.04
(t, J =
5.8 Hz, 4 H, OCH2) ; 6.83 (d, J= 8.3 Hz, 4 H, ArH) ; 7.11 (d, J= 8.1 Hz, 4 H,
ArH).
RMN-13C (100 MHz, D20): 28.66, 31.55, 34.40 (OCH2CH2, ArCH2CH2) ; 65.56 (OCH2)
115.37 (Q, 130.09 (Cm) ; 131.91 (CN) ; 157.26 (Cps0) ; 170.72 (Ca.m,;aine).
Analyse élémentaire calculée pour C21H3002N4C12, 0.5 H20 (450.39): C: 56.00 %
; H: 6.93
%, N: 12.43 %, trouvée: C: 56.13 %, H: 6.79 %, N: 12.61 %.
* Composés analogues
Les composés suivants :
- 1,4-bis(4-(2-(amidino)éthyl)phénoxy)butane, bis-chlorhydrate
- 1,5-bis(4-(2-(amidino)éthyl)phénoxy)pentane, bis-chlorhydrate
- 1,6-bis(4-(2-(amidino)éthyl)phénoxy)hexane, bis-chlorhydrate
- 1,7-bis(4-(2-(amidino)éthyl)phénoxy)heptane, bis-chlorhydrate
- 1,8-bis(4-(2-(amidino)éthyl)phénoxy)octane, bis-chlorhydrate
- 1,9-bis(4-(2-(amidino)éthyl)phénoxy)nonane, bis-chlorhydrate
- 1, 1 0-bis(4-(2-(amidino)éthyl)phénoxy)decane, bis-chlorhydrate
sont préparés en suivant les protocoles décrits ci-dessus pour aboutir au 1,3-
bis(4-(2-
(amidino)éthyl)phénoxy)propane, bis-chlorhydrate .
Les caractéristiques de ces composés sont décrites ci-après.
1,4-bis(4-(2-(amidino)éthyl)phénoxy)butane, bis-chlorhydrate; composé 104
RMN-'H (400 MHz, DMSO-D6): 1.85 (s large, 4 H, OCH2CH2) ; 2.64 (t, J = 7.8 Hz,
4 H,
ArCH2CH2 ou ArCH2CH2) ; 2.88 (t, J = 7.8 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 3.31
(s, 2
H, NH) ; 4.00 (s large, 4 H, OCH2); 6.89 (d, J = 8.3 Hz, 4 H, ArH) ; 7.16 (d,
J = 8.5 Hz, 4 H,
ArH) ; 8.58, 9.00 (s larges, 6 H, NH3).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
64
RMN-'H (400 MHz, D20): 1.76 (s large, 2 H, OCH2CH2) ; 2.62 (t, J = 7.4 Hz, 4
H,
ArCH2CH2 ou ArCH2CH2) ; 2.85 (t, J = 7.3 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 3.95
(s
large, 4 H, OCH2) ; 6.82 (d, J = 8.6 Hz, 4 H, ArH) ; 7.11 (d, J = 8.3 Hz, 4 H,
ArH).
RMN-13C (100 MHz, D20): 25.42, 31.56, 34.41 (OCH2CH2, ArCH2CH2) ; 68.51 (OCH2)
115.40 (Q, 130.10 (Cm) ; 131.86 (CN) ; 157.26 (Cpso) ; 170.72 (Camidine).
Analyse élémentaire calculée pour C22H3202N4C12, 0.5 H20 (464.43): C: 56.89 %
; H: 6.94
%, N: 12.06 %, trouvée: C: 57.31 % ; H: 7.40 %, N: 11.41 %.
1,5-bis(4-(2-(amidino)éthyl)phénoxy)pentane, bis-chlorhydrate; composé 105
RMN-'H (400 MHz, DMSO-D6): 1.56 (m, 2 H, OCH2CH2CH2) ; 1.76 (q, 4 H, OCH2CH2);
2.63 (t, J = 7.5 Hz, 4 H, ArCH2CH2 ou ArCH2CH2); 2.87 (t, J = 7.5 Hz, 4 H,
ArCH2CH2 ou
ArCH2CH2); 3.94 (t, J = 6.3 Hz, 4 H, OCH2); 6.87 (d, J = 8.9 Hz, 4 H, ArH);
7.14 (d, J = 7.8
Hz, 4 H, ArH); 8.58, 8.94 (s larges, 6 H, NH).
RMN-'H (400 MHz, D20): 1.55 (q, 2 H, OCH2CH2CH2) ; 1.78 (q, 4 H, OCH2CH2);
2.73 (t, J
= 7.4 Hz, 4 H, ArCH2CH2 ou ArCH2CH2); 2.95 (t, J = 7.4 Hz, 4 H, ArCH2CH2 ou
ArCH2CH2); 4.03 (t, J = 6.3 Hz, 4 H, OCH2); 6.94 (d, J = 8.5 Hz, 4 H, ArH);
7.22 (d, J = 8.3
Hz, 4 H, ArH).
RMN-'3C (100 MHz, D20): 22.14, 28.37, 31.58, 34.42 (OCH2CH2, ArCH2CH2); 68.86
(OCH2); 115.46 (C); 130.11 (Cm); 131.86 (CN); 157.31 (Cpso); 170.73
(Ca.midine).
Analyse élémentaire calculée pour C23H3402N4C12, 0.5 H20, 0.5 NH4C1 (505.19):
C: 54.68
%, H: 7.38 %, N: 12.47 %, trouvée: C: 54.36 %, H: 7.26 %, N: 12.66 %.
1,6-bis(4-(2-(amidino)éthyl)phénoxy)hexane, bis-chlorhydrate; composé 106
RMN-'H (400 MHz, DMSO-D6): 1.47 (s large, 4 H, OCH2CH2CH2) ; 1.72 (s large, 4
H,
OCH2CH2) ; 2.64 (t, J = 7.8 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 2.87 (t, J = 7.8
Hz, 4 H,
ArCH2CH2 ou ArCH2CH2) ; 3.94 (t, J= 6.3 Hz, 4 H, OCH2) ; 6.87 (d, J= 8.3 Hz, 4
H, ArH) ;
7.15 (d, J= 8.1 Hz, 4 H, ArH) ; 8.60, 9.02 (s larges, 6 H, NH).
RMN-'H (400 MHz, D20): 1.32 (s large, 4 H, OCH2CH2CH2) ; 1.58 (m, 4 H,
OCH2CH2) ,
2.62 (t, J = 7.5 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 2.84 (t, J = 7.4 Hz, 4 H,
ArCH2CH2 ou
ArCH2CH2) ; 3.86 (t, J = 6.4 Hz, 4 H, OCH2) ; 6.80 (d, J = 8.6 Hz, 4 H, ArH) ;
7.11 (d, J =
8.3 Hz, 4 H, ArH).
RMN-'3C (100 MHz, D20): 25.42, 28.62, 31.56, 34.41 (OCH2CH2CH2, ArCH2CH2) ;
68.86
(OCH2) ; 115.38 (Q, 130.08 (Cm) ; 131.80 (CN) ; 157.34 (Cpso) ; 170.72
(Can,aine).
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
Analyse élémentaire calculée pour C24H3602N4C12, 1/3 NH4C1(501.3): C: 57.50 %
; H: 7.50
%;N:12.10%;trouvée: C:57.13%;H:7.05%;N:12.10%.
1,7-bis(4-(2-(amidino)éthyl)phénoxy)heptane, bis-chlorhydrate; composé 107
5 RMN-'H (400 MHz, DMSO-D6): 1.41 (s large, 6 H, OCH2CH2CH2CH2) ; 1.71 (m, 4
H,
OCH2CH2) ; 2.63 (t, J = 7.1 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 2.87 (t, J = 7.8
Hz, 4 H,
ArCH2CH2 ou ArCH2CH2) ; 3.93 (t, J= 6.3 Hz, 4 H, OCH2) ; 6.87 (d, J= 8.6 Hz, 4
H, ArH) ;
7.15 (d, J= 8.3 Hz, 4 H, ArH) ; 8.57, 9.00 (s larges, 6 H, NH).
RMN-'H (400 MHz, D20): 1.16 (s large, 6 H, OCH2CH2CH2CH2) ; 1.49 (m, 4 H,
OCH2CH2)
10 ; 2.56 (t, J= 7.5 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 2.76 (t, J= 7.3 Hz, 4 H,
ArCH2CH2 ou
ArCH2CH2) ; 3.69 (t, J = 6.3 Hz, 4 H, OCH2) ; 6.69 (d, J = 8.3 Hz, 4 H, ArH) ;
7.04 (d, J =
8.6 Hz, 4 H, ArH).
RMN-13C (100 MHz, D20): 25.75, 28.90, 28.94, 31.58, 34.43 (OCH2CH2CH2CH2,
ArCH2CH2) ; 68.61 (OCH2) ; 115.16 (Co) ; 129.99 (Cm) ; 131.66 (CN) ; 157.46
(Cipso)
15 170.66 (Camidine)=
Analyse élémentaire calculée pour C25H3802N4C12, 0.5 H20 (497.5): C: 59.28 % ;
H: 7.75
; N: 11.06 %, trouvée: C: 58.74 %, H: 7.46 %, N: 11.47 %.
1,8-bis(4-(2-(amidino)éthyl)phénoxy)octane, bis-chlorhydrate; composé 108
20 RMN-'H (400 MHz, DMSO-D6): 1.47 (s large, 4 H, OCH2CH2CH2) ; 1.72 (s large,
4 H,
OCH2CH2) ; 2.64 (t, J = 7.8 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 2.87 (t, J = 7.8
Hz, 4 H,
ArCH2CH2 ou ArCH2CH2) ; 3.31 (s, 2 H, NH) ; 3.94 (t, J = 6.3 Hz, 4 H, OCH2) ;
6.87 (d, J =
8.3 Hz, 4 H, ArH) ; 7.15 (d, J = 8.1 Hz, 4 H, ArH) ; 8.60, 9.02 (s larges, 6
H, NH3).
RMN-'H (400 MHz, D20): 1.25 (m, 4 H, OCH2CH2CH2CH2) ; 1.42 (m, 4 H,
OCH2CH2CH2)
25 ; 1.63 (m, 4 H, OCH2CH2) ; 2.62 (t, J = 7.4 Hz, 4 H, ArCH2CH2 ou ArCH2CH2)
; 2.85 (t, J =
7.3 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 3.93 (t, J = 6.1 Hz, 4 H, OCH2) ; 6.85
(d, J = 8.6
Hz, 4H,ArH);7.12(d,J=8.6Hz,4H,ArH).
RMN-13C (100 MHz, D20): 25.83, 28.90, 29.19, 31.58, 34.43 (OCH2CH2CH2CH2,
ArCH2CH2) ; 68.76 (OCH2) ; 115.22 (Co) ; 130.00 (Cm) ; 131.61 (CN) ; 157.43
(Cipso)
30 170.65 (Camidine).
Analyse élémentaire calculée pour C26H4002N4C12, 0.4 H20 (518.73): C: 60.20 %
; H: 7.92
%, N: 10.80 %, trouvée: C: 60.34 %, H: 7.85 %, N: 10.91 %.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
66
1,9-bis(4-(2-(amidino)éthyl)phénoxy)nonane, bis-chlorhydrate; composé 109
RMN-'H (400 MHz, DMSO-D6): 1.31 (s large, 6 H, OCH2CH2CH2CH2CH2) ; 1.40 (s
large, 4
H, OCH2CH2CH2) ; 1.68 (q, 4 H, OCH2CH2) ; 2.66 (t, J = 7.8 Hz, 4 H, ArCH2CH2
ou
ArCH2CH2) ; 2.88 (t, J = 7.8 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 3.91 (t, J = 6.4
Hz, 4 H,
OCH2) ; 6.85 (d, J = 8.3 Hz, 4 H, ArH) ; 7.16 (d, J = 8.6 Hz, 4 H, ArH) ;
8.77, 9.16 (s larges,
8 H, NH).
RMN-'H (400 MHz, D20): 1.32 (m, 6 H, OCH2CH2CH2CH2CH2) ; 1.41 (m, 4 H,
OCH2CH2CH2) ; 1.73 (q, 4 H, OCH2CH2) ; 2.73 (t, J = 7.4 Hz, 4 H, ArCH2CH2 ou
ArCH2CH2) ; 2.95 (t, J = 7.4 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 4.04 (t, J = 6.5
Hz, 4 H,
OCH2) ; 6.96 (d, J= 8.6 Hz, 4 H, ArH) ; 7.22 (d, J= 8.3 Hz, 4 H, ArH).
RMN-13C (100 MHz, D20): 25.89, 29.07, 29.32, 31.47, 34.02 (OCH2CH2CH2CH2CH2,
ArCH2CH2); 67.69 (OCH2); 114.71 (C0); 129.63 (Cm); 131.40 (CN); 157.67
(Cipso); 170.51
(Camidine)
Analyse élémentaire calculée pour C27H4202N4C12 (525.55): C: 60.70 % ; H: 8.06
% ; N:
10.66 %, trouvée: C: 61.59 %, H: 7.97 %, N: 10.58 %.
1,10-bis(4-(2-(amidino)éthyl)phénoxy)decane, bis-chlorhydrate; composé 110
RMN-'H (400 MHz, DMSO-D6): 1.29 (m, 8 H, OCH2CH2CH2CH2CH2) ; 1.39 (m, 4 H,
OCH2CH2CH2) ; 1.68 (m, 4 H, OCH2CH2) ; 2.65 (t, J = 7.8 Hz, 4 H, ArCH2CH2 ou
ArCH2CH2) ; 2.88 (t, J= 7.8 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 3.36 (s, 2 H, NH)
; 3.91 (t,
J= 6.3 Hz, 4H,OCH2);6.86(d,J=8.3Hz, 4H,ArH);7.16(d,J=8.3Hz,4H,ArH)
8.74, 9.12 (s larges, 6 H, NH3).
RMN-'H (400 MHz, D20): 1.29 (m, 8 H, OCH2CH2CH2CH2CH2) ; 1.40 (m, 4 H,
OCH2CH2CH2) ; 1.72 (q, 4 H, OCH2CH2) ; 2.71 (t, J = 7.3 Hz, 4 H, ArCH2CH2 ou
ArCH2CH2) ; 2.94 (t, J = 7.3 Hz, 4 H, ArCH2CH2 ou ArCH2CH2) ; 4.03 (t, J = 6.5
Hz, 4 H,
OCH2);6.95(d,J=8.6Hz,4H,ArH);7.21 (d, J= 8.8 Hz, 4 H, ArH).
RMN-13C (100 MHz, D20): 25.89, 29.07, 29.13, 29.31, 31.45, 34.99
(OCH2CH2CH2CH2,
ArCH2CH2) ; 67.69 (OCH2) ; 114.73 (Co) ; 129.62 (Cm) ; 131.37 (CN) ; 157.68
(Cipso)
170.42 (Camidine).
Analyse élémentaire calculée pour C28H4402N4C12, 0.5 H20 (548.59): C: 61.30 %
; H: 8.26
%; N: 10.21%;trouvée: C: 61.39%; H: 8.12%; N: 10.16%.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
67
Exemple 5 Synthèse des bis(para-cyanométhyl)-diphénylalcane
n
C1 / / C1
Le 1,2-diphényl alcane est traité par le dichlorométhyléther en présence de
chlorure de zinc
(Hager et al., J. AM. Pharm. Ass, 1952, XLI, 3(6), 115-118 ; Reichstein et
Oppenauer, Helv.
Chim. Acta, 1933, 16, 1380) ou par du chlorométhyl-n-octylether en présence de
tétrachlorure
de titane, ou tout autre agent chlorométhylant, pour donner le bis(para-
chlorométhyl)-
diphénylalcane.
n
NC CN
Le bis(para-chlorométhyl)-diphénylalcane est traité par NaCN dans un mélange
hydroalcoolique (Hager et al. , J. AM. Pharm. Ass, 1952, XLI, 3(6), 115-118;
Reichstein et
Oppenauer, Helv. Chim. Acta, 1933, 16, 1380), ou dans tout autre solvant
favorisant cette
substitution nucléophile pour donner le bis(para-cyanométhyl)-diphénylalcane
Ces composés peuvent être homologués grâce au protocole proposé précédemment.
Exemple 6 : Synthèse des bis(para-guanidinoalkyl) phénoxy)alcanes
1) bis(para-aminoalkyl) phényl)alcanes
n
H2N tn m' NH2
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
68
Le bis(4-cyanoalkyl)-diphénylalcane considéré est mis en solution dans du THF
anhydre,
sous atmosphère inerte. Entre 5 et 10 équivalents de complexe borane:THF 1M
dans le
tétrahydrofurane sont ajoutés, et le mélange est agité 30 minutes à
température ambiante, puis
porté à reflux durant 3 à 4 heures. Après refroidissement à température
ambiante, le mélange
est additionné à un excès de méthanol pour détruire l'excès de borane. Le
triméthoxyborane,
le méthanol et le tétrahydrofurane sont évaporés. Le résidu d'évaporation est
repris dans un
mélange méthanol/eau/acide chlorhydrique, et l'ensemble est porté à reflux
durant 2 heures.
Les solvants sont évaporés à sec pour donner le dichlorhydrate de bis(4-
((aminométhyl)alkyl)-
diphénylalcane recherché. La bis amine libre est obtenue par traitement d'une
solution
aqueuse de chlorhydrate en présence d'une base minérale, suivi d'une
extraction au
dichlorométhane. La phase organique est séchée sur sulfate de sodium, filtrée
et évaporée
sous pression réduite.
2) bis(4- (N,N'-di-Boc) guanidinoalkyl) phényl)alcane
NBoc NBoc
NHBoc~N m NNHBoc
H H
Le dichlorhydrate de bis(4-aminoalkyl) phényl)alcane est mis en suspension
dans du
CH2C12 anhydre et solubilisé par l'ajout d'un minimum de MeOH. De la
triéthylamine est
alors ajoutée, ainsi que la N,N'-Bis(tert-butoxycarbonyl)-N"-triflylguanidine
et le tout est
placé à température ambiante, sous atmosphère inerte et sous agitation. Le
solvant est éliminé
par évaporation sous vide. Le brut obtenu est solubilisé par du CH2C12, lavé
par une solution
aqueuse de NaHSO4 2M, puis par une solution aqueuse saturée de NaHCO3. La
phase
organique est alors séchée sur Na2SO4, filtrée, concentrée et séchée sous vide
pour donner le
composé protégé.
3) bis(4-guanidinoalkyl) phényl)alcane
CF3C02H NH n NH
CF3CO2H
H N N m' NNH
2 H M H 2
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
69
Le composé bis(4-(N,N'-di-Boc)guanidinoalkyl) phényl)alcane est mis en
solution dans le
CH2C12 anhydre et est additionné de TFA. La réaction reste sous agitation et
sous atmosphère
inerte durant environ 3 h. Le mélange est alors concentré, reprit plusieurs
fois au
dichlorométhane et concentré pour éliminer le maximum de TFA résiduel. Le
produit obtenu
est ensuite trituré dans l'Et20 pour donner un solide qui est alors filtré,
lavé à l'Et20 et séché
sous vide. Il s'agit du composé recherché bis(trifluoroacétate) de bis(4-
(guanidinoalkyl)
phényl)alcane.
Exemple 7 : Synthèse des bis(4-(amidinoalkyl) phényl)alcanes
\ n \
HzN NHz
m
NH NH
Une solution de dérivé bis(4-(cyanoalkyl)phényl)alcane dans un mélange
d'éthanol et de
benzène anhydre est refroidie à 0 C, puis est traitée par barbotage d'acide
chlorhydrique
gazeux durant 1 heure environ. La solution acide est conservée à 4 C durant
plusieurs jours.
La part volatile d'acide chlorhydrique est éliminée par barbotage d'azote sec,
et la solution
dégazée est évaporée à sec sous pression réduite. Le résidu d'évaporation,
contenant le
dichlorhydrate de bis(4-(éthyl)imidatoalkyl) phényl)alcane est repris par une
solution 1M
d'ammoniac dans l'éthanol. Le mélange est chauffé à 50-60 C en conditions
anhydres durant
2-3h, puis est laissé sous agitation à température ambiante durant la nuit. Le
milieu résultant
est filtré, puis du diéthyléther est additionné, provoquant la précipitation
du dichlorhydrate de
bis(4-(amidinoalkyl) phényl)alcane recherché.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
B. Détermination de l'activité biologique
Matériel utilisé
5 Souches bactériennes
Selon les recommandations conjointes :
- du Comité de l'Antibiogramme de la Société Française de Microbiologie
(CA-SFM)
[CA-SFM. Communiqué 2007 (Edition janvier 2007). http://www.sfm.asso.fr] et,
10 - du Clinical and Laboratory Standards Institute (CLSI, anciennement
National
Committee for Clinical Laboratory Standards ou NCCLS) [NCCLS. 2003. Methods
for
dilution antimicrobial susceptibility tests for bacteria that grow
aerobically; approved
standard M7-A6, 6th ed. National Committee for Clinical Laboratory Standards,
Wayne, Pa,
USA.],
15 cinq souches bactériennes de référence ont été utilisées pour l'étude :
Escherichia coli ATCC
25922, Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 25923 &
ATCC 29213 et Enterococcus faecalis ATCC 29212.
L'étude a aussi porté sur 5 isolats cliniques, obtenus de prélèvements rectaux
et/ou
20 d'hémoculture :
- E. coli productrice de pénicilline (ECR1),
- S. aureus résistant à la méticilline (gène mecA) (SaRl),
- E.faecium résistant à la vancomycine (gène vanB) (EfRi),
- E. faecalis résistant à la teicoplanine et à la vancomycine (gène vanA)
(EfR2), et,
25 - P. aeruginosa surexprimant une pompe d'efflux (PaR1).
Les isolats ont été choisis sur la base de leur profil de résistance. Les
profils de résistance
ont été déterminés sur VITEK2 (BioMerieux, France).
Les bactéries sont cultivées soit sur gélose Mueller-Hinton (Difco, 225250),
soit en
30 bouillon Mueller-Hinton (Difco, 275730), à 35 C [Grare M, Mourer M,
Fontanay S, Regnouf-
de-Vains JB, Finance C, Duval RE. In vitro activity of para-
guanidinoethylcalix[4]arene
against susceptible and antibiotic-resistant Gram-negative and Gram-positive
bacteria. J.
Antimicrob Chemother. 2007; 60: 575-81].
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
71
Substances- actives-
-----------------------------
Les différentes molécules testées ont été préparées sous forme de solution
aqueuse à 10.2
mol/L. Les solutions utilisées pour les tests biologiques sont fraîchement
préparées, et
conservées au maximum une semaine à 4 C. Les solutions sont filtrées à travers
un filtre de
pores de 0,22 m (Millex(WGP ; 0,22 m ; Millipore ; France) avant chaque
test.
Treize substances actives ont été testées: les composés guanidino 1, 3, 4, 6,
7, 9 et 10 sous
forme de sels d'acide trifluoroacétique, les composés amidino 103, 104, 106,
107, 108 et 110
sous forme de sels d'acide chlorhydrique, ainsi que la chlorhexidine sous
forme de sel d'acide
gluconique, et l'hexamidine sous forme de sel d'acide iséthionique, qui sont
des
antibactériens commercialisés, à titre de comparaison.
oA ]1o
H
N
HZN ~NI-12
NH HN
CF3COOH
CF3COOH ~ ~ O
3 O
H _
N N
HZN 3 \-NIZ
NH HN
CF3000H CF3COOH
_ o'` 4'0 _
H H
N N
HZN- 4 >-NI-12
NH HN
CF3COOH CF3COOH
H _
N N
1-12N -NHZ
NH 6 \ HN
CF3COOH CF3COOH
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
72
,-4"
_ _
N N
HZN 7 >-NI-12
NH - HN
CF3000H CF3000H
A-~, ,
H _
N N
1-12N -NHZ
NH 9 \ HN
CF3COOH CF3COOH
0 100
N H
H N NH
z 10
NH HN
CF3COOH CF3000H
HZN 103 NH2
NH HN
HC1 HC1
,-4
0
,0
H2N-~-
104 NHZ
NH HN
HC1 HC1
14"
HZN 106 NHZ
NH HN
HC1 HC1
107 NH2
H2N-~-
NH HN
HC1 HC1
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
73
A-~.
o
,o
HZN 108 NHZ
NH HN
HC1 HC1
0 100
HZN 110 NH2
NH HN
HC1 HC1
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
74
Exemple 8 : Détermination de l'activité antibactérienne
Procédure pour déterminer la Concentration Minimale Inhibitrice (CMI)
Les concentrations minimales inhibitrices (CMI) ont été déterminées par la
méthode
standardisée de microdilution en milieu liquide (microplaque 96 puits à fond
U , Greiner),
en bouillon de Mueller-Hinton, avec un inoculum final de 105-106 UFC/mL, en
fonction des
espèces bactériennes, conformément aux recommandations du CLSI.
Pour la détermination des CMI, les suspensions bactériennes sont préparées à
partir d'une
colonie isolée, prélevée à partir d'une gélose Mueller-Hinton, reprise dans 5
mL de bouillon
Mueller-Hinton. Après 24 h de croissance, les suspensions bactériennes sont
diluées dans de
l'eau distillée stérile afin d'obtenir un inoculum de 105 - 106 UFC/mL. La
pureté des
suspensions bactériennes est contrôlée par isolement sur gélose et coloration
de Gram.
Après 18 à 24 h d'incubation à 35 C, les CMI sont déterminées à l'aide d'un
lecteur de
plaque ELISA (à 540 nm, Multiskan EX, Thermo Electron Corporation, France)
comme étant
les concentrations en substance active pour lesquelles l'absorbance est
comparable à celle du
témoin négatif (milieu de culture seul ou avec la drogue, sans l'inoculum).
Les résultats sont
la moyenne de 4 expériences indépendantes.
Résultats
Les concentrations minimales inhibitrices (CMI) sont données dans le tableau
3.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
t N `~
0 o U
~pl O N GO - V GO
N C N
cd cd cd
N N X
E
MI M N N ~Ic
-I 'd cnl sol ~~
GO V N M GO N N
O >C O p 4
4-. CD
lui
0
Cd
O O N GO O O -~ N GO
O ,~I
N N rn cq
01 01
Q cd
N O1 O N 1 ~
N N N N N
U U U U U o N
H H H H H ~1
"cw
b0 -d
N ~ U N N ~
1211 Z2
c~ 04
H
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
76
N
- Eco U
I
c'c
cd V
G0~ f^ ,~ f^ ,~-i N ~ DC U N
O M .~ .~ .~ `~ oo gi -E A p
O O O O ~
O ^i M N _N ^ ^
I
O M ~- N M M
N N N
N ~ \p GO ~ dj
.r.
lei
z :P
ICI N N
c O
cd ~ cd
N N
'-- M M
DC ~C ~C
0 0 0 0 0
M N M
0 ô ô a;
~yyyy
zzi-
N N cr C M b0
a1 a1 N N oocc ----
N N N N N
,~ U U U U U ~~ `~
H H H H H -d et et et et
"CI
Cd
v O ~ ~ ~ ~ M
U 1211
w w
cd
H
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
77
Premièrement, l'hexamidine et la chlorhexidine présentent toutes les deux une
activité
antibactérienne à large spectre (i.e. activité antibactérienne contre les
bactéries à Gram positif
et à Gram négatif), avec pour ces deux molécules (hexamidine et chlorhexidine)
une activité
moindre sur P. aeruginosa.
De plus, l'hexamidine et la chlorhexidine présentent une activité
antibactérienne
comparable que l'on considère les bactéries de référence (souches ATCC) ou les
isolats
cliniques. Enfin, l'hexamidine et la chlorhexidine présentent une meilleure
activité sur les
coques à Gram positif (S. aureus et Enterococcus spp., à l'exception de la
chlorhexidine vis-à-
vis de la bactérie E. coli.
Deuxièmement, concernant les composés selon l'invention, l'activité
antibactérienne varie
en fonction de la longueur de la chaîne alkyle (guanidino: n=9 > n=10 > n=6 >
n=4 > n=3 >
n=1; amidino: n=10 > n=6 > n=4). Ces molécules présentent une activité sur les
bactéries à
Gram positif et à Gram négatif, avec une activité plus forte sur les cocci à
Gram positif, (et
plus particulièrement Staphylococcus spp. et S. aureus), et 6 conserve une
activité comparable
sur les isolats cliniques.
Le composé 6 présente une activité antibactérienne globalement meilleure que
l'hexamidine et comparable à celle de la chlorhexidine, en particulier
concernant son activité
vis-à-vis des Staphylocoques.
Les composés 9 et 10 présentent tous deux de très bonnes activités sur les 5
souches de
référence testées, équivalentes ou supérieures à celles du composé 6.
Exemple 9 : Détermination de la viabilité cellulaire et de la cytotoxicité
Lignées de cellules et culture cellulaire
Les cellules eucaryotes utilisées dans notre étude sont les cellules HaCaT
(kératinocytes
humain) qui ont été gracieusement fournies par l'Institut Pierre Fabre
(Toulouse, France) ; et
les cellules MRC-5 (fibroblastes embryonnaires humain) qui ont été obtenues
auprès de la
société BioMérieux (Lyon, France). Ces cellules sont cultivées en DMEM (
Dulbecco's
modified Eagle's medium , Invitrogen 61965) pour les cellules HaCaT, et MEM (
modified
Eagle's medium , Invitrogen 41090) ; à 10% de sérum de veau foetal (SVF,
Invitrogen,
10270, Lot 40Q5150K) en chambre humide à 37 C, sous 5% C02. Les cellules HaCaT
et
MRC-5 ont été ensemencées à 104 cellules/puits en plaque 96 puits (Sarstedt
831835). Après
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
78
48 h de croissance, le milieu de culture est retiré et remplacé par les
différentes solutions
d'essai (volume = 100 L). Au bout de 24, 48 et/ou 168 h de temps de
contact, les tests de
viabilité ou de cytotoxicité sont réalisés.
Procédure des tests biologiques
a) Tests de viabilité cellulaire (test au MTT)
Pour évaluer l'effet sur la viabilité des cellules HaCaT et MRC-5, des
différents composés
testés, la technique du MTT (bromure de 3-[4,5-diméthylthiazol-2-yl] -2,5-
diphényltétrazolium ; MTT, Aldrich, 135038), décrite par Mossman [Mosmann T.
Rapid
colorimetric assay for cellular growth and survival: application to
prolifération and
cytotoxicity assays. Jlmmunol Methods. 1983; 65: 55-63] et modifiée par Grare
et coll [Grare
M, Mourer M, Fontanay S, Regnouf-de-Vains JB, Finance C, Duval RE. In vitro
activity of
para-guanidinoethylcalix[4]arene against susceptible and antibiotic-resistant
Gram-negative
and Gram-positive bacteria. JAntimicrob Chemother. 2007; 60: 575-81], a été
utilisée.
Elle est basée sur la réduction des sels de tétrazolium de couleur jaune, en
cristaux de
formazan violets, principalement par les déshydrogénases mitochondriales. La
quantité de
formazan formée est proportionnelle au nombre de cellules vivantes. Après les
24, 48 et/ou
168 h de temps de contact avec les différentes concentrations des molécules à
tester, 10 L de
MTT (à 5 mg/ni-L) sont ajoutés à chacun des puits et les plaques sont placées
à 37 C. Après
4 h d'incubation, les cristaux insolubles de formazan qui se sont formés, sont
dissous par
ajout de 100 L SDS dans chacun des puits. L'absorbance est mesurée à 540 nm
avec une
longueur d'onde de référence à 690 nm, à l'aide d'un lecteur plaque ELISA
(Multiskan EX,
Thermo Electron Corporation, France). Les résultats sont la moyenne des
valeurs obtenues
pour 8 puits par concentration et par unité de temps. Chaque expérience a été
réalisée 3 fois.
b) Tests de cytotoxicité (test rouge neutre)
Le test de cytotoxicité est base sur l'incorporation d'un colorant vital, le
Rouge Neutre,
dans les lysosomes des cellules viables, suite à une exposition des cellules
aux différentes
concentrations des molécules à tester. La quantité de colorant, après
extraction à partir des
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
79
lysosomes, est quantifiée à l'aide d'un spectrophotomètre et comparée à celle
obtenue dans le
cas de cellules control , non exposées aux molécules à tester.
Le test a été réalisé comme décrit précédemment [Borenfreund E, Puerner JA.
Toxicity
determined in vitro by morphological alterations and neutral red absorption.
Toxicol Lett
1985; 24: 119-24, et Grare M, Mourer M, Fontanay S, Regnouf-de-Vains JB,
Finance C,
Duval RE. In vitro activity of para-guanidinoethylcalix[4]arene against
susceptible and
antibiotic-resistant Gram-negative and Gram-positive bacteria. J Antimicrob
Chemother.
2007; 60: 575-81].
Après les 24, 48 et/ou 168 h de temps de contact avec les différentes
concentrations des
molécules à tester, le milieu contenu dans chacun des puits est retiré et
remplacé par 200 L
milieu sans rouge de phénol (Invitrogen, 51200) contenant 50 g/mL de Rouge
Neutre pour
une incubation supplémentaire de 3 h. Les cellules sont alors rincées 3 fois
avec une solution
de PBS. Après le dernier lavage au PBS, 200 L d'une solution à 1% acide
acétique/50%
éthanol sont ajoutés à chacun des puits pour extraire le colorant des
lysosomes des cellules
viables. L'absorbance est mesurée à 540 nm, avec une longueur d'onde de
référence à 690
nm, à l'aide d'un lecteur plaque ELISA (Multiskan EX, Thermo Electron
Corporation,
France). Les résultats sont la moyenne des valeurs obtenues pour 8 puits par
concentration et
par unité de temps. Chaque expérience a été réalisée 3 fois.
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
Résultats
Les résultats de viabilité et de cytotoxicité sont donnés dans les Tableaux 4
et 5.
Chlorhexidine Hexamidine 6
CI5o (mg/L)
HaCaT MRC-5 HaCaT MRC-5 HaCaT MRC-5
24 h 8-16 16-32 32-64 32-64 4-8 8-16
48 h 4-8 8-16 16-32 16-32 4-8 4-8
168 h 2-4 1-2 4-8 4-8 1-2 0,5-1
5
Tableau 4 : CI50 déterminées à partir des valeurs obtenues par le test de
viabilité (au MTT).
Les lignées de cellules HaCaT et MRC-5 ont été cultivées en tant que culture
adhérente sur
des microplaques à 96 puits.
Les composés ont été ajoutés à des concentrations de 1 à 256 mg/L pour 24, 48
et 168 h.
10 Les CI50 sont représentatives de trois déterminations indépendantes.
6: 1,6-bis(4-(2-guanidinoéthyl) phénoxy)hexane.
Chlorhexidine Hexamidine 6
CC50 (mg/L)
HaCaT MRC-5 HaCaT MRC-5 HaCaT MRC-5
24 h 8-16 8-16 8-16 8-16 4-8 4-8
48 h 4-8 2-4 8-16 8-16 2-4
168 h 1-2 0,5-1 1-2 0,5-1 1-2
Tableau 5: CC50 déterminées à partir des valeurs obtenues par le test de
cytotoxicité (au RN).
15 Les lignées de cellules HaCaT et MRC-5 ont été cultivées en tant que
culture adhérente sur
des microplaques à 96 puits.
Les composés ont été ajoutés à des concentrations de 1 à 256 mg/L pour 24, 48
et 168 h. Les
CC50 sont représentatives de trois déterminations indépendantes.
6: 1,6-bis(4-(2-guanidinoéthyl) phénoxy)hexane
La comparaison des résultats des tests de viabilité et de cytotoxicité montre
que les
concentrations CI50 (concentration inhibitrice à 50%) et CC50 (concentration
cytotoxique à
50%) obtenues sont globalement en accord. La comparaison des valeurs de CI50
et de CC50
montre que les valeurs sont de même ordre de grandeur dans le cas de
l'hexamidine et de la
chlorhexidine, celles obtenues pour le composé 6 étant un peu plus faibles.
Par conséquent le
CA 02730304 2011-01-07
WO 2010/004231 PCT/FR2009/051388
81
composé 6 a un impact un peu plus prononcé sur la viabilité et la
cytotoxicité, in vitro, sur les
cellules eucaryotes HaCaT et/ou MRC5.
Exemple 10 : Détermination de l'index de sélectivité
A partir des concentrations CMI et CI50 déterminées après 24 h d'exposition,
l'index de
sélectivité (IS = C150/CMI) a été calculé (Tableau 4). Les valeurs de IS
obtenues pour les deux
tests (MTT et RN) sont similaires.
Chlorhexidine Hexamidine 6
E. coli ATCC 25922 64-128 4-8 1-2
S. aureus ATCC 25923 32-64 8-16 8-16
S. aureus ATCC 29213 32-64 > 32 16-32
E. faecalis ATCC 29212 8-16 16-32 0,5-1
P. aeruginosa ATCC 27853 2-4 1-2 0,25-0,5
Tableau 6 : Index de sélectivité obtenu pour 5 souches de référence, après 24
h d'exposition
au composé, sur des lignées de cellules HaCaT.
6: 1,6-bis(4-(2-guanidinoéthyl) phénoxy)hexane.
Les valeurs d'IS sont globalement très proches les unes des autres ce qui
démontre
l'intérêt du composé 6 vis-à-vis de composés commerciaux largement
préconisés en
ville et à l'hôpital pour les infections à bactéries à Gram positif, et plus
particulièrement les
infections à S. aureus.