Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
1
COMPOSES POLYSUBSTITUES D'AZETIDINES, LEUR PRÉPARATION ET LEUR
APPLICATION EN THÉRAPEUTIQUE
La présente invention se rapporte à des dérivés d'azétidines, à leur
préparation et à leur
application en thérapeutique dans le traitement ou la prévention de maladies
impliquant les
récepteurs aux cannabinoïdes CB 1.
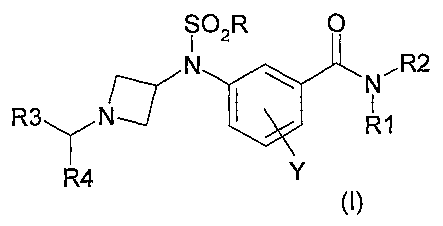
La présente invention a pour objet des composés répondant à la formule (I)
SOIR O
N \ NR2
R3 d~ 1
R1
R4 Y
dans laquelle : (J)
R représente un groupe (C1-C6)alkyle, un groupe halo(C1-C6)alkyle;
Rl représente un atome d'hydrogène ;
R2 représente un groupe hétérocycle lié par un atome de carbone, un groupe
hétérocycle-(C1-
C4)alkyle, ces groupes étant éventuellement substitués par un ou plusieurs
atomes ou groupes
choisis parmi un halogène, un hydroxy, oxo, cyan, NH2, C(O)NH2, un groupe (C1-
C6)alkyle, un
groupe halo(C1-C6)alkyle, un groupe (CI-C6)alcoxy, un groupe halo(C1-C6)alcoxy
ou un groupe
COO(Ci-C6)alkyle;
R3 et R4 représentent indépendamment l'un de l'autre un groupe phényle,
éventuellement
substitué par un ou plusieurs atomes ou groupes choisis parmi un halogène, un
cyano, un groupe
(C1-C6)alkyle, un groupe halo(CI-C6)alkyle, un groupe (C1-C6)alcoxy ou un
groupe halo(C1-
C6)alcoxy;
Y représente un atome d'hydrogène, un halogène, un cyano, un groupe (CI-
C6)alkyle, un groupe
halo(C1-C6)alkyle, un groupe (C1-C6)alcoxy, un groupe halo(C1-C6)alcoxy ou un
groupe (C1-
C6)alkylS(O)p;
p est compris entre 0 et 2 ;
à l'état de base ou de sel d'addition à un acide.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbones asymétriques.
Ils peuvent donc exister sous forme d'énantiomères ou de diastéréoisomères.
Ces énantiomères,
diastéréoisomères, ainsi que leurs mélanges, y compris les mélanges
racémiques, font partie de
l'invention.
Parmi les composés de formule (I) objets de l'invention, un premier groupe de
composés
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
2
est constitué des composés en mélange de diastéréoisomères et d'énantiomères
pour lesquels :
R représente un méthyle,
R3 et R4 représentent chacun un groupe phényle substitué par un atome de
chlore en position
para,
Y représente un atome d'hydrogène ou un halogène
RI représente un atome d'hydrogène,
R2 représente un groupe hétérocycle lié par un atome de carbone ou un groupe
hétérocycle-(Cl-
Cd)alkyle et l'hétérocycle représente un tétrahydrothiophène, pipéridine,
tétrahydrothiopyrane,
azétidine, pyrrolidine, imidazolidine qui sont éventuellement substitués par
un ou plusieurs
groupes (Cl-C6)alkyle, COO(Ci-C6)alkyle ou oxo ;
à l'état de base ou de sel d'addition à un acide.
Les combinaisons des groupes mentionnés ci-dessus sont également des groupes
de composés
objets de l'invention.
Dans le cadre de la présente invention, on entend par :
- un halogène : un fluor, un chlore, un brome ou un iode ;
- un groupe (Cl-C6)alkyle: un groupe aliphatique comprenant de 1 à 6 atomes de
carbone saturé,
cyclique, ramifié ou linéaire pouvant éventuellement être substitué par un ou
plusieurs
groupements (Cl-C6)alkyle linéaires, ramifiés ou cycliques. A titre
d'exemples, on peut citer les
groupes méthyle, éthyle, propyle, isopropyle, butyle, isobutyle, tertbutyle,
pentyle, hexyle,
cyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle, cycloheptyle,
cyclopropylméthyle, etc ;
- un groupe halo(C1-C6)alkyle : un groupe (Cl-C6)alkyle dont un ou plusieurs
atomes
d'hydrogène ont été substitués par un atome d'halogène. A titre d'exemples, on
peut citer les
groupes CF3, CH2CF3, CHF2, CC13;
- un groupe hydroxy(C1-C6)alkyle : un groupe (Cl-C6)alkyle dont un ou
plusieurs atomes
d'hydrogène ont été substitués par un ou plusieurs hydroxy
- un groupe (Cl-C6)alcoxy : un groupe (Cl-C6)alkyle-O- où le groupe (Cl-
C6)alkyle est tel que
précédemment défini.
- un groupe halo(C1-C6)alcoxy : un groupe halo(Cl-C6)alkyle-O- où le groupe
halo(Ci-
C6)alkyle est tel que précédemment défini.
- un groupe hétérocycle est un groupe monocyclique saturé ou partiellement
saturé comportant
de 4 à 6 atomes dont 1 à 3 hétéroatomes choisis parmi O, N, S sachant que
lorsqu'il y a un
oxygène présent il y a au moins un autre hétéroatome choisi parmi N, S. Les
hétéroatomes N ou S
peuvent être présents sous la forme oxydée c'est-à-dire N-O ou S(O) ou S02. A
titre d'exemples,
on peut citer les groupes pipéridine, pyrrolidine, tétrahydrothiophène,
imidazolidine,
tétrahydrothiopyrane, azétidine.
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
3
un groupe hétérocycle-(Cl-C4)alkyle est un groupe alkyle substitué par un
hétérocycle tel que
défini précédemment.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels. De
tels sels d'addition
font partie de l'invention.
Ces sels peuvent être préparés avec des acides pharmaceutiquement acceptables,
mais les
sels d'autres acides utiles, par exemple, pour la purification ou l'isolement
des composés de
formule (I) font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de
solvats, à savoir sous forme d'associations ou de combinaisons avec une ou
plusieurs molécules
d'eau ou avec un solvant. De tels hydrates et solvats font également partie de
l'invention.
Les composés de formule (1) peuvent également exister sous forme de tautomères
et font
partie également de l'invention.
Parmi les composés de formule (I) objets de l'invention, on peut notamment
citer les
composés suivants ; la nomenclature utilisée correspond à la nomenclature
IUPAC.
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[3-
(2-oxopyrrolidin-l-
yl)propyl]benzamide
3-[ {1 -[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
(1,1-
dioxidotétrahydrothiophén-3 -yl)benzamide
Chlorhydrate (2:1) de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-
N-[(1-éthylpyrro lidin-2-yl)méthyl] benzamide
4-[({3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]phényl}carbonyl)amino]pipéridine-1-carboxylate de t-
butyle
(-)-3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
{ [ 1-
éthylpyrrolidin-2-yl]méthyl}benzamide
(+)-3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
{ [ 1 -
éthylpyrrolidin-2-yl]méthyl}benzamide
(-)-3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-N-
[l,1-
dioxidotétrahydrothiophén-3-yl]benzamide
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
4
(+)-3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
[1,1-
dioxidotétrahydrothiophén-3-yl]benzamide
3-[ {l -[bis(4-chlorophényl)méthyllazétidin-3-yl} (méthylsulfonyl)amino]-N-[2-
(2-
oxoimidazolidin-1-yl)éthyl]benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
(tétrahydro-2H-
thiopyran-4-yl)benzamide
3-[ {l -[bis(4-chlorophényl)méthyl]azétidin-3-ylJ (méthylsulfonyl)amino]-N-
(1,1-
dioxidotétrahydro-2H-thiopyran-4-yl)benzamide
3-[({3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]phényl}carbonyl)amino] azétidine-1-carboxylate de t-
butyle
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-N-(2-
oxopyrrolidin-3-
yl)benzamide
3 -[ { 1-[bis(4-chlorophényl)méthyl] azétidin-3 -yl } (méthylsulfonyl)amino]-5-
fluoro-N-(2-
oxopyrrolidin-3-yl)benzamide
(+)-3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-5-
fluoro-N-[2-
oxopyrrolidin-3-yl]benzamide
(-)-3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-5-
fluoro-N-[2-
oxopyrrolidin-3-yl]benzamide
leurs isomères optiques et leurs sels pharmaceutiquement acceptables.
La présente invention a également comme objet l'utilisation des composés de
l'invention
de formule (I) pour la préparation d'un médicament pour le traitement ou la
prévention des
maladies dans lesquelles le récepteur CB 1 est impliqué.
La présente invention a également comme objet l'utilisation des composés de
l'invention
de formule (I) pour la préparation d'un médicament pour le traitement ou la
prévention des
désordres psychiatriques, de la dépendance et du sevrage à une substance, du
sevrage tabagique,
des troubles cognitifs et de l'attention et des maladies neurodégénératives
aiguës et chroniques ;
du métabolisme, des troubles de l'appétence, des troubles de l'appétit, de
l'obésité, du diabète (de
type I et/ou II), du syndrome métabolique, de la dyslipidémie, de l'apnée du
sommeil ; de la
douleur, de la douleur neuropathique, des douleurs neuropathiques induites par
les anticancéreux ;
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
des troubles gastro-intestinaux, des vomissements, de l'ulcère, des troubles
diarrhéiques, des
troubles vésicaux et urinaires, des troubles d'origine endocrinienne, des
troubles cardio-
vasculaires, de l'hypotension, du choc hémorragique, du choc septique, des
maladies du foie, de la
cirrhose chronique du foie, des fibroses, de la stéatohépatite non alcoolique
(NASH), de la
5 stéatohépatite et de la stéatose hépatique, quelle que soit l'étiologie de
ces affections (alcool,
médicament, produit chimique, maladie auto-immune, obésité, diabète, maladie
métabolique
congénitale) ; des maladies du système immunitaire, de l'arthrite rhumatoïde,
de la
démyélinisation, de la sclérose en plaques, des maladies inflammatoires ; de
la maladie
d'Alzheimer, de Parkinson, de la schizophrénie, des troubles cognitifs
associés à la schizophrénie,
au diabète, à l'obésité, au syndrome métabolique ; de l'asthme, des maladies
pulmonaires
chronique obstructive, du syndrome de Raynaud, du glaucome, des troubles de la
fertilité ; des
maladies infectieuses et virales telles que les encéphalites, des accidents
vasculaires cérébraux, du
syndrome de Guillain-Barré, de l'ostéoporose et de l'apnée du sommeil et pour
la chimiothérapie
anticancéreuse ; les troubles liés aux traitements antipsychotiques (prise de
poids, trouble du
métabolisme).
Conformément à l'invention, on peut préparer les composés de formule générale
(I) selon
le procédé décrit dans le schéma 1 :
SO,R
HN H2N
R3 OR" OR"
J_N>OMs { / /
R4 O Y 0
Y
3 2 1
R3 502R R3 S0 2R R2i R3>--NON S02R
R44-4 N > OR" R4 N> O H6
~>iOH R1 R4 / \ OR2
Y R1
4 $
Schéma 1
La mésylation du composé 1 en dérivé 2 peut se faire selon les méthodes
connues de
l'homme de l'art ou bien décrites dans T.W. GREENE, Protective Group in
Organic Synthesis,
fourth edition. Cette réaction se fera dans un solvant chloré tel que le
dichlorométhane en
présence d'une base telle que la pyridine et d'un dérivé mésylate tel que le
chlorure de mésyle à
une température comprise entre -10 C et 40 C.
Les dérivés 1 sont commerciaux ou synthétisés, selon les méthodes connues de
l'homme
du métier, à partir des précurseurs adéquats commerciaux, R" représente un
groupement
protecteur de la fonction OH de l'acide.
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
6
Le dérivé 4 est accessible par réaction du mésylate 2 avec l'azétidine 3.
Cette étape
s'effectue de préférence sous atmosphère inerte, au sein d'un solvant inerte
tel que la 4-méthyl-2-
pentanone en présence d'une base minérale comme le carbonate de potassium au
reflux du
mélange réactionnel.
La synthèse de l'azétidine 3 est décrite dans la demande de brevet WO01064634.
L'hydrolyse de l'ester 4 en acide 5 s'effectue d'après les méthodes connues de
l'homme
de l'art et, plus précisément, dans un mélange de solvants polaires tels que
le tétrahydrofuranne et
l'eau en présence d'une base telle que l'hydroxyde de lithium hydratée à une
température voisine
de 20 C.
La formation des composés de formule (I) peut se faire, par réaction entre
l'acide 5 et un
dérivé aminé 6 :
= au sein d'un solvant polaire tel que le tétrahydrofuranne ou d'un solvant
chloré tel
que le dichloroméhtane, en présence ou non d'une base telle qu'une
trialkylamine
(triéthylamine), en présence ou non d'un agent de couplage tel que le
chlorhydrate
de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide ou le carbodiimide supporté,
en présence ou non d'un additif (1-hydroxybenzotriazole, par exemple),
= au sein d'un solvant polaire tel que le tétrahydrofuranne ou d'un solvant
chloré tel
que le dichlorométhane, en présence d'une base telle qu'une triaikylamine
(triéthylamine ou diisopropyléthylamine, par exemple), en présence d'un agent
favorisant la synthèse peptidique via la formation d'un anhydride mixte tel
que
l'isobutylchloroformate,
et à une température comprise entre -50 C et la température d'ébullition du
solvant.
Les dérivés 6 sont commerciaux ou synthétisés, selon les méthodes connues de
l'homme
du métier, à partir des précurseurs adéquats commerciaux.
Les composés de formule (1) peuvent être préaprés par réaction d'un dérivé
acide 5 avec un dérivé
aminé 6 sont mis en réaction dans un solvant inerte ; en présence d'un agent
de couplage et
éventuellement d'un additif évitant la racémisation, on déprotège
éventuellement le produit puis
on isole le produit et on le transforme éventuellement en sel d'addition à un
acide.
Les composés de formule (I) peuvent être purifiés par les méthodes connues
habituelles,
par exemple, par cristallisation, chromatographie ou extraction.
Les énantiomères des composés de formule (I) peuvent être obtenus par
dédoublement des
racémiques, par exemple, par chromatographie sur colonne chirale selon PIRKLE
W.H. et coll.,
Asynimetric Synthesis, vol. 1, Academic Press (1983) ou, par formation de sels
ou par synthèse à
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
7
partir des précurseurs chiraux. Les diastéréoisomères peuvent être préparés
selon les méthodes
classiques connues (cristallisation, chromatographie ou à partir des
précurseurs chiraux).
La présente invention concerne également le procédé de préparation des
intermédiaires.
Les exemples suivants décrivent la préparation de certains composés conformes
à
l'invention. Ces exemples ne sont pas limitatifs et ne font qu'illustrer la
présente invention. Les
numéros des composés exemplifiés renvoient à ceux donnés dans le tableau ci-
après, qui illustre
les structures chimiques et les propriétés physiques de quelques composés
selon l'invention.
Exemple 1 : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(rnéthylsulfonyl)amino]-
N-[3-(2-oxopyrrolidin-1-yl)propyl]benzamide(Composé n 1) 0,5 g d'acide 3-[{1-
[bis(4-
chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)-amino]benzoïque, 10 cm3 de
dichlorométhane et 0,115 cm3 de 1-(3-aminopropyl)pyrrolidin-2-one sont agités
à une
température proche de 20 C. 1,4 g de résine scavenger (PS-carbodiimide,
Argonaut loading 1,3
mmol/g) est ajouté puis le milieu réactionnel est agité pendant 20 heures à
une température proche
de 20 C. La résine est filtrée et le filtrat est concentré à sec à
l'évaporateur rotatif sous pression
réduite (20 kPa). Le produit brut obtenu est purifié par chromatographie flash
sur une cartouche
de 30 g de silice Merck (granulométrie : 15-40 m ; gradient d'élution:
acétate d'éthyle/méthanol
100/0 à 9515). Après concentration des fractions sous pression réduite, on
obtient 0,082 g de 3-
[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[3-(2-
oxopyrrolidin-1-
yl)propyl]benzamide sous la forme d'une mousse blanche.
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 1,71
(m,
2H); 1,91 (m, 2H); 2,21 (t, J=8,0 Hz, 2H); 2,70 (t, J=7,5 Hz, 2H); 2,96 (s,
3H); 3,17 - 3,38
(m partiellement masqué, 8H); 4,38 (s, 1H); 4,72 (m, 1H); 7,30 (d, J=9,0 Hz,
4H); 7,35 (d,
J=9,0 Hz, 4H); 7,43 - 7,54 (m, 2H); 7,75 (s large, 1H); 7,81 (d large, J=8,0
Hz, 1H); 8,50
(t, J=6,5 Hz, 1H).
Spectre de masse: ES m/z=629 ([MH*] pic de base)
Analyse élémentaire:
Calculée: C: 59,14%- H: 5,44%- N: 8,80%- S: 5,09%
Mesurée: C: 58,61%- H: 5,43%- N: 8,76%- S: 5,10%- H20: 1,17%
Exemple 2 : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)
amino]-N-(1,1-dioxidotétrahydrothiophén-3-yl)benzamide (Composé n 2) A une
solution
de 0,5 g d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]benzoïque dans 10 cm3 de dichlorométhane sont ajoutés
0,209 g de
chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide, 0,153 cm3 de
triéthylamine puis
0,187 g de chlorhydrate de tétrahydrothiophén-3-amine- 1, 1 -dioxyde. Le
milieu réactionnel est
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
8
agité pendant 24 heures sous atmosphère inerte à une température proche de 20
C. 20 cm3 d'une
solution aqueuse saturée en chlorure de sodium sont ajoutés au milieu
réactionnel. Après
décantation, la phase aqueuse est extraite avec du dichlorométhane. Les phases
organiques sont
réunies, séchées sur sulfate de magnésium, filtrées et concentrées à sec à
l'évaporateur rotatif
sous pression réduite (5 kPa). On obtient 0,587 g de produit qui est purifié
par chromatographie
flash sur une cartouche de 30 g de silice Merck (granulométrie : 15-40 gin;
éluant : acétate
d'éthyle 100). Après concentration des fractions sous pression réduite, on
obtient 0,246 g de 3-
[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-N-(1,1-
dioxidotétrahydrothiophén-3-yl)benzamide sous la forme d'une mousse blanche.
Spectre RMN 1H (300 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm) :
2,21 (m,
1H); 2,43 (m partiellement masqué, 1H); 2,69 (t, J=7,5 Hz, 2H); 2,97 (s, 3H);
3,08 (dd,
J=8,0; 13,0 Hz, 1H); 3,12 - 3,43 (m partiellement masqué, 4H); 3,50 (dd,
J=8,0; 13,0 Hz,
1H); 4,37 (s, 1H); 4,60 - 4,80 (m, 2H); 7,30 (d, J=9,0 Hz, 4H); 7,36 (d, J=9,0
Hz, 4H);
7,45 - 7,57 (m, 2H); 7,78 (s, 1H); 7,83 (m, 1H); 8,78 (d, J=7,0 Hz, 1H)
Spectre de masse: ES m/z=622 ([MHE], pic de base)
Analyse élémentaire:
Calculée: C: 54,02%- H: 4,70%- N: 6,75%- S: 10,30%-C1: 11,39%
Mesurée: C: 53,50%- H: 4,27%- N: 6,63%- S: 10,44%-Cl: 11,71%- H2O: 1,28%
Exemple 3: (-)-3-[{1-[bis(4-ehlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)
amino]-N-[1,1-dioxidotétrahydrothiophén-3-yl]benzamide(Composé n 7)
601 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-
(1,1-dioxidotétrahydrothiophén-3-yl)benzamide sont injectés sur une colonne
contenant 700 g de
phase stationnaire chirale Chirobiotic TAG 10 m. L'élution est effectuée à
130 cm3 par minute
avec comme éluant du méthanol à 100%. L'énantiomère lévogyre est élué en
première position.
Après concentration du solvant, on obtient 206 mg de (-)-3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[ 1,1-
dioxidotétrahydrothiophén-3-
yl]benzamide sous forme d'une poudre blanche.
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,21
(m, 1H); 2,43 (m partiellement masqué, 1H); 2,70 (m, 2H); 2,96 (s, 3H); 3,08
(dd,
J=13,7; 7,8 Hz, 1H); 3,17 - 3,54 (m partiellement masqué, 5H); 4,37 (s, 1H);
4,63 - 4,79
(m, 2H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,46 - 7,54 (m, 2H);
7,77 (s
large, 1H); 7,84 (m, 1H); 8,77 (d, J=7,1 Hz, 1H)
Spectre de masse : ES m/z=622 [M+H]}; m/z=620 [M-M-
Analyse élémentaire :
Calculée: C: 54,02%- H: 4,70%- N: 6,75%- S: 10,30%
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
9
Mesurée: C: 53,82%- H. 4,94%- N: 6,65%- S: 9,81% - H2O: 1,00%
Pouvoir rotatoire : aD = - 21,1 +/- 0,8 (c=0,346, DMSO)
Exemple 4 : (+)-3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)
aminol-N-[1,1-dioxidotétrahydrothiophén-3-yl]benzamide (Composé n 8)
L'énantiomère
dextrogyre a été élué en deuxième position lors de la séparation effectuée
dans l'exemple 3.
Après concentration du solvant, on obtient 176 mg de (+)-3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[ 1,1-
dioxidotétrahydrothiophén-3-
yl]benzamide sous forme d'une poudre blanche.
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,21
(m,
1H); 2,43 (m partiellement masqué, 1H); 2,70 (m, 2H); 2,96 (s, 3H); 3,07 (dd,
J=13,7; 7,8
Hz, 1H); 3,15 - 3,41 (m partiellement masqué, 4H); 3,49 (dd, >13,7; 8,1 Hz,
1H); 4,37
(s, 1H); 4,63 - 4,79 (m, 2H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H);
7,46 - 7,54
(m, 2H); 7,77 (s large, 1H); 7,84 (m, 1H); 8,76 (d, J=7,3 Hz, 1H)
Spectre de masse : ES ni/z=622 [M+H]}; m/z=620 [M-Hl-
Analyse élémentaire:
Calculée: C: 54,02%- H: 4,70%- N: 6,75%- S: 10,30%
Mesurée: C: 53,68%- H: 4,77%- N: 6,90%- S: 9,68% - H20: 1,69%
Pouvoir rotatoire : aD = + 11,5 +/- 0,5 (c=0,391, DMSO)
Exemple 5 : Chlorhydrate (2 :1) de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)aminol-N-[(1-éthylpyrrolidin-2-yl)méthyl]benzamide (Composé
n 3)
5a : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)aminoJ-N-
[(1-
éthylpyrrolidin-2-yl)méthyl] benzamide
A une solution de 0,6 g d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]benzoïque, 20 em3 de tétrahydrofurane et 0,217 cm3 de
triéthylamine
est ajouté goutte à goutte 0,177 cm3 de chloroformate d'isobutyle sous
atmosphère inerte à une
température proche de -5 C. La suspension obtenue est agitée pendant 40
minutes à une
température inférieure à 10 C. 0,225 cm3 de 1-(1-éthylpyrrolidin-2-
yl)méthanamine est ajouté à
une température proche de -5 C. On laisse le mélange réactionnel remonter
progressivement à
une température proche de 20 C puis on agite pendant 24 heures à cette
température. Une solution
aqueuse saturée en chlorure de sodium est ajoutée au milieu réactionnel. Après
décantation, la
phase aqueuse est extraite par du dichlorométhane. Les phases organiques sont
réunies, séchées
sur sulfate de magnésium, filtrées et concentrées à sec à l'évaporateur
rotatif sous pression réduite
(5 kPa). On obtient 0,972 g de produit brut qui est purifié par
chromatographie flash sur une
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
cartouche de 90 g de silice Merck (granulométrie : 15-40 pm ; éluant :
dichlorométhane/méthanol
96/4). Après concentration des fractions sous pression réduite, on obtient
0,248 g de 3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[(1-
éthylpyrrolidin-2-
yl)méthyl]benzamide.
5 Spectre de masse: ES m/z=615 (MEI)
Sb : Chlorhydrate (2 :1) de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthyl
sulfonyl)amino]-N-[(1-éthylpyrrolidin-2-yl)méthyl]benzamide (Composé n 3)
Après
filtration de la suspension de 0,195 g de 3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-
yl} (méthylsulfonyl)amino]-N-[(1-éthylpyrrolidin-2-yl)méthyl]benzamide dans du
10 dichlorométhane, on ajoute 1,58 cm3 d'une solution d'acide chlorhydrique 1N
dans l'éther
éthylique. Le milieu réactionnel est concentré à sec à l'évaporateur rotatif
sous pression réduite
(5 kPa). On obtient 0,19 g de chlorhydrate de 3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-{(1-éthylpyrrolidin-2-yl)méthyl]benzamide sous
forme d'un solide
blanc,
Spectre RMN 1H (400 MHz ; (b en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): pour
ce
lot, nous observons un mélange 70% - 30% de conformères et une salification
par 2 HCl
avec : 1,29 (t, J = 6,5 Hz, 3H) ; de 1,75 à 2,03 (m, 3H) ; 2,12 (m, 1H); 3,02
(s, 3H) ; de
3,03 à 3,15 (m, 2H) ; 3,43 (m, 1H) ; 3,54 (m, 1H) ; 3,63 (m, 2H) ; de 3,70 à
4,18 (m
partiellement masqué, 5H) ; 5,05 (m étalé, 0,7H) ; 5,48 (m étalé, 0,3H) ; 5,95
(m étalé,
0,7H) ; 6,10 (m étalé, 0,3H) ; de 7,30 à 7,75 (m, 10H) ; de 7,90 à 8,03 (m,
2H) ; 9,15 (t, J
= 6,0 Hz, 1H) ; 10,1 (m large, 0,3H) ; 10,2 (m large, 0,7H) ; 12,65 (m étalé,
0,3H) ; 13,05
(m étalé, 0,7H).
Spectre de masse: ES m/z=615 (MW); m/z=381 ([MH - C13H9C12 + H]+, pic de
base);
m/z=235 (C13H9Cl2})
Analyse élémentaire:
Calculée: C: 57,10%- H: 5,72%- N: 8,59%- S: 4,92%- Cl: 16,31%
Mesurée: C: 52,955%- H: 5,99%- N: 7,40%- S: 4,18%- Cl: 19,90%-H20: 2,21%
Exemple 6: (+)-3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-{[1-éthylpyrrolidin-2-yl]méthyl}benzamide (Composé
n 6)
A une solution de 0,3 g d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]benzoïque dans 3 cm3 de dichlorométhane sont
additionnés 84 mg
de (R)-(+)-2-aminomethyl-1-éthylpyrrolidine. Le milieu réactionnel est agité
pendant 10
minutes à une température voisine de 20 C avant d'ajouter 136 mg de
chlorhydrate de 1-(3-
diméthylaminopropyl)-3-éthylcarbodiimide. Après une nuit d'agitation à une
température
voisine de 20 C, le milieu réactionnel est dilué avec 25 cm3 d'eau et 20 cm3
de
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
11
dichlorométhane. Après décantation, la phase aqueuse est extraite 2 fois avec
20 cm3 de
dichlorométhane. Les phases organiques réunies sont séchées, filtrées puis
concentrées à sec
sous pression réduite. Le brut réactionnel obtenu est purifié par
chromatographie flash sur une
colonne de 30 g de silice (gradient d'élution : acétonitrile/méthanol :
jusqu'à 80/20). Après
concentration des fractions sous pression réduite, on obtient une meringue
blanche qui est
solubilisée dans un minimum de dichlorométhane. A cette solution est
additionnée de l'heptane
jusqu'à obtention d'un trouble. Après concentration de la suspension sous vide
et séchage à
l'étuve pendant une nuit, on obtient 137 mg de (+)-3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-
3-yl}(méthylsulfonyl)amino]-N-{[1-éthylpyrrolidin-2-yl]méthyl}benzamide sous
forme d'une
mousse blanche.
Pf : 122 C
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 1,02
(t,
J=7,1 Hz, 3H); 1,51 - 1,67 (m, 3H); 1,77 (m, 1H); 2,12 (m, 1H); 2,26 (m, 1H);
2,58 (m,
1H); 2,70 (t, J=6,7 Hz, 2H); 2,81 (m, 1H); 2,96 (s, 3H); 3,01 (m, 1H); 3,07
(m, 1H); 3,24
- 3,42 (m partiellement masqué, 3H); 4,37 (s, 1H); 4,73 (m, 1H); 7,30 (d,
J=8,8 Hz, 4H);
7,35 (d, J=8,8 Hz, 4H); 7,43 - 7,53 (m, 2H); 7,75 (t, J=1,8 Hz, 1H); 7,80 (dt,
J=7,5; 1,8
Hz, 1H); 8,45 (t, J=5,9 Hz, 1H)
Spectre de masse : ES m/z=615 [M+H]+; m/z=381 ([M-C13H8C12+H]+, pic de base);
m/z=613 [M-H] mlz=659 ([M+HCO2H-H,] pic de base)
Pouvoir rotatoire : aD = + 24,5 +I- 0,8 (c=0,349, MeOH)
Exemple 7: (-)-3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-{[1-éthylpyrrolidin-2-yl]méthyl}benzamide (Composé
n 5)
Le (-)-3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-N-
{[1-
éthylpyrrolidin-2-yl]méthyl}benzamide est synthétisé comme décrit à l'exemple
6, en partant de
0,3 g d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]benzoïque, 3
cm3 de dichlorométhane, 84 mg de (S)-(-)-2-aminomethyl-1-éthylpyrrolidine et
136 mg de
chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide. Après réaction,
traitement et
purification, on obtient 153 mg de (-)-3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-{[1-éthylpyrrolidin-2-yl]méthyl}benzamide sous
forme d'une
mousse blanche.
Pf : 128 C
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 1,02
(t,
J=7,1 Hz, 3H); 1,51 - 1,67 (m, 3H); 1,77 (m, 1H); 2,12 (m, 1H); 2,27 (m, 1H);
2,58 (m,
1H); 2,70 (t, J=6,7 Hz, 2H); 2,81 (m, 1H); 2,96 (s, 3H); 3,01 (m, 1H); 3,07
(m, 1H); 3,24 -
3,42 (m partiellement masqué, 3H); 4,37 (s, 1H); 4,73 (m, 1H); 7,30 (d, J=8,8
Hz, 4H);
7,35 (d, J=8,8 Hz, 4H); 7,43 - 7,53 (m, 2H); 7,75 (t, J=1,8 Hz, 1H); 7,80 (dt,
J=7,5; 1,8
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
12
Hz, 1H); 8,45 (t, J=5,9 Hz, 1H)
Spectre de masse : ES m/z=615 [M+H]+, m/z =381 ([M-C13H8C12+H]+, pic de base),
m/z=613 [M-H]", m/z''659 ([M+HCO2H-H]", pic de base)
Pouvoir rotatoire : aD =- 22 +/- 0,9 (c=0,284, MeOH)
Exemple 8 :3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-
5-fluoro-N-(2-oxopyrrolidin-3-yl)benzamide (Composé n 14) A une solution de
0,50 g d'acide
3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino)-5-
fluorobenzoïque dans
cm3 de tétrahydrofuranne agitée à une température voisine de -30 C, sont
successivement
additionnés 0,333 cm3 de triéthylamine et 0,135 cm3 de chloroformiate
d'isobutyle. Le milieu
10 réactionnel est agité pendant 1 heure en ramenant la température de -30 C à
0 C, puis 30 minutes
en ramenant la température de 0 C à 4 C. On ajoute alors 144 mg de 3-amino-2-
pyrrolidone et 5
cm3 de tétrahydrofuranne. Après 19 heures d'agitation à une température
voisine de 20 C, le
milieu réactionnel est refroidi à une température proche de -20 C avant
hydrolyse avec 15 cm3
d'eau. Le milieu est ensuite agité 1 heure à une température voisine de 20 C
puis extrait 3 fois
avec 20 cm3 d'acétate d'éthyle. Les phases organiques sont réunies, séchées
sur sulfate de
magnésium puis filtrées avant concentration à sec. On obtient 590 mg d'une
meringue jaune qui
est purifiée par chromatographie flash sur une colonne de 30 g de silice
(Merck, 15-40 m,
éluant : acétate d'éthyle/méthanol 98/2). Après concentration des fractions
sous pression réduite,
on obtient 282 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-5-
fluoro-N-(2-oxopyrrolidin-3-yl)benzamide sous forme d'une meringue blanche.
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,01
(m,
1H); 2,36 (m, 1H); 2,74 (m, 2H); 3,00 (s, 3H); 3,24 (m, 2H); 3,36 (m, 2H);
4,40 (s, 1H);
4,54 (m, 1H); 4,72 (m, 1H); 7,30 - 7,38 (m, 8H); 7,44 (dt, J=9,3; 2,1 Hz, 1H);
7,67 (s
large, 1H); 7,68 (m, 1H); 7,86 (s, 1H); 8,83 (d, J=8,3 Hz, 1H)
Spectre de masse : ES ni/z=605 [M+H]+; m/z=603 [M-H] m/z=649 [M+HCO2H-H]'
Analyse élémentaire:
Calculée: C: 55,54%- H: 4,49%- N: 9,25%- S: 5,30%
Mesurée: C: 55,77%- H: 4,72%- N: 8,91%- S: 4,93
Exemple 9: (+)-3-[{1-[bis(4-chlorophényl)méthyljazétidin-3-yl}(méthylsulfonyl)
amino]-5-fluoro-N-[2-oxopyrrolidin-3-yl]benzamide (Composé n 15)
990 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-5-
fluoro N-(2-oxopyrrolidin-3-yl)benzamide sont injectés sur une colonne
contenant une phase
stationnaire chirale Chiralpak IA 20 m. L'élution est effectuée à 120 cm3 par
minute avec
comme éluant un mélange acétonitrile/isopropanol 90/10. L'énantiomère
dextrogyre est élué en
première position. Après concentration du solvant, on obtient 360 mg de (+)-3-
[{1-[bis(4-
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
13
chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-fluoro-N-[2-
oxopyrrolidin-3-
yl]benzamide sous forme d'une meringue blanche.
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm: 2,00
(m,
1H); 2,35 (m, 1H); 2,74 (m, 2H); 3,00 (s, 3H); 3,25 (m, 2H); 3,36 (m, 2H);
4,40 (s, 1H);
4,53 (m, 1H); 4,72 (m, 1H); 7,31 (d, J=8,6 Hz, 4H); 7,36 (d, J=8,6 Hz, 4H);
7,44 (d large,
J=9,5 Hz, 1H); 7,64 - 7,74 (m, 2H); 7,87 (d large, 1H); 8,84 (d large, J=8,6
Hz, 1H)
Spectre de masse : ES m/z=605 [M+H]+; m/z=603 [M-H]-
Analyse élémentaire:
Calculée: C: 55,54%- H: 4,49%- N. 9,25%- S: 5,30%
Mesurée: C: 55,32%- H: 4,86%- N: 8,92%- S: 5,06%
Pouvoir rotatoire : aD = + 7,4 +/- 0,5 (c=0,482, DMSO)
Exemple 10: (-)-3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)
amino]-5-fluoro-N-[2-oxopyrrolidin-3-yl]benzamide(Composé n 16) L'énantiomère
lévogyre
est élué en deuxième position. Après concentration du solvant, on obtient 466
mg de (-)-3-[{1-
[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-5-fluoro-N-[2-
oxopyrrolidin-3-
yl]benzamide sous forme d'une meringue blanche.
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,00
(m,
1H); 2,34 (m, 1H) ; 2,74 (m, 2H) ; 3,00 (s, 3H) ; 3,25 (m, 2H); 3,36 (m, 2H);
4,40 (s, 1H);
4,53 (m, 1H); 4,72 (m, 1H); 7,31 (d, J=8,6 Hz, 4H); 7,35 (d, J=8,6 Hz, 4H);
7,44 (d large,
J=9,3 Hz, 1H); 7,62 - 7,72 (m, 2H); 7,87 (s large, 1H); 8,84 (d, J=8,3 Hz, 1H)
Spectre de masse : ES m/z=605 [M+H]+; in/z--603 [M-H] m/z=649 [M+HCO2H-H]"
Analyse élémentaire:
Calculée: C: 55,54%- H: 4,49%- N: 9,25%- S: 5,30%
Mesurée: C: 55,21%- H: 4,73%- N: 9,07%- S: 4,95%
Pouvoir rotatoire : aD = - 9,4 +/- 0,6 (c=0,433, DMSO)
Le tableau 1 qui suit illustre les structures chimiques (I) et les propriétés
physiques de
quelques exemples de composés selon l'invention. Dans ce tableau :
- R représente un groupe méthyle;
- R3 et R4 représentent chacun un groupe phényle substitué par un atome de
chlore en
position para;
SO2R O
N N,R2
R3 NJ 1 1
R1
R4 Y (I)
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
14
Tableau 1
R1~ R2
N N Y Chiralité / Sel / Caractérisations
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm); 1,71 (m, 2H); 1,91 (m, 2H);
2,21 (t, J=8,0 Hz, 2H); 2,70 (t, J=7,5 Hz, 2H); 2,96 (s,
O 311); 3,17 - 3,38 (m partiellement masqué, 8H); 4,38 (s,
1H); 4,72 (m, 1H); 7,30 (d, J=9,0 Hz, 4H); 7,35 (d,
1 H H J=9,0 Hz, 4H); 7,43 - 7,54 (m, 2H); 7,75 (s large, 1H);
NN 7,81 (d large, J=8,0 Hz, 1H); 8,50 (t, J=6,5 Hz, 1H);
Spectre de masse : ES : mlz=629 (MH+, pic de base);
Analyse élémentaire: Calculée: C: 59,14%- H: 5,44%-
N: 8,90%- S: 5,09%; Mesurée: C: 58,61%- H: 5,43%-
N: 8,76%- S: 5,10% - H2O : 1,17%
Spectre RMN 1H (300 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,21 (m, 1H); 2,43 (m
partiellement masqué, 1H); 2,69 (t, J=7,5 Hz, 2H); 2,97
(s, 3H); 3,08 (dd, J=8,0; 13,0 Hz, 1H); 3,12 - 3,43 (m
O Jo partiellement masqué, 4H); 3,50 (dd, J=8,0; 13,0 Hz,
s 1H); 4,37 (s, 1H); 4,60 - 4,80 (m, 2H); 7,30 (d, J=9,0
2 ~N~ H Hz, 4H); 7,36 (d, J=9,0 Hz, 4H); 7,45 - 7,57 (m, 2H);
7,78 (s, 1H); 7,83 (m, 1H); 8,78 (d, J=7,0 Hz, 1H);
H Spectre de masse : ES : m/z=622 (MH+,pic de base);
Analyse élémentaire: Calculée: C: 54,02%- H: 4,70%-
N: 6,75%- S: 10,3%- Cl 11,39%; Mesurée: C: 53,50%-
H: 4,27%- N: 6,63%- S: 10,44%- Cl 11,71% - H20:
1,28%
2HCl;
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): Pour ce lot, nous observons
un mélange 70% - 30% de conformères et une
salification par 2 HCl avec : 1,29 (t, J=6,5 Hz, 3H); 1,75
- 2,03 (m, 3H); 2,12 (m, IH); 3,02 (s, 3H); 3,03 - 3,15
'I (m, 2H); 3,43 (m, 1H); 3,54 (m, 1H); 3,63 (m, 2H); 3,70
3 ' H - 4,18 (m partiellement masqué, 5H); 5,05 (m étalé,
0,7H); 5,48 (m étalé, 0,3H); 5,95 (m étalé, 0,7H); 6,10
(m étalé, 0,3H); 7,30 - 7,75 (m, 10H); 7,90 - 8,03 (m,
2H); 9,15 (t, J=6,0 Hz, 1H); 10,1 (m large, 0,3H); 10,2
(m large, 0,7H); 12,65 (m étalé, 0,3H); 13,05 (m étalé,
0,7H); Spectre de masse : ES : m/z=615 (MH+),
m/z=381 (MH - C13H9C12 + H)+, pic de base), in/z--235
(C13H9C12+)
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
H Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
iN d6) ; référencé à 2,50 ppm): 1,38 (m, 9H); 1,76 (m, 2H);
4 N o H 2,89 - 2,60 (m, 4H); 2,92 (s, 3H); 3,28 (m, 4H); 3,92 (m,
y 3H); 4,34 (s, 1H); 4,70 (m, 1H); 7,30 (m, 8H); 7,45 (m,
2H); 7,73 (m, 1H); 7,79 (m, 1H); 8,27 (d, J=8 Hz, 1H);
S ectre de masse : ES m/z=686 (MH+)
Chiral (-);
Pf : 128 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 1,02 (t, J=7,1 Hz,
3H); 1,51 - 1,67 (m, 3H); 1,77 (m, 1H); 2,12 (m, 1H);
2,27 (m, 1H); 2,58 (m, 1H); 2,70 (t, J=6,7 Hz, 2H); 2,81
}j (m, 1H); 2,96 (s, 3H); 3,01 (m, 1H); 3,07 (m, 1H); 3,24
5 N H - 3,42 (m partiellement masqué, 3H); 4,37 (s, 1H); 4,73
(m, 1H); 7,30 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H);
7,43 - 7,53 (m, 2H); 7,75 (t, J=1,8 Hz, 1H); 7,80 (dt,
J=7,5; 1,8 Hz, 1H); 8,45 (t, J=5,9 Hz, 1H); Spectre de
masse : ES : m/z=615 [M+H]+, m/z=381 ([M-
C13H8C12+H]+, pic de base), m/z=613 [M-H] m/z=659
([M+HCO2H-Hf, pic de base); Pouvoir rotatoire : aD =
- 22 +/- 0,9 (c=0,284, MeOH)
Chiral (+);
Pf : 122 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 1,02 (t, J=7,1 Hz,
3H); 1,51 - 1,67 (m, 3H); 1,77 (m, 1H); 2,12 (m, 1H);
2,26 (m, 1H); 2,58 (m, IH); 2,70 (t, J=6,7 Hz, 2H); 2,81
H (m, IH); 2,96 (s, 3H); 3,01 (m, 1H); 3,07 (m, 1H); 3,24
6 N H - 3,42 (m partiellement masqué, 3H); 4,37 (s, 1H); 4,73
(m, 1H); 7,30 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H);
7,43 - 7,53 (m, 2H); 7,75 (t, J=1,8 Hz, 1H); 7,80 (dt,
J=7,5; 1,8 Hz, 1H); 8,45 (t, J=5,9 Hz, 1H); Spectre de
masse : ES : m/z=615 [M+H]+; m/z=381 ([M-
C13H8C12+H]+, pic de base); m/z=613 [M-H]`; m/z=659
([M+HCO2H-H]-, pic de base); Pouvoir rotatoire : aD =
+ 24,5 +/- 0,8 (c=0,349, MeOH)
Chiral (-);
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,21 (m, 1H); 2,43 (m
partiellement masqué, 1H); 2,70 (m, 2H); 2,96 (s, 3H);
p O 3,08 (dd, J=13,7; 7,8 Hz, 1H); 3,17 - 3,54 (m
~S partiellement masqué, 5H); 4,37 (s, 1H); 4,63 - 4,79 (m,
2H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H);
7 N H 7,46 - 7,54 (m, 2H); 7,77 (s large, 1H); 7,84 (m, 1H);
H 8,77 (d, J=7,1 Hz, 1H); Spectre de masse : ES :
m/z=622 [M+H]+; m/z=620 [M-H]"; Analyse
élémentaire: Calculée: C: 54,02%- H: 4,70%- N:
6,75%- S: 10,3%; Mesurée: C: 53,82%- H: 4,94%- N:
6,65%- S: 9,81% - H2O : 1,00%; Pouvoir rotatoire : aD
_ - 21,1 +/- 0,8 (c=0,346, DMSO)
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
16
Chiral (+);
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,21 (m, 1H); 2,43 (m
partiellement masqué, 1H); 2,70 (m, 2H); 2,96 (s, 3H);
p 3,07 (dd, J=13,7; 7,8 Hz, 1H); 3,15 - 3,41 (m
~S partiellement masqué, 4H); 3,49 (dd, J=13,7; 8,1 Hz,
1H); 4,37 (s, 1H); 4,63 - 4,79 (m, 2H); 7,31 (d, J=8,8
8 N H Hz, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,46 - 7,54 (in, 2H);
Fi 7,77 (s large, 1H); 7,84 (m, 1H); 8,76 (d, J=7,3 Hz, 1H);
Spectre de masse : ES: m/z=622 [M+H]+ ; ni/z--620
[M-H] Analyse élémentaire: Calculée: C: 54,02%- H:
4,70%- N: 6,75%- S: 10,30%; Mesurée: C: 53,68%- H:
4,77%- N: 6,90%- S: 9,68% - H2O : 1,69%; Pouvoir
rotatoire : ap = + 11,5 +/- 0,5 (c=0,391, DMSO)
Pf : 130 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,70 (t, J=7,2 Hz,
H O 2H); 2,96 (s, 3H); 3,16 - 3,25 (m, 4H); 3,28 - 3,42 (m
l' partiellement masqué, 6H); 4,37 (s, 1H); 4,72 (m, 1H);
9 / N N H 6,26 (s, 1H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz,
NH 4H); 7,44 - 7,51 (m, 2H); 7,71 (s large, 1H); 7,78 (d
large, J=7,7 Hz, 1H); 8,58 (t, J=5,7 Hz, 1H); Spectre de
masse : ES : m/z=616 ([M+H]+, pic de base); m/z=1231
[2M+H]+
Pf : 210 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 1,66 (m, 2H) ;
2,09 (m, 2H); 2,60 - 2,77 (m, 6H); 2,96 (s, 3H); 3,33 (m
partiellement masqué, 2H); 3,82 (m, 1H); 4,37 (s, 1H);
4,74 (m, 1H); 7,30 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz,
N
H 4H); 7,44 - 7,53 (m, 2H); 7,76 (s large, 1H); 7,82 (m,
S 1H); 8,37 (d, J=8,1 Hz, 1H); Spectre de masse : ES :
m/z=604 ([M+H]+, pic de base); m/z--1206 [2M+H]+;
Analyse élémentaire: Calculée: C: 57,61%- H: 5,17%-
N: 6,95%- S: 10,61% ; Mesurée: C: 57,39%- H: 5,26%-
N: 6,88%- S: 10,32
Pf : 270 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,01 - 2,17 (m,
H 4H); 2,70 (t, J=7,3 Hz, 2H); 2,96 (s, 3H); 3,11 (m, 2H);
3,27 - 3,39 (m, 4H); 4,21 (m, 1H); 4,38 (s, 1H); 4,74
(m, 1H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H);
il H 7,45 - 7,53 (m, 2H); 7,76 (s large, 1H); 7,84 (m, 1H);
SJO 8,45 (d, J=8,3 Hz, 1H); Spectre de masse : ES :
~ ni/z--636 [M+H]+; m/z=634 ([M-H]-; pic de base);
m/z=680 [M+HCO2H-H]"; Analyse élémentaire:
Calculée: C: 54,71%- H: 4,91%- N: 6,60%- S: 10,07%;
Mesurée: C: 54,76%- H: 4,92%- N: 6,62%- S: 9,73
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 1,41 (s, 9H) ; 2,72 (t, J=7
N--~~/N-~ Hz, 2H) ; 2,98 (s, 3H) ; 3,35 (m, 2H) ; 3,88 (m, 2H);
12 ~-{ p H 4,13 (t, J=8 Hz, 2H); 4,38 (s, 1H); 4,66 (m, 1H); 4,75
(m, IH); 7,34 (m, 8H); 7,53 (m, 2H); 7,81 (s, 1H); 7,87
(m, 1H); 9,01 (d, J=7 Hz, 1H); Spectre de masse : ES
ni/z--659 (MH+)
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
17
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,02 (m, 1H); 2,35 (m, 1H);
2,71 (m, 2H); 2,97 (s, 3H); 3,21 - 3,38 (m, 4H); 4,37 (s,
H O 1H); 4,54 (m, 1H); 4,73 (m, 1H); 7,26 - 7,38 (m, 8H);
7,44 - 7,56 (m, 2H); 7,79 (s large, 1H); 7,84 (s large,
13 /N H 1H); 7,85 (m, 1H); 8,75 (d, J=8,3 Hz, 1H); Spectre de
masse : ES : m/z=587 [M+H]+; m/z=585 [M-H]";
LJNH
m/z=631 ([M+HCO2H-H]", pic de base); Analyse
élémentaire: Calculée: C: 57,24%- H: 4,80%- N:
9,54%- S: 5,46%; Mesurée: C: 56,87%- H: 4,94%- N:
9,04%- S: 5,18- H2O : 0,48%
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,01 (m, 1H); 2,36 (m, 1H);
H O 2,74 (m, 2H); 3,00 (s, 3H); 3,24 (m, 2H); 3,36 (m, 2H);
4,40 (s, 1H); 4,54 (m, 1H); 4,72 (m, 1H); 7,30 - 7,38
14 N F (m, 8H); 7,44 (dt, J=9,3; 2,1 Hz, 1H); 7,67 (s large, 1H);
NH 7,68 (m, 1H); 7,86 (s, 1H); 8,83 (d, J=8,3 Hz, 1H);
Spectre de masse : ES : ni/z--605 [M+H]+; m/z=603 [M-
H] m/z=649 [M+HCO2H-H]-; Analyse élémentaire:
Calculée: C: 55,54%- H: 4,49%- N: 9,25%- S: 5,30%;
Mesurée: C: 55,77%- H: 4,72%- N: 8,91%- S: 4,93
Chiral (+);
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,00 (m, 1H); 2,35 (m, 1H);
2,74 (m, 2H); 3,00 (s, 3H); 3,25 (m, 2H); 3,36 (m, 2H);
H 0 4,40 (s, 1H); 4,53 (m, 1H); 4,72 (m, 1H); 7,31 (d, J=8,6
Hz, 4H); 7,36 (d, J=8,6 Hz, 4H); 7,44 (d large, J=9,5
15 /N F Hz, 1H); 7,64 - 7,74 (m, 2H); 7,87 (d large, 1H); 8,84
NH (d large, J=8,6 Hz, 1H); Spectre de masse : ES :
ni/z--605 [M+H]+; m/z=603 [M-H] Analyse
élémentaire: Calculée: C: 55,54%- H: 4,49%- N:
9,25%- S: 5,30%; Mesurée: C: 55,32%- H: 4,86%- N:
8,92%- S: 5,06%; Pouvoir rotatoire : c D = + 7,4 +/- 0,5
(c=0,482, DMSO)
Chiral (-);
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
d6) ; référencé à 2,50 ppm): 2,00 (m, 1H); 2,34 (m, 1H);
2,74 (m, 2H); 3,00 (s, 3H); 3,25 (m, 2H); 3,36 (m, 2H);
4,40 (s, 1H); 4,53 (m, 1H); 4,72 (m, 1H); 7,31 (d, J=8,6
H / Hz, 4H); 7,35 (d, J=8,6 Hz, 4H); 7,44 (d large, >9,3
16 /N F Hz, 1H); 7,62 - 7,72 (m, 2H); 7,87 (s large, 1H); 8,84
NH (d, J=8,3 Hz, 1H); Spectre de masse : ES : m/z=605
[M+H]+; m/z=603 [M-H] ni/z--649 [M+HCO2H-H]
Analyse élémentaire: Calculée: C: 55,54%- H. 4,49%-
N: 9,25%- S: 5,30%; Mesurée: C: 55,21%- H: 4,73%-
N: 9,07%- S: 4,95%; Pouvoir rotatoire : aD 9,4 +/-
0,6 (c=0,433, DMSO)
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant de déterminer
l'activité vis-à-vis des récepteurs humains aux cannabinoïdes de type CB1.
L'efficacité des
composés de formule (I) a été déterminée dans un test fonctionnel mesurant
l'activité des
récepteurs aux cannabinoïdes CB1 (test de l'AMP cyclique intracellulaire). Le
test de détection de
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
18
l'AMP cyclique intracellulaire dans les cellules U373MG exprimant
naturellement le récepteur
CB 1 humain, a été effectué comme décrit dans la référence: Bouaboula et al.,
1995, J. Biol. Chem.
270:13973-13980. Le kit IITRF cAMP Dynamic Kit de CisBio a été utilisé pour la
quantification
de l'AMP cyclique intracellulaire. Dans ce test, les CI50 sont comprises entre
0,001 pM et 1 M.
Par exemple, les composés n S 9, 14, 16, 2 ont montré des C150 respectivement
130, 9, 7,
47 nM.
D'autres essais consistant à mesurer l'activité in vivo des composés de
l'invention ont été
effectués. Leur activité antagoniste a été montrée au moyen du modèle
d'hypothermie induite par
un agoniste des récepteurs aux cannabinoïdes CB1 (CP55,940 racémique (1RS,
3RS, 4RS)- 3-
[hydroxy-2-(1,1-diméthylheptyl)phényl]-4-(3-hydroxypropyl)cyclohexane-1-ol) à
une dose de
1,25mg/kg) chez la souris, selon la méthode décrite par Pertwee R.G. dans
Marijuana 84, Harvey
D.J. eds, Oxford IRL Press, 263-277 (1985).
Leur activité antagoniste a également été montrée au moyen du modèle de
l'inhibition du
transit gastrointestinal induit par le CP55,940 racémique (1RS, 3RS, 4RS-3-
[hydroxy-2-(1,1-
diméthylheptyl)phényl]-4-(3-hydroxypropyl)cyclohexane-1-ol) chez la souris,
selon la méthode
décrite par Rinaldi-Carmona et al., J.Pharmacol.Exp.Ther. 2004, 310, 905-914.
En bref, des souris
mâles CD 1 reçoivent le produit à tester per os 30 minutes ou 2 heures avant
l'administration de
l'agoniste CP55,940 racémique (1RS, 3RS, 4RS-3-[hydroxy-2-(1,1-
diméthylheptyl)phényl]-4-(3-
hydroxypropyl)cyclohexane-1-ol) (0,15 mg/kg ip en crémophore 10%). Après
encore 30 minutes,
les animaux reçoivent un bolus de charbon po. Trente minutes plus tard, les
animaux sont
euthanasiés (C02/02) et l'intestin est disséqué. La progression du bolus de
charbon dans l'intestin
est exprimée en pourcentage de la longueur totale de l'intestin.
Par exemple, les composés n S 2 à 2mg/kg et 5 à lmg/kg ont montré un
pourcentage d'inhibition
respectivement de 57% et 39% à 3 heures après l'administration du produit.
En conséquence, les composés de l'invention de formule (I) sont des
antagonistes des récepteurs
aux cannabinoïdes de type CB 1 in vitro et in vivo. Certains composés sont
actifs in vivo à la fois
sur le test d'hypothermie et de transit, et certains composés montrent des
activités dissociées entre
le test d'hypothermie et de transit.
Ainsi les composés selon l'invention peuvent être utilisés dans le traitement
ou la
prévention de maladies impliquant les récepteurs aux cannabinoïdes CB1. Ces
composés
présentent une activité périphérique dissociée de l'activité centrale.
Par exemple et de manière non limitative, les composés de formule (I) sont
utiles comme
médicaments psychotropes, notamment pour le traitement des désordres
psychiatriques incluant
l'anxiété, la dépression, les troubles de l'humeur, l'insomnie, les troubles
délirants, les troubles
obsessionnels, les psychoses en général, la schizophrénie, les troubles
déficit de l'attention et de
l'hyperactivité (TDAH) chez les enfants hyperkinétiques (MBD) ainsi que pour
le traitement des
troubles liés à l'utilisation de substances psychotropes, notamment dans le
cas d'un abus d'une
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
19
substance et/ou de dépendance à une substance, y compris la dépendance
alcoolique et la
dépendance nicotinique et les troubles de sevrage. Les composés de formule (I)
selon l'invention
peuvent être utilisés comme médicaments pour le traitement de la migraine, du
stress, des
maladies d'origine psychosomatique, des crises d'attaques de panique, de
l'épilepsie, des troubles
du mouvement, en particulier des dyskinésies ou de la maladie de Parkinson,
des tremblements et
de la dystonie.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments
pour le cancer de la peau et la protection de la peau.
Les composés de formule (I) selon l'invention peuvent également être utilisés
comme
médicaments dans le traitement des troubles mnésiques, des troubles cognitifs,
en particulier dans
le traitement des troubles cognitifs liés aux démences séniles, à la maladie
d'Alzheimer, à la
schizophrénie et aux maladies neurodégénératives, ainsi que dans le traitement
des troubles de
l'attention ou de la vigilance.
De plus, les composés de formule (I) peuvent être utiles comme
neuroprotecteurs, dans le
traitement de l'ischémie, des traumatismes crâniens et le traitement des
maladies
neurodégénératives : incluant la chorée de Huntington, le syndrome de
Tourrette.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments
dans le traitement de la douleur : les douleurs neuropathiques, les douleurs
aiguës périphériques,
les douleurs chroniques et les douleurs d'origine inflammatoire.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments
dans le traitement des troubles de l'appétit, de l'appétence (pour les sucres,
carbohydrates,
drogues, alcools ou toute substance appétissante) et/ou des conduites
alimentaires, notamment
pour le traitement de la boulimie ainsi que pour le traitement du diabète de
type II ou diabète non
insulinodépendant et pour le traitement des dyslipidémies, du syndrome
métabolique. Ainsi les
composés de formule (I) selon l'invention sont utiles dans le traitement de
l'obésité et des risques
associés à l'obésité, notamment les risques cardio-vasculaires.
De plus, les composés de formule (I) selon l'invention peuvent être utilisés
en tant que
médicaments dans le traitement des troubles gastro-intestinaux, des troubles
diarrhéiques, des
ulcères, des vomissements, des troubles vésicaux et urinaires, des troubles
d'origine
endocrinienne, des troubles cardio-vasculaires, de l'hypotension, du choc
hémorragique, du choc
septique, de la cirrhose, de la fibrose hépatique, de la stéatohépatite et de
la stéatose hépatique,
quelle que soit l'étiologie de ces affections : en particulier virus, alcool,
médicament, produit
chimique, maladie auto-immune, obésité, diabète, maladie métabolique
congénitale,
(hémochromatose, déficit en alpha-l antitrypsine, maladie de Wilson, etc...),
de la cirrhose
chronique du foie, des fibroses, de la stéatohépatite non alcoolique (NASH),
de l'asthme, des
maladies pulmonaires chronique obstructive, du syndrome de Raynaud, du
glaucome, des troubles
de la fertilité, des phénomènes inflammatoires, des maladies inflammatoires,
des maladies du
système immunitaire, en particulier auto-immunes et neuroinflammatoires telles
que l'arthrite
rhumatoïde, l'arthrite réactionnelle, les maladies entraînant une
démyélinisation, la sclérose en
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
plaque, des maladies infectieuses et virales telles que les encéphalites, des
accidents vasculaires
cérébraux ainsi qu'en tant que médicaments pour la chimiothérapie
anticancéreuse, pour le
traitement du syndrome de Guillain-Barré, pour le traitement de l'ostéoporose
et l'apnée du
sommeil.
5 Selon un de ses aspects, la présente invention est relative à l'utilisation
d'un composé de
formule (I), de ses sels pharmaceutiquement acceptables et de leurs solvats ou
hydrates pour le
traitement des troubles et maladies indiqués ci-dessus.
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques comprenant, en tant que principe actif, un composé selon
l'invention. Ces
10 compositions pharmaceutiques contiennent une dose efficace d'au moins un
composé selon
l'invention, ou un sel pharmaceutiquement acceptable, dudit composé, ainsi
qu'au moins un
excipient pharmaceutiquement acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration
souhaité, parmi les excipients habituels qui sont connus de l'Homme du métier.
15 Dans les compositions pharmaceutiques de la présente invention pour
l'administration
orale, sublinguale, sous-cutanée, intramusculaire, intra-veineuse, topique,
locale, intratrachéale,
intranasale, transdermique ou rectale, le principe actif de formule (I) ci-
dessus, ou son sel, peut
être administré sous forme unitaire d'administration, en mélange avec des
excipients
pharmaceutiques classiques pour le traitement des troubles ou des maladies
cités ci-dessus.
20 Les formes unitaires d'administration appropriées comprennent les formes
par voie orale
telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les solutions ou
suspensions orales, les formes d'administration sublinguale, buccale,
intratrachéale, intraoculaire,
intranasale, par inhalation, les formes d'administration topique,
transdermique, sous-cutanée,
intramusculaire ou intraveineuse, les formes d'administration rectale et les
implants. Pour
l'application topique, on peut utiliser les composés selon l'invention dans
des crèmes, gels,
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention
sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscarmellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
CA 02734082 2011-02-11
WO 2010/018329 PCT/FR2009/001004
21
Stéarate de magnésium 3,0 mg
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique habituelle, le
dosage approprié à chaque patient est déterminé par le médecin selon le mode
d'administration, le
poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de
traitement des pathologies ci-dessus indiquées qui comprend l'administration,
à un patient, d'une
dose efficace d'un composé selon l'invention, ou d'un de ses sels
pharmaceutiquement
acceptables.