Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-1-
DERIVES INDOLES, LEUR PROCEDE DE PREPARATION ET LES COMPOSITIONS
PHARMACEUTIQUES QUI LES CONTIENNENT
La présente invention concerne de nouveaux dérivés indoles, leur procédé de
préparation et
les compositions pharmaceutiques qui les contiennent.
Les composés de la présente invention sont nouveaux et présentent des
caractéristiques
pharmacologiques très intéressantes concernant les récepteurs
mélatoninergiques.
De nombreuses études ont mis en évidence ces dix dernières années le rôle
capital de la
mélatonine (N-acétyl-5-méthoxytryptamine) dans de nombreux phénomènes physio-
pathologiques ainsi que dans le contrôle des rythmes circadiens. Toutefois,
elle possède un
temps de demi-vie assez faible dû à une rapide métabolisation. Il est donc
très intéressant
de pouvoir mettre à la disposition du clinicien des analogues de la
mélatonine,
métaboliquement plus stables et présentant un caractère agoniste ou
antagoniste, dont on
peut attendre un effet thérapeutique supérieur à celui de l'hormone elle-même.
Outre leur action bénéfique sur les troubles du rythme circadien (J.
Neurosurg. 1985, 63,
pp. 321-341) et du sommeil (Psychopharmacology, 1990, 100, pp. 222-226), les
ligands du
système mélatoninergique possèdent d'intéressantes propriétés pharmacologiques-
sur le
système nerveux central, notamment anxiolytiques et antipsychotiques
(Neuropharmacology of Pineal Secretions, 1990, 8 (3-4), pp. 264-272),
analgésiques
(Pharmacopsychiat., 1987, 20, pp. 222-223), ainsi que pour le traitement des
maladies de
Parkinson (J. Neurosurg. 1985, 63, pp. 321-341) et d'Alzheimer (Brain
Research, 1990,
528, pp. 170-174). De même, ces composés ont montré une activité sur certains
cancers
(Melatonin - Clinical Perspectives, Oxford University Press, 1988, pp. 164-
165), sur
l'ovulation (Science 1987, 227, pp. 714-720), sur le diabète (Clinical
Endocrinology, 1986,
24, pp. 359-364), et dans le traitement de l'obésité (International Journal of
Eating
Disorders, 1996, 20 (4), pp. 443-446).
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-2-
Ces différents effets s'exercent par l'intermédiaire de récepteurs spécifiques
de la
mélatonine. Des études de biologie moléculaire ont montré l'existence de
plusieurs sous-
types réceptoriels pouvant lier cette hormone (Trends Pharmacol. Sci., 1995,
16, p. 50).
Certains de ces récepteurs ont pu être localisés et caractérisés pour
différentes espèces,
dont les mammifères.
Les composés de la présente invention, outre leur nouveauté, montrent une très
forte
affinité pour les récepteurs de la mélatonine.
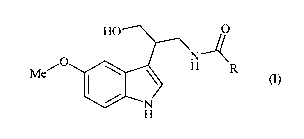
La présente invention concerne plus particulièrement les composés de formule
(I)
HO O
N--~
O
Met \ H R (I)
N
H
dans laquelle :
R représente un groupement alkyle (C1-C6) linéaire ou ramifié, un groupement
cycloalkyle
(C3-C8), ou un groupement cycloalkyle (C3-C8) alkyle (C1-C6) linéaire ou
ramifié,
leurs énantiomères et diastéréoisomères, ainsi que leurs sels d'addition à une
base
pharmaceutiquement acceptable.
Parmi les bases pharmaceutiquement acceptables, on peut citer à titre non
limitatif
l'hydroxyde de sodium, l'hydroxyde de potassium, la triéthylamine, la
tertbutylamine, etc...
R représente avantageusement un groupement alkyle (C1-C6) linéaire ou ramifié
et, plus
particulièrement, les groupements méthyle, éthyle et propyle.
De manière préférée, l'invention concerne les composés qui sont :
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-3-
= le N-[3-hydroxy-2-(5-méthoxy-1H-indol-3-yl)propyl]acétamide,
= le N-[(2R)-3-hydroxy-2-(5-méthoxy-lH-indol-3-yl)propyl]acétamide,
= et le N-[(2S)-3-hydroxy-2-(5-méthoxy-lH-indol-3-yl)propyl]acétamide.
Les sels d'addition à une base pharmaceutiquement acceptable des composés
préférés de
l'invention font partie intégrante de l'invention.
L'invention s'étend également au procédé de préparation du composé de formule
(I)
caractérisé en ce que l'on utilise comme produit de départ le composé de
formule (II) :
Met
(II)
H
que l'on soumet à l'action du 3-nitroacrylate d'éthyle pour conduire, par
addition de
Michael, au composé de formule (III) :
OEt
O
/O NO2 Me ~ \11 (III)
N
H
que l'on réduit par hydrogénation catalytique, en présence de l'anhydride
d'acyle de
formule RCO-O-COR dans laquelle R est tel que défini dans la formule (I), pour
conduire
au composé de formule (IV) :
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-4-
OEt
O O
N
O
Met H R (IV)
N
H
dans laquelle R est tel que défini précédemment,
que l'on soumet à une réduction en présence d'un hydrure, pour conduire au
composé de
formule (I),
qui peut être purifié selon une technique classique de séparation, que l'on
transforme, si on
le souhaite, en ses sels d'addition à une base pharmaceutiquement acceptable
et dont les
isomères optiques peuvent être séparés sur colonne chirale selon une technique
classique
de séparation.
L'étude pharmacologique des dérivés de l'invention a montré qu'ils étaient
atoxiques,
doués d'une forte affinité sélective pour les récepteurs de la mélatonine et
possédaient
d'importantes activités sur le système nerveux central et, en particulier, on
a relevé des
propriétés thérapeutiques sur les troubles du sommeil, des propriétés
antidépressives,
anxiolytiques, antipsychotiques, analgésiques ainsi que sur la
microcirculation, qui
permettent d'établir que les produits de l'invention sont utiles dans le
traitement du stress,
des troubles du sommeil, de l'anxiété, des dépressions saisonnières ou de la
dépression
majeure, des pathologies cardiovasculaires, des pathologies du système
digestif, des
insomnies et fatigues dues aux décalages horaires, de la schizophrénie; des
attaques de
panique, de la mélancolie, des troubles de l'appétit, de l'obésité, de
l'insomnie, des
troubles psychotiques, de l'épilepsie, du diabète, de la maladie de Parkinson,
de la
démence sénile, des divers désordres liés au vieillissement normal ou
pathologique, de la
migraine, des pertes de mémoire, de la maladie d'Alzheimer, ainsi que dans les
troubles de
la circulation cérébrale. Dans un autre domaine d'activité, il apparaît que
dans le
traitement, les produits de l'invention peuvent être utilisés dans les
dysfonctionnements
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-5-
sexuels, qu'ils possèdent des propriétés d'inhibiteurs de l'ovulation,
d'immunomodulateurs
et qu'ils sont susceptibles d'être utilisés dans le traitement des cancers.
Les composés seront utilisés de préférence dans les traitements de la
dépression majeure,
des dépressions saisonnières, des troubles du sommeil, des pathologies
cardiovasculaires,
des pathologies du système digestif, des insomnies et fatigues dues aux
décalages horaires,
des troubles de l'appétit et de l'obésité.
Par exemple, les composés seront utilisés dans le traitement de la dépression
majeure, des
dépressions saisonnières et des troubles du sommeil.
La présente invention a également pour objet les compositions pharmaceutiques
contenant
au moins un composé de formule (I) seul ou en combinaison avec un ou plusieurs
excipients pharmaceutiquement acceptables.
Parmi les compositions pharmaceutiques selon l'invention, on pourra citer,
plus
particulièrement celles qui conviennent pour l'administration orale,
parentérale, nasale, per
ou transcutanée, rectale, perlinguale, oculaire ou respiratoire et notamment
les comprimés
simples ou dragéifiés, les comprimés sublinguaux, les sachets, les paquets,
les gélules, les
glossettes, les tablettes, les suppositoires, les crèmes, les pommades, les
gels dermiques, et
les ampoules buvables ou injectables.
Les compositions pharmaceutiques citées précédemment illustrent l'invention
mais ne la
limitent en aucune façon.
La posologie varie selon le sexe, l'âge et le poids du patient, la voie
d'administration, la
nature de l'indication thérapeutique, ou des traitements éventuellement
associés et
s'échelonne entre 0,01 mg et 1 g par 24 heures en une ou plusieurs prises.
Les exemples suivants illustrent l'invention et ne la limitent en aucune
façon. Les produits
de départ utilisés sont des produits connus ou préparés selon des modes
opératoires connus.
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-6-
Les structures des composés, décrits dans les exemple, ont été déterminées
selon les
techniques spectroscopiques usuelles (infrarouge, RMN, spectrométrie de
masse...).
Les préparations suivantes conduisent à des intermédiaires de synthèse utiles
dans la
préparation des composés de l'invention.
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-7-
Préparation 1 : 2-Iodo-3-nitropropionate d'éthyle
50,8 g (200 mmol) de diiode et 70 ml (640 mmol) d'acrylate d'éthyle sont
dissous dans
600 ml d'éther diéthylique. Cette solution est agitée pendant 15 minutes puis
refroidie à
0 C. Extemporanément, 61 ml (800 mmol) d'acide nitrique (65 % technique) sont
ajoutés
goutte à goutte sur 45 g de cuivre en copeaux pour former du dioxyde d'azote
qui est mis à
buller dans la solution d'éther maintenue à 0 C. Le bullage doit s'effectuer
sur une période
de 45 minutes puis la solution est agitée 1 heure à 0 C et, enfin, 5 heures à
température
ambiante. La phase organique est lavée avec une solution saturée en
thiosulfate de sodium
puis séchée sur MgSO4 anhydre et évaporée. Après élimination des produits
secondaires
par évaporation sous pompe à vide poussé, le produit du titre est obtenu sous
la forme
d'une huile rouge.
Spectrométrie de masse : m/z = 274,0 (M+H)+ ; 296,0 (M+Na)+
Préparation 2 : 3-Nitroacrylate d'éthyle
Sous argon, 820 mg (3 mmol) du composé de la Préparation 1 sont solubilisés
dans 10 ml
d'éther diéthylique. A cette solution, sont ajoutés 370 mg (4,5 mmol)
d'acétate de sodium.
Le mélange est porté à reflux et agité pendant 3 heures. Après ajout de 10 ml
d'éther
diéthylique, la phase organique est lavée successivement avec 20 ml d'une
solution saturée
en thiosulfate de sodium, 20 ml d'une solution aqueuse en carbonate de sodium
et 20 ml
d'une solution aqueuse en chlorure de sodium. La phase organique récupérée est
séchée sur
MgSO4 anhydre puis évaporée. Le produit du titre est obtenu sans autre
purification sous la
forme d'une huile rouge.
Spectrométrie de masse : m/z = 146, 0 (M+H)+
Exemple 1 : N-[3-Hydroxy-2-(5-méthoxy-lH-indol-3-yl)propyllacétamide
Stade A : 2-(5-Méthoxy-1 H-indol-3 yl)-3-nitropropionate d'éthyle
Dans 150 ml d'acétonitrile, 1,70 g (4,5 mmol) de chlorure de cérium (III)
heptahydrate,
675 mg (4,5 mmol) de iodure de sodium et 7,5 g de silice sont agités pendant
une nuit à
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-8-
température ambiante. L'acétonitrile est ensuite évaporé sous pression
réduite. A ce
mélange, sont ajoutés 2,21 g (15 mmol) de 5-méthoxyindole et 2,18 g (15 mmol)
du
composé de la Préparation 2. Le milieu réactionnel est agité vigoureusement
pendant
18 heures à température ambiante. De l'éther diéthylique est ensuite ajouté et
le brut est
filtré sur célite. Après évaporation, le résidu est purifié par
chromatographie sur gel de
silice (acétate d'éthyle / éther de pétrole 3 / 7) pour donner le produit du
titre sous la forme
d'une huile jaune.
Spectrométrie de masse : m/z = 293, 0 (M+H) +
Stade B : 3 Acétamido-2-(5-méthoxy-1 H-indol-3 yl)propionate d'éthyle
Sous une pression de 60 psi d'hydrogène, 2,14 g (7,3 mmol) du composé obtenu
au
Stade A, 1,2 g (14,6 mmol) d'acétate de sodium et 400 mg de nickel de Raney
en
suspension dans 60 ml d'anhydride acétique sont agités pendant 15 heures à 50
C. Après
filtration sur célite, la solution est lentement piégée avec une solution
saturée de carbonate
de sodium puis avec du carbonate de sodium solide. Le milieu est extrait avec
de l'acétate
d'éthyle, lavé une fois avec une solution saturée de bicarbonate de sodium et
deux fois
avec dé l'eau. Après séchage sur MgSO4 anhydre et évaporation, le produit du
titre est
obtenu sous la forme d'un solide blanc.
Point de usion : 117 C
Stade C : N-[3-Hydroxy-2-(5-méthoxy-1 H-indol-3 yl)propyl]acétamide
Sous argon, 800 mg (2,6 mmol) du composé obtenu au Stade B sont dissous dans
10 ml de
tétrahydrofurane fraîchement distillé. A ce mélange à 0 C, sont ajoutés par
portions
200 mg (5,2 mmol) d'hydrure d'aluminium et de lithium. En fin d'addition, le
bain de
glace est retiré. Après 20 minutes d'agitation, le mélange est refroidi à 0 C
puis piégé avec
de l'eau. Le milieu est extrait au dichlorométhane, lavé deux fois avec une
solution saturée
de chlorure de sodium et une fois avec de l'eau. Après séchage sur MgS04
anhydre et
évaporation, le résidu est purifié par chromatographie sur gel de silice
(acétate d'éthyle /
méthanol 40 / 1) pour donner le composé du titre sous la forme d'une poudre
blanche.
Point defusion: 140 C
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-9-
Exemple 2 : N-[(2R)-3-hydroxy-2-(5-méthoxy-lH-indol-3-yl)propyl]acétamide
L'énantiomère R a été obtenu par séparation sur colonne préparative chirale.
Exemple 3 : N-[(2S)-3-hydroxy-2-(5-méthoxy-lH-indol-3-yl)propyl]acétamide
L'énantiomère S a été obtenu par séparation sur colonne préparative chirale.
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-10-
ETUDE PHARMACOLOGIQUE
EXEMPLE A : Etude de la toxicité aiguë
La toxicité aiguë a été appréciée après administration orale à des lots de 8
souris
(26 2 grammes). Les animaux ont été observés à intervalles réguliers au
cours de la
première journée et quotidiennement pendant les deux semaines suivant le
traitement. La
DL 50, entraînant la mort de 50 % des animaux, a été évaluée et a montré la
faible toxicité
des composés de l'invention.
EXEMPLE B : Test de la nage forcée
Les composés de l'invention sont testés dans un modèle comportemental, le test
de la nage
forcée.
L'appareil est constitué d'un cylindre en plexiglas rempli d'eau. Les animaux
sont testés
individuellement pendant une session de 6 minutes. Au début de chaque test,
l'animal est
placé au centre du cylindre. Le temps d'immobilisation est enregistré. Chaque
animal est
jugé immobile quand il cesse de se débattre, et reste à la surface de l'eau,
immobile, ne
faisant seulement que les mouvements lui permettant de maintenir la tête hors
de l'eau.
Après administration 40 minutes avant le début du test, les composés de
l'invention
diminuent de façon significative la durée d'immobilisation attestant de leur
activité
antidépressive.
EXEMPLE C : Etude de liaison aux récepteurs MT1 et MT2 de la mélatonine
Les expériences de liaison aux récepteurs MT, ou MT2 sont réalisées en
utilisant la
2-[125I]-iodomélatonine comme radioligand de référence. La radioactivité
retenue est
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-11-
déterminée à l'aide d'un compteur à scintillation liquide.
Des expériences de liaison compétitive sont ensuite réalisées en triple, avec
les différents
composés à tester. Une gamme de concentrations différentes est testée pour
chaque composé.
Les résultats permettent de déterminer les affinités de liaison des composés
testés (Ki).
Ainsi, les valeurs de K; trouvées pour les composés de l'invention attestent
d'une liaison
pour l'un ou l'autre des sites de liaisons mélatoninergiques, ces valeurs
étant <_ 10 M. A
titre d'exemple, le composé obtenu dans l'Exemple 1 présente un K;(MT1) de
49.1 nM, et
un K;(MT2) de 5.7 nM.
EXEMPLE D : Action des composés de l'invention sur les rythmes circadiens
d'activité
locomotrice du rat
L'implication de la mélatonine dans l'entraînement, par l'alternance
jour/nuit, de la plupart
des rythmes circadiens physiologiques, biochimiques et comportementaux a
permis
d'établir un modèle pharmacologique pour la recherche de ligands
mélatoninergiques.
Les effets des molécules sont testés sur de nombreux paramètres et, en
particulier, sur les
rythmes circadiens d'activité locomotrice qui représentent un marqueur fiable
de l'activité
de l'horloge circadienne endogène.
Dans cette étude, on évalue les effets de telles molécules sur un modèle
expérimental
particulier, à savoir le rat placé en isolement temporel (obscurité
permanente).
Protocole expérimental
Des rats mâles âgés de un mois sont soumis dès leur arrivée au laboratoire à
un cycle
lumineux de 12 heures de lumière par 24 heures (LD 12 12).
Après 2 à 3 semaines d'adaptation, ils sont placés dans des cages équipées
d'une roue
reliée à un système d'enregistrement afin de détecter les phases d'activité
locomotrice et de
suivre ainsi les rythmes nycthéméraux (LD) ou circadiens (DD).
Dès que les rythmes enregistrés témoignent d'un entraînement stable par le
cycle lumineux
LD 12 : 12, les rats sont mis en obscurité permanente (DD).
Deux à trois semaines plus tard, lorsque le libre-cours (rythme reflétant
celui de l'horloge
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
-12-
endogène) est clairement établi, les rats reçoivent une administration
quotidienne de la
molécule à tester.
Les observations sont réalisées grâce à la visualisation des rythmes
d'activité :
- entraînement des rythmes d'activité par le rythme lumineux,
- disparition de l'entraînement des rythmes en obscurité permanente,
- entraînement par l'administration quotidienne de la molécule ; effet
transitoire ou durable.
Un logiciel permet :
- de mesurer la durée et l'intensité de l'activité, la période du rythme chez
les animaux en
libre cours et pendant le traitement,
- de mettre éventuellement en évidence par analyse spectrale l'existence de
composants
circadiens et non circadiens (ultradiens par exemple).
Résultats
Il apparaît clairement que les composés de l'invention permettent d'agir de
façon puissante
sur le rythme circadien via le système mélatoninergique.
EXEMPLE E : Test des cages claires/obscures
Les composés de l'invention sont testés dans un modèle comportemental, le test
des cages
claires/obscures, qui permet de révéler l'activité anxiolytique des molécules.
L'appareil est composé de deux boîtes en polyvinyle couvertes de Plexiglas.
L'une de ces
boîtes est obscure. Une lampe est placée au-dessus de l'autre boîte donnant
une intensité
lumineuse au centre de celle-ci d'approximativement 4000 lux. Un tunnel opaque
en
plastique sépare la boîte claire de la boîte sombre. Les animaux sont testés
individuellement pendant une session de 5 minutes. Le plancher de chaque boîte
est
nettoyé entre chaque session. Au début de chaque test, la souris est placée
dans le tunnel,
face à la boîte sombre. Le temps passé par la souris dans la boîte éclairée et
le nombre de
transitions à travers le tunnel sont enregistrés après la première entrée dans
la boîte
sombre.
CA 02744178 2011-05-19
WO 2010/061074 PCT/FR2009/001338
- 13-
Après administration des composés 30 minutes avant le début du test, les
composés de
l'invention augmentent de façon significative le temps passé dans la cage
éclairée ainsi que
le nombre des transitions, ce qui montre l'activité anxiolytique des dérivés
de l'invention.
EXEMPLE F : Composition pharmaceutique
Formule de préparation pour 1000 comprimés dosés à 5 mg de N-[3-hydroxy-2-
(5-méthoxy-lH-indol-3-yl)propyl]acétamide (Exemple 1)
.....................................................5 g
Amidon de blé
...............................................................................
................................... 20 g
Amidon de maïs
...............................................................................
................................. 20 g
Lactose
...............................................................................
............................................... 30g
Stéarate de magnésium
...............................................................................
........................ 2 g
Silice
...............................................................................
.................................................... 1 g
Hydroxypropylcellulose
......................................................................:........
...................... 2 g