Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
1
NOUVEAUX DERIVES D'INDOLIZINE, LEUR PRÉPARATION ET LEUR
APPLICATION EN THERAPEUTIQUE
La présente invention a pour objet de nouveaux dérivés d'indolizine, leur
procédé de
préparation et leur application en thérapeutique.
La fibrillation auriculaire (FA) est l'arythmie la plus commune et est
associée à une
forte morbidité incluant l'insuffisance cardiaque et les attaques cardiaques.
Elle est
souvent rencontrée chez des patients présentant une pathologie cardiaque telle
que
l'hypertension, ou une maladie des coronaires ou des valves cardiaques. Les
conséquences les plus significatives de la FA sont l'insuffisance cardiaque,
avec un
risque d'attaque cardiaque multiplié par 5 et un risque de mortalité multiplié
par 2
(Duray GZ, Ehrlich JR, Hohnloser SH. Dronedarone: a novel antiarrhythmic agent
for
the treatment of atrial fibrillation. Curr.Opin.Cardiol. 2010;25:53-58). En
raison du
vieillissement de la population, le nombre d'adultes présentant des FA devrait
augmenter au cours des prochaines décades.
La FA est caractérisée par la coexistence de nombreuses ondes d'activation
dans le
myocarde auriculaire. Le mécanisme de leur initiation et de leur persistance a
été
beaucoup discuté au cours des dernières années. Parce que toute forme de
tachyarythmie induit un remodeling fréquence dépendant, la coexistence de
multiples
foyers de réentrées pourrait représenter le mécanisme commun responsable de la
persistance des FA liées à des causes pathologiques diverses. D'après la
théorie des
leading circle , le maintien des réentrées dépend de la longueur d'onde du
circuit
qui est le résultat du produit de la vitesse de conduction par la période
réfractaire
effective (PRE) à l'intérieur du circuit. Plus grande est la longueur d'onde,
moins le
nombre de circuits de FA possibles dans l'oreillette est élevé et plus il est
probable que
les circuits de réentrée s'interrompent simultanément. Ainsi, tout médicament
qui
prolonge la PRE atriale devrait avoir des propriétés antiarythmiques (Ehrlich
JR, Nattel
S. Novel approaches for pharmacological management of atrial fibrillation.
Drugs
2009;69:757-774).
Dans FR 2341578 et EP471609, il est décrit des dérivés d'indolizine qui
possèdent de
remarquables propriétés pharmacologiques notamment des propriétés anti-
arythmiques puisque ces dérivés se sont révélés capables de supprimer ou de
prévenir
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
2
les troubles du rythme auriculaire. La plupart des composés décrits ont des
propriétés
électrophysiologiques des classes 1, 2, 3 et 4 de la classification de Vaughan-
Williams
qui confèrent en plus de leurs propriétés antiarythmiques, des propriétés
bradycardisantes, anti-hypertensives et anti-adrénergiques a et 13 non
compétitives.
Ces propriétés rendent les composés en question très utiles dans le traitement
de
certains syndromes pathologiques du système cardio-vasculaire en particulier
dans le
traitement de l'angine de poitrine, de l'hypertension, de l'arythmie
ventriculaire ou
supraventriculaire. De même, ces composés sont utilisés dans le traitement de
l'insuffisance cardiaque, de l'infarctus du myocarde compliqué ou non
d'insuffisance
cardiaque ou pour la prévention de la mortalité post-infarctus.
Néanmoins, ces composés présentent l'inconvénient de n'être pas ou très peu
solubles
dans l'eau.
L'amiodarone, qui est un antiarythmique auriculaire et ventriculaire actif par
voies orale
et intraveineuse, est une molécule insoluble dans l'eau ; la solution
injectable contient
donc des solvants comme le polysorbate 80 et l'alcool benzylique. Ces solvants
induisent chez le patient des effets hypotenseur et inotrope négatif. La
solution
injectable provoque aussi des intolérances veineuses locales que l'on évite en
préconisant une injection centrale en milieu hospitalier spécialisé.
La dronedarone, dérivé benzofurane, ne contenant pas d'iode dans sa structure
chimique contrairement à l'amiodarone, est également un antiarythmique
auriculaire et
ventriculaire actif par voie orale et intraveineuse.
On a maintenant découvert, dans le cadre de l'invention, des antiarythmiques
actifs par
voie orale de type indolizine capable de bloquer plusieurs canaux ioniques
comme la
dronédarone mais sans ses limitations et inconvénients. Le plus grand
désavantage de
la dronédarone est sa contre-indication chez les patients présentant une
insuffisance
cardiaque. Il est probable que ces effets soient liés au blocage des canaux
sodiques
(Lalevee N, Nargeot J, Barrere-Lemaire S, Gautier P, Richard S. Effects of
amiodarone
and Dronedarone on voltage-dependent sodium current in human cardiomyocytes. J
Cardiovasc.Electrophysiol. 2003;14:885-890) et calciques (Gautier P,
Guillemare E,
Marion A, Bertrand JP, Tourneur Y, Nisato D Electrophysiologic
characterization of
Dronedarone in guinea pig ventricular cells. J.Cardiovasc.Pharmacol.
2003;41:191-
202) entrainant une inotropie négative chez l'animal et probablement aussi
chez les
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
3
atients. C'est pourquoi, les nouveaux composés devront être dépourvus d'effet
inotrope
régatif chez l'animal (le porc par exemple). De plus, comparés à l'amiodarone
ou à la
Ironédarone, nos composés offrent une meilleure stabilité métabolique et une
solubilité dans
eau suffisante pour une forme injectable.
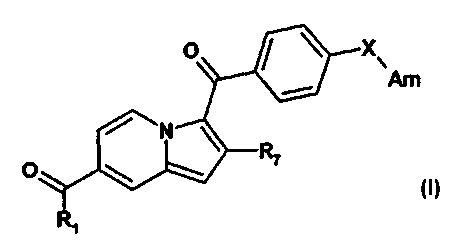
.a présente invention a pour objet des composés répondant à la formule (I) :
R1 X
Am
N
R7
lans laquelle
21 représente :
- soit
0
R3
=
- soit
= Ri-0 R3
=
- soit
R-0
4 7k3c__NR,
_ soit
Ro
=
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
4
- soit
0
R
N
N
- soit
REÇN¨
r
- soit
Me
/--(.
Me-0 0-
- soit
H
0.. h....>
---
0-
- soit
--N
N.--
I )¨
N 0¨
Me/ N
R2 représente un atome d'hydrogène, un groupe (C1-06) alkyle, un groupe
benzyle,
un groupe 0H2-0F3;
R3 représente un atome d'hydrogène, un groupe (C1-06) alkyle, un groupe
benzyle;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
R4 représente un atome d'hydrogène, un groupe (C1-04) alkyle;
R5 représente un atome d'hydrogène, un groupe (C1-05) alkyle;
R6 représente un groupe nitrile ou un groupe hétéroaryle comprenant de 1 à 4
hétéroatomes choisis parmi un atome d'azote et un atome d'oxygène, ce groupe
hétéroaryle étant éventuellement substitué par un groupe (C1-06) alkyle ;
R7 représente un atome d'hydrogène, un groupe (C1-06) alkyle linéaire, ramifié
ou
cyclique ;
R8 représente un groupe hydroxyle, un groupe cyano ;
X représente une liaison ou un atome d'oxygène ;
Am représente:
- soit
)n
"bR16
- soit
-(CH2)t-CR19R20NR17-R18
R16 représente un atome d'hydrogène, un groupe (C1-06) alkyle ;
R17 représente un atome d'hydrogène, un groupe (C1-06) alkyle ;
R18 représente un groupe (C1-06) alkyle ramifié ou cyclique ;
R19 et R20 représentent un atome d'hydrogène, un groupe (C1-06) alkyle, ou
forment
un groupe (03-06) spiroalkyle ;
m représente un nombre entier égal à 0 ou 1 ;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
6
n représente un nombre entier égal à 1 ou 2;
r représente un nombre entier égal à 1 ou 2 ;
s représente un nombre entier égal à 1 ou 2;
t représente un nombre entier compris entre 2 et 4.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbone
asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou de
diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges, y
compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou salifiés par
des
acides ou des bases, notamment des acides ou des bases pharmaceutiquement
acceptables. De tels sels d'addition font partie de l'invention.
Ces sels sont avantageusement préparés avec des acides pharmaceutiquement
acceptables, mais les sels d'autres acides utiles, par exemple, pour la
purification ou
l'isolement des composés de formule (I), font également partie de l'invention.
Dans le cadre de la présente invention, et sauf mention différente dans le
texte, on
entend par:
- un atome d'halogène : un fluor, un chlore, un brome ou un iode ;
- un groupe alkyle : un groupe aliphatique saturé linéaire, ramifié ou
cyclique.
A titre d'exemples, on peut citer les groupes méthyle, éthyle, propyle,
isopropyle,
butyle, isobutyle, tertbutyle, pentyle, etc;
- un groupe spiroalkyle : un bicycle dont les cycles sont connectés par un
unique atome. Les cycles peuvent être de longueur ou de nature identiques ou
différentes;
- un groupe halogenoalkyle : un groupe alkyle dont un ou plusieurs atomes
d'hydrogène ont été substitués par un atome d'halogène;
- un groupe aryle : un groupe aromatique cyclique comprenant entre 6 et 10
atomes de carbone. A titre d'exemples de groupes aryles, on peut citer un
phényle,
benzyle ou naphthyle;
- un groupe hétéroaryle : un groupe aromatique cyclique comprenant 2, 3, 4
ou 5 atomes de carbone et comprenant de 1 à 4 hétéroatomes choisis parmi un
atome
d'azote et un atome d'oxygène, indépendamment l'un de l'autre, de manière à
être
identiques ou différents, lorsqu'ils sont au nombre de 2 ou indépendamment les
uns
des autres, à être identiques ou différents, lorsqu'ils sont au nombre de 3.
On peut
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
7
citer les groupes pyridyle, furanyle, pyrrolyle ;
- un groupe hydroxyle : un groupement ¨OH.
Parmi les composés de formule (I) objets de l'invention, on peut notamment
citer les
composés suivants :
- composé n 2 : (S)-1-{2-Buty1-344-(3-dibutylamino-propy1)-
benzoy1Findolizine-7-
carbonyl}-pyrrolidine-2-carboxylic acid methyl ester ;
- composé n 3 : (R)-1-{2-Buty1-344-(3-dibutylamino-propy1)-
benzoy1Findolizine-7-
carbonyl}-pyrrolidine-2-carboxylic acid methyl ester ;
- composé n 4 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid ethyl-(2-methoxy-ethyl)-amide ;
- composé n 5 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-indolizine-7-
carbony1}-
ethyl-amino)-acetic acid methyl ester ;
- composé n 6 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-indolizine-7-
carbony1}-
ethyl-amino)-acetic acid ;
- composé n 7 : 3-({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-
7-
carbonyl}-ethyl-amino)-propionic acid ;
- composé n 8: ({344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester ;
- composé n 9 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide;
- composé n 10 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid ethyl-(3-methyl41,2,4]oxadiazol-5-ylmethyl)-amide ;
- composé n 11: 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid ethyl-(1H-tetrazol-5-ylmethyl)-amide ;
- composé n 12 : {[2-Buty1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carbonyl]-isopropyl
-amino}-acetic acid methyl ester ;
- composé n 13 : 4-{2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-
7-
carbonyl}-piperazin-2-one ;
- composé n 14: ({344-(4-Cyclopentylamino-buty1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester;
- composé n 15: [(3-{443-(1-Amino-cyclopenty1)-propylFbenzoy1}-2-ethyl-
indolizine-7-
carbony1)-isopropyl-aminoFacetic acid methyl ester ;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
8
- composé n 16: [(2-Ethy1-3-{443-(1-methylamino-cyclopenty1)-
propylFbenzoy1}-
indolizine-7-carbony1)-isopropyl-aminoFacetic acid methyl ester;
- composé n 17 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide;
- composé n 18 : 344-(3-tert-Butylamino-3-methyl-buty1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 19 : ({344-(3-Cyclopentylamino-3-methyl-buty1)-benzoy1]-2-ethyl-
indolizine-7-carbony1}-isopropyl-amino)-acetic acid methyl ester;
- composé n 20 : 2-Ethy1-344-((S)-3-ethylamino-4-methyl-penty1)-
benzoy1Findolizine-7
-carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 21 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid benzyl-(2-methoxy-ethyl)-amide ;
- composé n 22 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid isopropyl-(2-methoxy-ethyl)-amide ;
- composé n 23 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid ethyl-(2-isopropoxy-ethyl)-amide;
- composé n 24 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid (2-ethoxy-ethyl)-isopropyl-amide;
- composé n 25 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid (2-methoxy-ethyl)-(2,2,2-trifluoro-ethyl)-amide ;
- composé n 26: ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-ethyl-amino)-acetic acid ethyl ester ;
- composé n 27: ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-ethyl-amino)-acetic acid isopropyl ester ;
- composé n 28 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-isopropyl-amino)-acetic acid methyl ester ;
- composé n 29 : ({344-(3-Dibutylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-carbonyl}
-isopropyl-amino)-acetic acid methyl ester ;
- composé n 30: ({344-(3-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-7-
carbony1}-
isopropyl-amino)-acetic acid methyl ester ;
- composé n 31 : ({344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester ;
- composé n 32 : ({2-Ethy1-344-(3-isopropylamino-propy1)-benzoy1Findolizine-
7-
carbonyl}-isopropyl-amino)-acetic acid methyl ester ;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
9
- composé n 33 : ({344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-ethyl-amino)-acetic acid ethyl ester ;
- composé n 34: ({344-(3-Cyclopentylamino-propy1)-benzoy1]-2-isopropyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester;
- composé n 35: ({344-(3-Cyclohexylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester ;
- composé n 36: [(3-{443-(2,2-Dimethyl-propylamino)-propyq-benzoy1}-2-ethyl-
indolizine-7-carbony1)-isopropyl-aminoFacetic acid methyl ester ;
- composé n 37 : 344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid (2-ethoxy-ethyl)-ethyl-amide ;
- composé n 38 : 4-{344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-piperazin-2-one;
- composé n 39 : 2-Ethy1-3-{443-(1-methyl-cyclopentylamino)-propylFbenzoy1}-
indolizine-7-carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 40 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(2-ethy1-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 41 : 344-(3-tert-Butylamino-propy1)-benzoy1Findolizine-7-
carboxylic acid
ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 42 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-cyclobutyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 43 : 2-Ethy1-344-(-3-ethylamino-4,4-dimethyl-penty1)-benzoyq-
indolizine-
7-carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 44: 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(1-methy1-1H-pyrazol-3-ylmethyl)-amide ;
- composé n 45 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(1-methy1-1H-pyrazol-4-ylmethyl)-amide ;
- composé n 46 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(5-methyl-isoxazol-3-ylmethyl)-amide ;
- composé n 47: (R)-1-{344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-pyrrolidine-3-carbonitrile;
- composé n 48 : {344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizin-
7-y1}4(S)-
3-hydroxy-pyrrolidin-1-y1)-methanone ;
- composé n 49 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid 2-methyl-2H-tetrazol-5-ylmethyl ester;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
- composé n 50: (S)-1-{344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-2-methyl-pyrrolidine-2-carboxylic acid methyl ester ;
- composé n 51 : 3-[4-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid (R)-2-methoxy-1-methyl-ethyl ester;
- composé n 52 : 3-[4-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid (R)-5-oxo-pyrrolidin-3-y1 ester ;
- composé n 53: 1-{344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}41,4]diazepan-5-one;
- composé n 54: [(3-{443-(tert-Butyl-methyl-amino)-propylFbenzoy1}-2-ethyl-
indolizine-7-carbony1)-isopropyl-aminoFacetic acid methyl ester ;
- composé n 55: [(2-Ethy1-3-{443-(ethyl-isopropyl-amino)-propylFbenzoy1}-
indolizine-
7-carbony1)-isopropyl-amino]-acetic acid methyl ester ;
- composé n 56: ({344-(3-Dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}-
isopropyl-amino)-acetic acid methyl ester ;
- composé n 57: ({344-(3-Dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}-
isopropyl-amino)-acetic acid ;
- composé n 58 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}-isopropyl-amino)-acetic acid isopropyl ester ;
- composé n 59 : 2-Buty1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carboxylic acid
diethylamide;
- composé n 60: ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-isopropyl-amino)-acetic acid ethyl ester ;
- composé n 61 : ({344-(3-Dipropylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carbony1}-isopropyl-amino)-acetic acid methyl ester;
- composé n 62 : [(2-Buty1-3-{443-(butyl-ethyl-amino)-propylFbenzoy1}-
indolizine-7-
carbony1)-isopropyl-aminoFacetic acid methyl ester;
- composé n 63 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-isobutyl-amino)-acetic acid methyl ester ;
- composé n 64: ({2-Buty1-344-(1-methyl-piperidin-4-y1)-benzoy1Findolizine-
7-
carbony1}-isopropyl-amino)-acetic acid;
- composé n 65 : {[2-Ethy1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carbonyl]-isopropyl
-amino}-acetic acid methyl ester;
- composé n 66 : 2-Buty1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carboxylic acid
diethylamide ;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
11
- composé n 67: ({2-Buty1-344-(piperidin-4-yloxy)-benzoy1Findolizine-7-
carbony1}-
isopropyl-amino)-acetic acid methyl ester ;
- composé n 68 : ({2-Buty1-3444(S)-piperidin-3-yloxy)-benzoy1Findolizine-7-
carbonyl}-
isopropyl-amino)-acetic acid methyl ester ;
- composé n 69 : (S)-2-({2-Buty1-344-(3-dibutylamino-propy1)-
benzoy1Findolizine-7-
carbonyl}-ethyl-amino)-propionic acid methyl ester ;
- composé n 70 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid benzyl-ethyl-amide ;
- composé n 71 : 2-Buty1-344-(3-butylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid ethyl-(2-methoxy-ethyl)-amide ;
- composé n 72 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carboxylic
acid (2-isopropoxy-ethyl)-isopropyl-amide ;
- composé n 73 : [(2-Buty1-3-{4434(3R,5S)-3,5-dimethyl-piperidin-1-y1)-
propyl]-
benzoy1}-indolizine-7-carbony1)-isopropyl-aminoFacetic acid methyl ester ;
- composé n 74: (Benzyl-{2-buty1-344-(3-dibutylamino-propy1)-
benzoy1Findolizine-7-
carbonyl}-amino)-acetic acid methyl ester ;
- composé n 75: ({2-Buty1-344-(3-diethylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-isopropyl-amino)-acetic acid ;
- composé n 76: ({344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid;
- composé n 77 : 344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 78 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-methyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 79 : [(2-Ethy1-3-{443-(1-isopropylamino-cyclopenty1)-
propylFbenzoy1}-
indolizine-7-carbony1)-isopropyl-aminoFacetic acid methyl ester ;
- composé n 80 : 2-Buty1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carboxylic acid ethyl-
(3-methyl-[1,2,4]oxadiazol-5-ylmethyl)-amide ;
- composé n 81 : ({2-Buty1-3444(R)-piperidin-3-yloxy)-benzoy1Findolizine-7-
carbonyl}-
isopropyl-amino)-acetic acid methyl ester ;
sous forme de base ou de sel d'addition à un acide.
Parmi les composés de formule (1) objets de l'invention, un groupe de composés
est
constitué par les composés suivants:
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
12
- composé n 3 : (R)-1-{2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-
indolizine-7-
carbonyl}-pyrrolidine-2-carboxylic acid methyl ester ;
- composé n 4 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carboxylic
acid ethyl-(2-methoxy-ethyl)-amide ;
- composé n 5 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-indolizine-7-
carbony1}-
ethyl-amino)-acetic acid methyl ester ;
- composé n 8 : ({344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester ;
- composé n 9 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carboxylic
acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide;
- composé n 10 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carboxylic
acid ethyl-(3-methyl41,2,4]oxadiazol-5-ylmethyl)-amide ;
- composé n 13 : 4-{2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-
7-
carbonyl}-piperazin-2-one ;
- composé n 16: [(2-Ethy1-3-{443-(1-methylamino-cyclopenty1)-
propylFbenzoy1}-
indolizine-7-carbony1)-isopropyl-aminoFacetic acid methyl ester ;
- composé n 17 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide;
- composé n 18 : 344-(3-tert-Butylamino-3-methyl-buty1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 22 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carboxylic
acid isopropyl-(2-methoxy-ethyl)-amide ;
- composé n 23 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carboxylic
acid ethyl-(2-isopropoxy-ethyl)-amide;
- composé n 24 : 2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carboxylic
acid (2-ethoxy-ethyl)-isopropyl-amide ;
- composé n 28 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoyq-indolizine-7-
carbonyl}
-isopropyl-amino)-acetic acid methyl ester ;
- composé n 29 : ({344-(3-Dibutylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-carbonyl}
-isopropyl-amino)-acetic acid methyl ester ;
- composé n 30: ({344-(3-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-7-
carbony1}-
isopropyl-amino)-acetic acid methyl ester ;
- composé n 31 : ({344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester ;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
13
- composé n 35: ({344-(3-Cyclohexylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}-isopropyl-amino)-acetic acid methyl ester ;
- composé n 40 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-
carboxylic acid ethyl-(2-ethy1-2H-tetrazol-5-ylmethyl)-amide;
- composé n 42 : 344-(3-tert-Butylamino-propy1)-benzoy1]-2-cyclobutyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 43 : 2-Ethy1-344-(-3-ethylamino-4,4-dimethyl-penty1)-
benzoy1Findolizine-
7-carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 53: 1-{344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carbony1}41,41diazepan-5-one ;
- composé n 55: [(2-Ethy1-3-{443-(ethyl-isopropyl-amino)-propylFbenzoy1}-
indolizine-7
-carbony1)-isopropyl-aminoFacetic acid methyl ester ;
- composé n 58 : ({344-(3-Dibutylamino-propy1)-benzoy1]-2-ethyl-indolizine-
7-carbonyl}
-ethyl-amino)-acetic acid isopropyl ester ;
- composé n 62 : [(2-Buty1-3-{443-(butyl-ethyl-amino)-propylFbenzoy1}-
indolizine-7-
carbony1)-isopropyl-aminoFacetic acid methyl ester;
- composé n 63 : ({2-Buty1-344-(3-dibutylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-isobutyl-amino)-acetic acid methyl ester ;
- composé n 64: ({2-Buty1-344-(1-methyl-piperidin-4-y1)-benzoy1Findolizine-
7-
carbony1}-isopropyl-amino)-acetic acid;
- composé n 65 : {p-Ethy1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carbonylpsopropyl
-amino}-acetic acid methyl ester ;
- composé n 69 : (S)-2-({2-Buty1-344-(3-dibutylamino-propy1)-
benzoy1Findolizine-7-
carbonyl}-ethyl-amino)-propionic acid methyl ester ;
- composé n 75: ({2-Buty1-344-(3-diethylamino-propy1)-benzoy1Findolizine-7-
carbonyl}
-isopropyl-amino)-acetic acid ;
- composé n 77 : 344-(3-Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
indolizine-7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide ;
- composé n 78 344-(3-tert-Butylamino-propy1)-benzoy1]-2-methyl-indolizine-
7-
carboxylic acid ethyl-(2-methyl-2H-tetrazol-5-ylmethyl)-amide;
sous forme de base ou de sel d'addition à un acide.
Dans ce qui suit, on entend par groupe protecteur (Pg) un groupe qui permet,
d'une part, de protéger une fonction réactive telle qu'un hydroxy ou une amine
pendant
une synthèse et, d'autre part, de régénérer la fonction réactive intacte en
fin de
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
14
synthèse. Des exemples de groupes protecteurs ainsi que des méthodes de
protection
et de déprotection sont données dans Protective Groups in Organic Synthesis
,
Green et al., 3rd Edition (John Wiley & Sons, Inc., New York).
On entend par groupe partant (Lg), dans ce qui suit, un groupe pouvant être
facilement clivé d'une molécule par rupture d'une liaison hétérolytique, avec
départ
d'une paire électronique. Ce groupe peut ainsi être remplacé facilement par un
autre
groupe lors d'une réaction de substitution, par exemple. De tels groupes
partants sont,
par exemple, les halogènes ou un groupe hydroxy activé tel qu'un mésyle,
tosyle,
triflate, acétyle, etc. Des exemples de groupes partants ainsi que des
références pour
leur préparation sont donnés dans Advances in Organic Chemistry , J. March,
3rd
Edition, Wiley lnterscience, p. 310-316.
Conformément à l'invention, on peut préparer les composés de formule (I) avec
R1, R7, X et Am qui ont la même signification que précédemment selon le
procédé qui
suit, illustré dans les schémas 1, 2, 3, 4 et 5.
Dans les schémas 1, 2, 3, 4 et 5, les composés de départ et les réactifs,
quand
leur mode de préparation n'est pas décrit, sont disponibles dans le commerce
ou
décrits dans la littérature, ou bien peuvent être préparés selon des méthodes
qui y sont
décrites ou qui sont connues de l'Homme du métier.
Le noyau indolizine (VIII, schéma1) est préparé selon le procédé de
Chichibabin via la quaternisation de la pyridine (XI) (avec R = un groupe
alkyle tel que
isopropyle) avec un dérivé a-halocétone (X) tel que le 1-bromohexane-2-one (Y
= Br,
étape ii), dans un solvant tel que la butan-2-one portée à reflux, suivie
d'une réaction
de cyclisation (étape iii) en présence d'une base telle que le carbonate de
sodium dans
un solvant protique tel que l'isopropanol porté à reflux.
Une réaction d'acylation de type Friedel-Crafts de la position 3 avec un
chlorure
d'acide (VII) où Y représente un atome d'halogène (étape iv), conduit, après
chauffage,
au dérivé cétone (VI). Alternativement, à l'étape (iv') l'acylation peut être
effectuée
avec un chlorure d'acide (VII') avec X-Am porteur d'une fonction amine masquée
dans
un groupe amide ou formiate, démasquée en fin de synthèse pour conduire au
composé (I), ou à nouveau engagée dans un deuxième groupement protecteur
compatible avec les conditions de saponification à l'étape (vi) et libérée à
nouveau
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
après l'étape finale (vii).
Dans une étape (y), la condensation de l'amine Am-H (V) sur le dérivé
halogéné (VI) où Y représente un atome d'halogène, en présence d'une base
telle que
le carbonate de potassium et d'une quantité catalytique d'iodure de potassium
(KI)
dans un solvant tel que de l'acétonitrile porté à reflux, conduit à l'amine
(IV) qui
correspond à un composé de formule (I) dans lequel R1 représente OR quand R =
R12
= un groupe (C1-C6)alkyle tel qu'un groupe isopropyle.
La saponification (étape vi) de l'ester (IV) avec de la soude dans un solvant
tel que le
dioxanne suivie de l'activation (étape vii) de l'acide carboxylique (III)
correspondant
(qui correspond à un composé de formule (I) dans lequel R1 représente 0-R12
avec R12
=H) avec un agent de couplage tel que le tétrafluoroborate de 0-benzotriazolyl-
N,N,N',N'-tétraméthyluronium (TBTU), en présence du dérivé amine ou alcool R1-
H (II)
et d'une base telle que la N,N-diisopropyléthylamine (DIEA) dans un solvant
aprotique
tel que le dichlorométhane (DOM), conduit aux composés de formule générale (I)
conformément à la présente invention.
Alternativement comme décrit dans le schéma 2, la chaîne X-Am peut être
introduite à
partir d'une réaction de Sonogashira entre un dérivé alcyne (V) et un dérivé
halogéné
(VI), préparé comme décrit dans le schéma 1, où Z représente un halogène de
préférence un atome d'iode. Ainsi, à l'étape (ii) le couplage est réalisée en
présence
d'une base organique telle que la DIEA et d'une quantité catalytique de cuivre
(I) tel
que Cul ou CuBr, et de palladium tel Pd012(PPh3) dans un solvant polaire tel
que de
l'acétonitrile chauffé à 50 C. A l'étape (iii) la triple liaison du dérivé
alcyne (IV) est
ensuite réduite totalement sous atmosphère d'hydrogène ou avec un agent de
transfert
d'hydrogène tel que le formiate d'ammonium en présence d'une quantité
catalytique de
palladium sur charbon (Pd-C) dans un solvant protique tel que l'éthanol ou le
méthanol.
Enfin, comme décrit dans le schéma 1, l'ester (III) est soumis à une séquence
saponification-couplage peptidique (étapes iv et y) pour conduire au composé
I. Les
différents substituants, quand leur définition n'est pas précisée, sont tels
que définis en
formule générale (I).
Alternativement comme décrit dans le schéma 3, le couplage de Sonogashira peut
être
réalisé avec un dérivé alcyne fonctionnalisé avec un précurseur d'une fonction
amine
tel qu'une fonction acide carboxylique masquée dans un groupement ester
benzylique
hydrogènolysable pour garantir une déprotection orthogonale efficace en
présence de
la deuxième fonction ester avec R tel que décrit précédemment. Ainsi, à
l'étape (ii) la
triple liaison et l'ester benzylique (R13=0Bn) du produit de Sonogashira sont
réduits
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
16
concomitamment sous atmosphère d'hydrogène ou avec un agent de transfert
d'hydrogène tel que le formiate d'ammonium en présence d'une quantité
catalytique de
palladium sur charbon (Pd-C) dans un solvant protique tel que l'éthanol ou le
méthanol.
La fonction acide carboxylique (VII) ainsi libérée est transformée à l'étape
(iii) selon un
réarrangement de Curtius en une fonction carbamate de tert-butyle (V) en
présence
d'azoture de diphénylphosphoryle (DPPA) dans de l'alcool tert-butylique et
d'une
quantité catalytique de cuivre (I) tel que CuCl. Le dérivé (V) aux étapes (iv)
et (y) est
soumis comme décrit dans le schéma 1 à une séquence saponification-couplage
peptidique pour conduire au composé (III).
Enfin, la fonction carbamate de tert-butyle (III) peut être soit acidolysée
avec de l'acide
trifluoroacétique ou du chlorure d'hydrogène à l'étape (vii) pour mener au
composé (I)
avec R17=H, soit à l'étape (vi), avant l'étape d'acidolyse traité par une base
inorganique telle que de l'hydrure de sodium (NaH) en présence d'un halogénure
d'alkyle R17X avec X qui représente un atome de brome ou d'iode dans un
solvant
aprotique polaire tel que le diméthylformamide (DMF) et conduire au dérivé
carbamate
alkylé (II).
Les différents substituants, quand leur définition n'est pas précisée, sont
tels que
définis en formule générale (I).
Alternativement comme décrit au schéma 4 la chaine X-Am, avec X représente un
atome d'oxygène et Am fonctionnalisé avec une fonction amine protégée telle
qu'un
carbamate de tert-butyle, qui garanti une bonne stabilité lors de l'étape de
saponification de la fonction ester avec R tel que décrit précédemment, est
introduite à
partir une réaction de type Buchwald pour créer une liaison carbone-oxygène.
Ainsi à
l'étape (i), le couplage entre le dérivé (VI) avec Z représente un atome
d'halogène tel
qu'un atome d'iode et HXAm (V) est réalisé en présence d'une base minérale
telle que
du carbonate de césium (Cs2003) et d'une quantité catalytique d'un ligand de
type
phénanthrolidine et de cuivre (I) tel que Cul dans un solvant apolaire tel que
le toluène
chauffé à reflux. L'éther (IV) à l'étape (iii) est transformé en dérivé (II)
selon une
séquence saponification-couplage peptidique comme décrit au schéma 1. Enfin,
le
groupement carbamate de ter-butyle est acidolysé soit avec de l'acide
trifluoroacétique
ou soit avec du chlorure d'hydrogène dans un solvant aprotique tel que du
chlorure de
méthylène (CH2Cl2) ou de l'acétate d'éthyle (AcOEt) pour conduire au dérivé I.
Alternativement comme décrit au schéma 5, la chaine XAm peut être introduite à
partir
d'une réaction de type Wittig. A l'étape (i), la réaction d'acylation entre
l'indolizine (VIII)
et le chlorure d'acide (IX) avec X représente un atome d'halogène tel qu'un
atome de
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
17
chlore en présence d'une base organique telle que de la lutidine et de
pyridine en
quantité catalytique dans un solvant aprotique tel que du chlorobenzène
chauffé à
reflux conduit au composé (VII). A l'étape (ii) selon les conditions
d'Arbuzov, le dérivé
halogénure de benzyle (VII) traité dans un excès de dérivé phosphite (V) tel
que le
phosphite d'éthyle chauffé à reflux est transformé en phosphonate (VI). Une
réaction
de type Wittig à l'étape (iii) entre l'ester (VI) et un dérivé a-amino-
aldéhyde chiral (IV),
préparé à partir du composé parent a-amino-acide dont la fonction amine est
protégée
par un groupe carbamate de tert-butyle pour une déprotection finale en mileu
acide
aprotique, et d'une base inorganique telle que NaH dans un solvant aprotique
tel que
du THF conduit à l'alcène (III). A l'étape (y), l'alcène est transformé selon
une
séquence hydrogénation-saponification-couplage peptidique-acidoly se, comme
décrit
dans le schéma 2, en dérivé (I). Les différents substituants, quand leur
définition n'est
pas précisée, sont tels que définis en formule générale (I).
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
18
Schéma 1
0 OR
(i)
I H2/Pd-C
2 0 OR
0 (ii)
_______________________________________________ M. 0 OR
I ., Br
H3C N Cl H3C ry H3C N
R7 )Y IL rR7
(XII) (XI) (X) (IX)
0
Na2CO3 (iii)
iPrOH '
0 . X= A
Y
N \ (iv) N \
R7 mu _____________________________ R7
0 ------ 0 -----
0 Y
IlRO (VI) CI X RO (VIII)
. I
(v) AmH / K2CO3 / A
(V) (VII) X
C I Am
(iv') (VII')
0 * X=Am 0 * X=
Am
N \ (vi)-N\
R7 R7
_
0 ------ 0 ---
NaOH
(IV) (III)
RO OH
R1-H /
TBTU /DIEA
0 4. X= (II)
Am (vii)
- _____________
N \
R7
0
(I)
R1
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
19
Schéma 2
o o . z
N \ Cl V N \
R7 (VII) R7
0 \ ----- 0 \ -----
________________________________________ I.
(I)
RO RO
(VIII) (VI)
R19
H ______________________________________________________ = R20
(V) 71-R12
R10 (11)
Cul! DIEA /
PdC12(PPII3)
R19
R
R20 19
R20
o * o
IN-Ri7
R18
H2 OU HCO2NH4 / Me0H R18
V N \ .. ___________________ V N \
R2 R2
0 (iii) 0 \ '-
RO RO
(III) (IV)
NaOH (iv)
R
R10 19
R
R20 20
IN-Ri7 1%1-
R17
0 * 0 * R18
R10
V N \ R7
R1-H (II)! TBTU /DIEA V N \
R7
_________________________________________ 0
0 ii.
(y)
OH (II) R1 (I)
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
Schéma 3
R19
Cul / DIEA / R20
ID * Z PdC12(PPh3) (I) ----
----
. 0
0
R1, *
R13
V N \ H __ = R20 V N \
R, R,
O \ R130 0 \ ----
OR (VI) (IX) OR (VIII)
H2 OU HCO2NH4 / I (II)
Me0H / Pd-c
R19 R19
R2, R2,
ID = NBOC
I
H
DDPA / A 0 4. HO 0
terBuOH
N \ N \
R, - __________________________ R,
O \ (Hi) 0 \ ----
OR on OR
(VII)
1
(iv) NaOH R19 R19
R2, R2,
ID 4411b NBOC
I
H 0 * NBOC
I
H
N \ R1-H (II) / TBTU / DIEA N \
R, R,
O \ 'O \ ----
(y)
OH (IV) R1 (III)
TFA
Ri7=H R,X/ (vi)
(vii) NaH
R1, R19
R2, R2,
ID = NH
I
R17 TFA 0 . NIH
R17
IC ____________________________________
N \N \
R7 (VII) R7
ID ID ----
R1 (I) R1 (II)
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
21
Schéma 4
HXAm (V)
0 4t Z / Cul / Ligand / A 0 5 XAm
i.-
(I)
V N \ V N \
R7 R7
0 \ ----- 0 \
OR (VI) OR (IV)
NaOH (H)
0 . XAm 0 . XAm
a:NaOH
V N\ R b:R1-H (II) / TBTU / DIEA V N \ R
. _________________
7 ... 7
ID ....' ID
(iii)
R (H)
1 OH (III)
1 (iv) TFA ou HCI
0 . XAm
V N \ R7
ID ----
R1 (I)
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
22
Schéma 5
o
'IL 0 ex
R
CI X
N \ m V N \
R7
0 \ -- (IX)- 0 \
_____________________________________ i..-
RO (VIII) (I)
RO (VII)
P¨OR', (il)
(V)
R20
Ria
- NR,B0C
---
R20
O 4k, NR17BOC 0 . ,p
P,
NaH / THF R194 ________________________________________________________ R.ci)
OR'
sz;\ (IV)
V N\ - ____________ H V N \
R7 R7
0 \
0 \ -----
(Hi)
RO (I") RO (VI)
H2 OU HCO2NH4 i
(iv) Me0H
R20
R19
Y NR17BOC
0 *a: NaOH
b: TBTU / DIEA / R -H
V N \ 1 R20
R7 C: TFA ou HCI R19
0 \ ----- N(H)R17
RO (II) (y)
o,
V N \
R7
0 \
(I)
R
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
23
L'invention, selon un autre de ses aspects, a également pour objet les
composés de
formules (VI)
0 =13',5)
R10 OR
N
R7
RO (VI)
dans laquelle :
- R7 est tel que défini dans la revendication1 ;
- R représente un groupement (C1-C4) alkyle ;
- R' représente un groupement (C1-C4) alkyle ;
- P représente un atome de phosphore ; à l'état de base ou de sel d'addition à
un
acide, tel que décrit dans le schéma de synthèse 5. Ces composés sont utiles
comme
intermédiaires de synthèse des composés de formule (I).
Les abréviations et formules brutes suivantes sont utilisées :
anh. anhydre
AcOEt acétate d'éthyle
DCM dichlorométhane
DCE dichloroéthane
DIEA N,N-diisopropyléthylamine
D1PA Disopropylamine
DIAD Diisopropyl azodicarboxylate
DPPA azoture de diphénylphosphoryle
DMF diméthylformamide
EDCI N-ethyl-N'-(3-dimethyliminopropy1)-carbodiimid * HCI
HM PA hexamethylphosphoramide
HOBt 1-hydroxy benzotriazole
HPLC high performance liquid chromatography
LC/MS chromatographie liquide/ spectrométrie de masse
NMP N-méthylmorpholine
Pd-C Palladium sur charbon
TBTU Tétrafluoroborate de N-[(111-benzotriazol-1-
yloxy)(diméthylamino)
méthylidènej-N-méthylméthanaminium
TEA triéthylamine
THF tétrahydrofurane
TA temperature ambiante
TFA acide trifuoroac étique
DIAD 1,1'-(azodicarbonyl)dipiperidine
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
24
DME diméthoxyéthane
DMF diméthylformamide
DMSO diméthyl sulfoxide
Les exemples suivants illustrent la préparation de certains composés conformes
à
l'invention. Les numéros des composés exemplifiés renvoient à ceux du tableau
donné
plus loin qui illustre les structures chimiques et les propriétés physiques de
quelques
composés selon l'invention :
Les points de fusion ont été mesurés avec un appareil Büchi melting point B-
545 .
Les pouvoirs rotatoires ont été mésurés avec un appareil Perking Elmer 343
.
Les spectres de masse sont obtenus dans les conditions de couplage LC/MS
suivantes :
Conditions A :
Colonne :Kromasil 50x2,1 mm 6,5 pm
Eluants : A = CH3CN / TFA (0,05 %)
B = H20 / CH3CN / TFA (1000 : 3 : 0,5)
Gradients t (mm) %A %B Débit (mL/mm)
0 0 100 0,5
12 100 0 0,5
15 100 0 0,5
Conditions B :
Colonne : Acquity BEH C18 (50x2,1 mm 1,7 pm)
Eluants : A = H20 / TFA (0,05 %)
B = CH3CN / TFA (0,035 %)
Gradients t (mm) %A %B Débit (mL/mm)
0 98 2 1
1,6 0 100 1
2,1 0 100 1
On note le temps de rétention par Tr.
- Les spectres de résonnance magnétique du proton (RMN1H), tels que décrits ci-
dessous, sont enregistrés à 400MHz dans du DMSO-d6, en utilisant le pic du
DMS0-
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
d5 comme référence (O = 2,5 ppm). Les déplacements chimiques O sont exprimés
en
partie par million (ppm). Les signaux observés sont exprimés ainsi : s =
singulet ; d =
doublet ; t = tuplet ; m = massif ou singulet large ; H = proton (pour les
rotamères, on
note HA,, et Hm en référence aux isomères majoritaires ou minoritaires M et m
respectivement).
Exemple 1: Synthèse de l'intermédiaire 2-buty1-3-({4[3-(dibutylamino)propyl]
phényl}carbonyl)indolizine-7-carboxylate de 1-méthyléthyle
1.1 2-méthylpyridine-4-carboxylate de 1-méthyléthyle
Un mélange de 11,9 g (55,7 mmoles) de 2-chloro-6-méthylpyridine-4-carboxylate
de 1-
méthyléthyle et de 1,2 g de palladium sur charbon actif à 10 % dans 150 mL de
iPrOH
est agité 24 h à température ambiante sous 4 bar d'hydrogène. Par température
ambiante, on entend une température comprise entre 5 et 25 C. Le mélange
réactionnel est filtré et le filtrat est concentré sous pression réduite. Le
résidu obtenu
est ensuite repris par 200 mL d'eau, neutralisé à 0 C à l'aide de Na2003, puis
extrait
avec 3x200 mL de DOM. Les phases organiques sont rassemblées, séchées sur
sulfate de sodium, filtrées puis concentrées sous pression réduite. Le résidu
est purifié
par chromatographie sur une colonne de silice en éluant avec un gradient
AcOEt/cyclohexane de 0 à 30 % en AcOEt. Après concentration sous pression
réduite,
on obtient 38,05 g de 2-méthylpyridine-4-carboxylate de 1-méthyléthyle sous
forme
d'une huile incolore.
Rendement = 70 %
1.2 Bromure de 2-méthy1-44(1-méthyléthoxy)carbony11-1-(2-
oxohexyl)pyridinium
Un mélange de 9,88 g (55,13 mmoles) de 2-méthylpyridine-4-carboxylate de 1-
méthyléthyle et 14,88 g (82,69 mmoles) de 1-bromohexan-2-one dans 30 mL de
butan-
2-one est chauffé à reflux pendant 24 h. On laisse revenir à température
ambiante, on
filtre le précipité ainsi obtenu puis on le lave successivement avec de la
butan-2-one et
du pentane. On obtient ainsi 16,4 g de bromure de 2-méthy1-4-[(1-méthyléthoxy)
carbonyI]-1-(2-oxohexyl)pyridinium sous forme d'une poudre blanchâtre utilisée
telle
quel à l'étape suivante.
Rendement = 82 %.
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
26
1.3 2-butylindolizine-7-carboxylate de 1-méthyléthyle
Un mélange de 16,4 g (45,52 mmoles) de bromure de 2-méthy1-4-[(1-méthyléthoxy)
carbonyI]-1-(2-oxohexyl)pyridinium et de 14 ,17 g (136,52 mmoles) de Na2003
dans
200 mL de iPrOH est chauffé à reflux pendant 1h30. Le mélange réactionnel est
ensuite concentré sous pression réduite, puis repris par 200 mL d'eau et
extrait avec
3x150 mL de DOM. Les phases organiques sont rassemblées, séchées sur sulfate
de
sodium, filtrées puis concentrées sous pression réduite. Le résidu obtenu est
purifié
par chromatographie sur une colonne de silice en éluant avec du DOM. Après
concentration sous pression réduite, on obtient 8,24 g de 2-butylindolizine-7-
carboxylate de 1-méthyléthyle sous forme d'un solide jaune.
Rendement = 70 %.
1.4 2-buty1-3-{[4-(3-chloropropyl)phényl]carbonyllindolizine-7-carboxylate
de 1-
méthyléthyle
8,24 g (31,77 mmoles) de 2-butylindolizine-7-carboxylate de 1-méthyléthyle et
6,89 g
(31,77 mmoles) de chlorure de 4-(3-chloropropyl)benzoyle sont agités 4h30 à 85
C.A
température ambiante, le mélange réactionnel est repris par 200 mL d'eau,
neutralisé
avec du Na2003 puis extrait avec 3x150 mL d'éther. Les phases organiques sont
rassemblées, séchées sur Na2SO4, filtrées puis concentrées sous pression
réduite. Le
résidu obtenu est chromatographié sur une colonne de silice en éluant avec un
gradient AcOEt/cyclohexane de 0 à 10 % en AcOEt. Après concentration sous
pression réduite, on obtient 12,4 g de 2-buty1-3-{[4-(3-chloropropyl)
phényl]carbonyl}indolizine-7-carboxylate de 1-méthyléthyle sous forme d'un
solide
jaune.
Rendement = 89%.
1.5 Chlorhydrate de 2-buty1-3-({413-(d ibutylamino)propyl]phényllcarbonyl)i
ndolizine
-7-carboxylate de 1-méthyléthyle
Un mélange de 12,4 g (28,18 mmoles) de 2-buty1-3-{[4-(3-chloropropyl) phényl]
carbonyl}indolizine-7-carboxylate de 1-méthyléthyle, de 5,46 g (42,27 mmoles)
de di-
nbutylamine, de 11,69 g (84,55 mmoles) de K2003 et de 4,68 g (28,18 mmoles) de
KI
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
27
dans 350 mL de CH3CN est chauffé à reflux pendant 3 jours. Le mélange
réactionnel
est concentré sous pression réduite, repris par 200 mL d'eau puis extrait avec
3x200
mL d'AcOEt. Les phases organiques sont rassemblées, séchées sur Na2SO4,
filtrées
puis concentrées sous pression réduite. Le résidu obtenu est chromatographié
sur une
colonne de silice en éluant avec un gradient AcOEt/cyclohexane de 0 à 40 % en
AcOEt. Après concentration sous pression réduite, on obtient 12,7 g de 2-buty1-
3-({4-
[3-(dibutylamino)propyl]phényl}carbonyl)indolizine-7-carboxylate de 1-
méthyléthyle
sous forme d'une huile jaune.
Rendement = 85 %
Le chlorhydrate est préparé en reprenant la base par une solution 0,1 N
d'acide
chlorhydrique dans du iPrOH (1,1 éq.) qui est ensuite concentrée sous pression
réduite
et le résidu obtenu est chromatographié sur phase inverse RP18 en éluant avec
un
gradient CH3CN/H20 (HCI 0,01N) de 0 à 100% en CH3CN puis lyophilisé.
F( C) = gomme hygroscopique
LC/MS : M = C34H48N203 = 532; M+H = 533 ; Tr 13,0 min (conditions A).
RMN1H (ppm, d6-DMSO, 400 MHz) :
10,30-10,15 (m, 1H) ; 9,30 (d, 1H) ; 8,30 (s, 1H) ; 7,60 (d, 2H) ; 7,45 (d,
2H) ; 7,30 (d,
1H) ; 6,85 (s, 1H) ; 5,25-5,10 (m, 1H) ; 3,15-2,95 (m, 6H) ; 2,85-2,70 (t, 2H)
; 2,40-2,25
(t, 2H) 2,15-1,95 (m, 2H) 1,70-1,55 (m, 4H) 1,50-1,30 (m, 12H) ; 1,10-1,00 (m,
2H) ;
0,95 (t, 6H) 0,70 (t, 3H).
Exemple 2 : composé n 02: Chlorhydrate de (S)-1-{[2-buty1-3-({4[3-
(dibutylamino)
propyllphényl}carbonyl)indolizin-7-yllcarbonyl}prolinate de méthyle
2.1 Acide 2-buty1-3-({443-(dibutylamino)propyllphényllcarbonyl)indolizine-7-
carboxylique
Un mélange de 12,7 g (23,84 mmoles) de 2-buty1-3-({4[3-(dibutylamino) propyl]
phényl}carbonyl)indolizine-7-carboxylate de 1-méthyléthyle et de 1,91 g (47,68
mmoles) de NaOH dans 100 mL de dioxanne et 20 mL d'eau est agité 3 jours à
température ambiante. Le mélange réactionnel est ensuite neutralisé à l'aide
d'une
solution aqueuse 2N d'acide chlorhydrique, concentré sous pression réduite et
le
précipité ainsi obtenu est filtré, lavé avec de l'eau glacée puis avec de
l'éther. On
obtient, après séchage sous pression réduite, 11,4 g d'acide 2-buty1-3-({443-
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
28
(dibutylamino)propyl]phényl}carbonyl)indolizine-7-carboxylique sous forme d'un
solide
jaune.
Rendement = 97 %
2.2 Chlorhydrate de (S)-1-{1-2-buty1-3-({443-(dibutylamino)propyllphényll
carbonyl)
indolizin-7-ylicarbonyllprolinate de méthyle
A une solution de 1,5 g (3,06 mmoles) d'acide 2-buty1-3-({4[3-(dibutylamino)
propyl]
phényl}carbonyl)indolizine-7-carboxylique, de 0,51 g (3,06 mmoles) de (S)-
prolinate de
méthyle et de 1,07 mL (6,11 moles) de DIEA dans 30 mL de DOM, on ajoute par
petites quantités, à 0 C, sous argon, 1,0 g (3,06 mmoles) de TBTU. On laisse
revenir
lentement le mélange réactionnel à température ambiante et on poursuit
l'agitation
pendant 18h. Le mélange réactionnel est repris par 150 mL de DOM, lavé
successivement avec 2X75mL d'une solution saturée de NaHCO3, 2x75 mL d'eau
75mL de saumure, séché sur Na2SO4, filtré, le filtrat est ensuite traité avec
1 mL d'une
solution 4N de chlorure d'hydrogène dans le dioxane puis concentré sous
pression
réduite. Le résidu obtenu est chromatographié sur phase inverse RP18 en éluant
avec
un gradient CH3CN/H20 (HCl 0,01N) de 0 à 100% en CH3CN. Après concentration
sous pression réduite et une lyophilisation, on obtient 1,33 g de chlorhydrate
de (S)-1-
{[2-buty1-3-({443-(dibutylamino)propyl]phényl}carbonyl)indolizin-7-
yl]carbonyl}prolinate
de méthyle.
Rendement = 68 %
F( C) : gomme hygroscopique
[]D2 = -22 (c = 0,1 ; Me0H)
LC/MS : M = C37H51 N304 = 601 ; M+H = 602 ; Tr = 9,0 min (conditions A).
RMN1H (ppm, d6-DMSO, 400 MHz, 2 conformères M/m 8:2) :
10,10-10,00 (m, 1H) ; 9,35 (d, 1H) ; 7,90 (s, 1Hm) ; 7,70 (s, 1Hm) ; 7,60 (d,
2H) ; 7,40 (d,
2H) ; 7,05 (d, 1Hm) ; 6,85 (d, 1Hm) ; 6,70 (s, 1Hm) ; 6,65 (s, 1Hm) ; 4,70-
4,60 (m, 1Hm) ;
4,60-4,50 (m, 1Hm) ; 3,80-3,45 (m, 5H) ; 3,15-2,95 (m,6H) ; 2,80-2,70 (m, 2H)
; 2,40-
2,20 (m, 3H) ; 2,10-1,85 (m, 5H) ; 1,70-1,55 (m,4H) ; 1,45-1,25 (m,6H) ; 1,10-
0,95 (m,
2H) ; 0,90 (t, 6H) ; 0,70 (t, 3H).
Exemple 3 : composé n 3 : Chlorhydrate de (R)-1-{[2-buty1-3-({4[3-
(dibutylamino)
propyllphényl}carbonyl)indolizin-7-yllcarbonyl}prolinate de méthyle
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
29
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 1,50 g
(3,06
mmoles) d'acide 2-buty1-3-({443-
(dibutylamino)propyl]phényl}carbonyl)indolizine-7-
carboxylique et de 0,50 g (3,06 mmoles) de (R)-prolinate de méthyle, on
obtient, après
une phase inverse sur RP18 en éluant avec un gradient CH3CN/H20 (HCI 0,01N) de
0
à 100 `)/0 en CH3CN et une lyophilisation, 1,20 g de chlorhydrate de (R)-1-{[2-
buty1-3-
({443-(dibutylamino)propyl]phényl}carbonyl)indolizin-7-yl]carbonyl}prolinate
de méthyle
Rendement = 65 `)/0
F( C) : gomme hygroscopique
[]D2 = +22 (c = 0,1 ; Me0H)
LC/MS : M = C37H51 N304 = 601 ; M+H = 602 ; Tr = 9,0 min (conditions A).
RMN1H (ppm, d6-DMSO, 400 MHz, 2 conformères M/m 85:15) :
9,90-9,75 (m, 1H) ; 9,35 (d, 1H) ; 7,90 (s, 1Hm) ; 7,70 (s, 1Hm) ; 7,60 (d,
2H) ; 7,45 (d,
2H); 7,05 (d, 1Hm) ; 6,90 (d, 1Hm) ; 6,75 (s, 1Hm) ; 6,65 (s, 1Hm) ; 4,75-4,65
(m, 1Hm) ;
4,60-4,50 (m, 1Hm) ; 3,80-3,50 (m, 5H) ; 3,15-2,95 (m,6H) ; 2,85-2,70 (m, 2H)
; 2,40-
2,20 (m, 3H) ; 2,10-1,80 (m, 5 H) ; 1,70-1,50 (m,4H) ; 1,45-1,25 (m,6H) ; 1,10-
0,95 (m,
2H) ; 0,90 (t, 6H) ; 0,70 (t, 3H).
Exemple 4: composé n 4: Chlorhydrate de 2-buty1-3-({4-[3-(dibutylamino)
propyl]phényl}carbony1)-N-éthyl-N-(2-méthoxyéthyl)indolizine-7-carboxamide
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 1,0 g (2,04
mmoles) d'acide 2-buty1-3-({443-
(dibutylamino)propyl]phényl}carbonyl)indolizine-7-
carboxylique et 0,36 g (2,55 mmoles) de N-éthy1-2-méthoxyéthanamine, on
obtient
après une phase inverse RP18 et une lyophilisation, 0,75 g de chlorhydrate de
2-buty1-
3-({443-(dibutylamino)propyl]phényl}carbony1)-N-éthyl-N-(2-
méthoxyéthypindolizine-7-
carboxamide sous forme d'une mousse jaune hygroscopique.
Rendement = 60 `)/0
F( C) : gomme hygroscopique
LC/MS : M = C36H63N303 = 575; M+H = 576 ; Tr = 9,6 min (conditions A)
RMN1H (ppm, d6-DMSO, 400 MHz) :
10,00 (sl, 1H) ; 9,40 (d, 1H) ; 7,70 (s, 1H) ; 7,60 (d, 2H) ; 7,45 (d, 2H) ;
6,90 (d, 1H) ;
6,65 (s, 1H) ;3,70-3,15 (m, 8H) ; 3,15-2,95 (m, 6H) ; 2,80-2,70 (m, 2H) ; 2,30-
2,20 (m,
2H) ; 2,10-1,95 (m, 2H) ; 1,70-1,55 (m, 4H) ; 1,40-1,25 (m, 6H) ; 1,20-0,95
(m, 6H) ;
0,90 (t, 6H) ; 0,70 (t, 3H).
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
Exemple 5 : composé n 5: Chlorhydrate de N-{[2-buty1-3-({4[3-(dibutylamino)
propyllphényl) carbonyl)i ndol izi n-7-yllcarbony1)-N-éthylglyci nate de
méthyle
5.1 Chlorhydrate de N-éthylqlycinate de méthyle
A une solution de 2,1 g (20,36 mmoles) de N-éthylglycine dans 40 mL de Me0H,
on
ajoute goutte à goutte, à 0 C, 3mL (40,72 mmoles) de chlorure de thionyle. On
laisse
revenir à température ambiante, puis après 4 h d'agitation, on concentre le
mélange
réactionnel sous pression réduite. Le résidu obtenu est concrétisé dans de
l'éther, filtré
et lavé successivement avec de l'éther et du pentane. On obtient 3 g de
chlorhydrate
de N-éthylglycinate de méthyle sous forme d'un solide blanc utilisé tel quel à
l'étape
suivante.
Rendement = 95 %
5.2 Chlorhydrate de N-{[2-buty1-3-({4[3-(dibutylam
ino)propyl]phényllcarbonyl)
indolizin-7-yl]carbonyll-N-éthylglycinate de méthyle
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 2,0 g (4,08
mmoles) d'acide 2-buty1-3-({443-(d ibutylam
ino)propyl]phényl}carbonyl)indolizine-7-
carboxylique et de 0,78 g (5,09 mmoles) de chlorhydrate de N-éthylglycinate,
on
obtient, après une phase inverse RP18 en éluant avec un gradient CH3CN/H20
(HCI
0,01N) de 0 à 30 % en CH3CN et une lyophilisation, 0,77 g de chlorhydrate de N-
{[2-
buty1-3-({443-(dibutylamino)propyl]phényl}carbonyl)indolizin-7-yl]carbony1}-N-
éthylglycinate de méthyle sous forme d'une mousse jaune hygroscopique.
Rendement = 30 %
F( C) : gomme hygroscopique
LC/MS : M = C36H51 N304 = 589; M+H = 590 ; Tr = 9,30 min (conditions A)
RMN1H (ppm, d6-DMSO, 400 MHz, 2 conformères) :
10,15-10,00 (m, 1H) ; 9,45-9,35 (m, 1H) ; 7,75-7,65 (m, 1H) ; 7,60 (d, 2H) ;
7,45 (d, 2H)
; 7,00-6,85 (m, 1H) ; 6,75-6,65 (m, 1H) ; 4,25 (s, 2H) ; 3,80-3,65 (m, 3H) ;
3,55-3,35 (m,
3H) ; 3,15-2,95 (m, 6H) ; 2,85-2,70 (t, 2H) ; 2,30-2,20 (t, 2H) ; 2,10-1,95
(m, 2H) ;1,70-
1,55 (m, 4H) ; 1,45-1,25 (m, 6H) ; 1,20-1,10 (t, 2H) ; 1,10-1,00 (m, 2H) ;
0,95 (t, 6H) ;
0,70 (t, 3H).
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
31
Exemple 6: composé n 6: Chlorhydrate de N-{[2-buty1-3-({4[3-(dibutylamino)
propyllphényl) carbonyl)indolizin-7-yllcarbony1)-N-éthylglycine
A une solution de 1,6 g (2,71 mmoles) de N-{[2-buty1-3-({4[3-(dibutylamino)
propyl]
phényl}carbonyl)indolizin-7-yl]carbony1}-N-éthylglycinate de méthyle, on
ajoute à 0 C
3.0 mL (3.0 mmoles) d'une solution aqueuse 1N de soude puis on laisse revenir
à
température ambiante et on poursuit l'agitation pendant 24 h. Le mélange
réactionnel
est traité avec 1,0 mL d'une solution 4N de chlorure d'hydrogène dans le
dioxane,
concentré sous pression réduite puis chromatographié sur phase inverse RP18 en
éluant avec un gradient CH3CN/H20 (HCI 0,01N) de 0 à 30 % en CH3CN. Après
concentration sous pression réduite et une lyophilisation, on obtient 0,78 g
de
chlorhydrate de N-{[2-buty1-3-({443-
(dibutylamino)propyl]phényl}carbonyl)indolizin-7-
yl]carbony1}-N-éthylglycine sous forme d'une mousse jaune hygroscopique.
Rendement = 41 %
F( C) : mousse jaune hygroscopique
LC/MS : M = C35H49N304 = 575; M+H = 576 ; Tr = 8,6 min (conditions A)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,45-9,30 (m, 1H) ; 7,75-7,55 (m, 3H) ; 7,4 (d, 2H) ; 6,95-6,80 (m, 1H) ; 6,75-
6,60 (m,
1H); 4,20-4,05 (m, 2H) ; 3,60-3,20 (m, 2H) ; 3,15-2,95 (m, 6H) ; 2,85-2,70 (t,
2H) ; 2,30-
2,20 (t, 2H) ; 2,10-1,95 (m, 2H) ; 1,70-1,55 (m, 4H) ; 1,45-1,25 (m, 6H) ;
1,20-0,90 (m,
11H) ; 0,70(t, 3H).
Exemple 7: composé n 7: Chlorhydrate de 3-({2-Buty1-344-(3-dibutylamino-
propy1)-benzoyll-indolizine-7-carbony1}-ethyl-amino)-propionic acid
7.1 Chlorydrate de N-{12-
buty1-3-({4[3-(dibutylamino)propyllphényllcarbonyl)
indolizin-7 -yl]carbonyll-N-éthyl-p-alaninate de méthyle
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 2,0 g (4,08
mmoles) d'acide 2-
buty1-3-({443-(dibutylamino)propyl]phényl}carbony1)-N,N-
diéthylindolizine-7-carboxamide et de 0,54 g (4,08 mmoles) de N-éthy1-13-
alaninate de
méthyle, on obtient 2.2 g de chlorydrate de N-{[2-buty1-3-({4[3-(dibutylamino)
propyl]phényl}carbonypindolizin-7-yl]carbony1}-N-éthyl-13-alaninate de
méthyle.
Rendement = 89 %
F( C) : mousse jaune hygroscopique
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
32
LC/MS : M = C371-163N304 = 603; M+H = 604 ; Tr = 1,18 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,40 (d, 1H) ; 7,65 (s, 1H) ; 7,60 (d, 2H) ; 7,45 (d, 2H) ; 6,90 (d, 1H) ,
6,65 (s, 1H) ;
3,80-3,20 (m, 7H) ; 3,15-3,00 (m, 6H) ; 2,80-2,70 (m, 2H) ;2,70-2,60 (t, 2H) ;
2,30-2,20
(t, 2H) ; 2,10-1,95 (m, 2H) 1,70-1,55 (m, 4H) ; 1,45-1,25 (m, 6H) ; 1,20-0,90
(m, 11H) ;
0,70 (t, 3H).
7.2 Chlorhydrate de 3-({2-Buty1-344-(3-dibutylamino-propy1)-benzoyll-
indolizine-7-
carbonyll-ethyl-am ino)-propion ic acid
On procède de la même façon qu'à l'exemple 6. Ainsi, à partir de 1.1g
(1.82mmoles)
de N-{[2-buty1-3-({443-(dibutylamino)propyl]phényl}carbonypindolizin-7-
yl]carbony1}-N-
éthyl-13-alaninate de méthyle, 0.91g de chlorhydrate de 3-({2-Buty1-344-(3-
dibutylamino-propy1)-benzoy1Findolizine-7-carbonyl}-ethyl-amino)-propionic
acid sous
forme d'une mousse hygroscopique.
Rendement = 85 %
F( C) : mousse hygroscopique
LC/MS : M = C36H51 N304 = 589; M+H = 590 ; Tr = 1.09 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,40 (d, 1H) ; 7,65 (s, 1H) ; 7,60 (d, 2H) ; 7,45 (d, 2H) ; 6,90 (d, 1H) ,
6,65 (s, 1H) ;
3,80-3,20 (m, 4H) ; 3,15-3,00 (m, 6H) ; 2,80-2,70 (m, 2H) ;2,70-2,60 (t, 2H) ;
2,30-2,20
(t, 2H) ; 2,10-1,95 (m, 2H) 1,70-1,55 (m, 4H) ; 1,45-1,25 (m, 6H) ; 1,20-0,90
(m, 11H) ;
0,70 (t, 3H).
Exemple 8 : composé n 8: Chlorhydrate de N-{[3-({4[3-(cyclopentylamino)propyl]
phényl) carbonyI)-2-éthyli ndol izi n-7-yllcarbony1)-N-propan-2-ylglyci nate
de
méthyle.
8.1 Bromure de 2-méthy1-1-(2-oxopropy1)-4-[(propan-2-
yloxy)carbonyl]pyridinium
On procède de la même façon qu'à l'exemple 1.2. Ainsi, à partir de 39,0 g
(217,61
mmoles) de 2-méthylpyridine-4-carboxylate de 1-méthyléthyle et 49,29 g (326,42
mmoles) de 1-bromobutanone dans 120 mL de butan-2-one, on obtient 66,15 g de
bromure de 2-méthy1-1-(2-oxopropy1)-4-[(propan-2-yloxy)carbonyl]pyridinium
sous
forme d'une poudre jaune pâle utilisée telle quelle à l'étape suivante.
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
33
Rendement = 96 %
8.2 2-éthylindolizine-7-carboxylate de propan-2-yle
On procède de la même façon qu'à l'exemple 1.3. Ainsi, à partir de 66,15 g
(209
mmoles) de bromure de 2-méthy1-1-(2-oxopropy1)-4-[(propan-2-yloxy) carbonyl]
pyridinium et de 6,5 g (627,62 mmoles) de Na2003 dans 700 mL de iPrOH, on
obtient
40 g de 2-éthylindolizine-7-carboxylate de propan-2-yle sous forme d'un solide
jaune
pâle.
Rendement = 83 %
8.3 3-{[4-(3-chloropropyl)phényl]carbony1}-2-éthylindolizine-7-carboxylate
de
propan-2-yle
On procède de la même façon qu'à l'exemple 1.4. Ainsi, à partir de 10,0 g
(43,24
mmoles) de 2-éthylindolizine-7-carboxylate de propan-2-yle et de 25,03 g
(51,88
mmoles) de chlorure de 4-(3-chloropropyl)benzoyle, on obtient 17,6 g de 3-{[4-
(3-
chloropropyl)phényl]carbony1}-2-éthylindolizine-7-carboxylate de propan-2-yle
sous
forme d'une huile jaunâtre qui cristallise lentement .
Rendement = 98 %.
8.4 3-[(4-{3-Rtert-butoxycarbonyl)(cyclopentypamino]propyllphényl)carbonyl]-
2-
éthylindolizine-7-carboxylate de propan-2-yle
Dans un tube scellé, un mélange de 4,0 g (9,71 mmoles) de 3-{[4-(3-
chloropropyl)
phényl]carbonyI}-2-éthylindolizine-7-carboxylate de propan-2-yle, de 1,65 g
(19,42
mmoles) de cyclopentyl-amine et de 1,69 g (10,2 mmoles) de KI dans 30 mL d'un
mélange CH3CN / DMF 2:1 est chauffé 18h à 105 C. Le mélange réactionnel est
ensuite concentré sous pression réduite, puis repris par 200 mL de DOM, lavé
successivement avec 2x300mL d'eau et 100 mL de saumure, séché sur Na2SO4,
filtré
et concentré sous pression réduite. On obtient ainsi 2,08 g d'une poudre jaune
que l'on
reprend par 25 mL de DOM, puis on ajoute à 0 C 1,28 g (5,90 mmoles) de Boc20
et
0,46 g (4,52 mmoles) de TEA. Après 18h d'agitation à températue ambiante (TA),
le
mélange réactionnel est repris par 200 mL de DOM, lavé successivement avec 100
ml
d'eau et 100 mL de saumure, puis séché sur MgSO4, filtré et concentré sous
pression
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
34
réduite. Le résidu obtenu est purifié par chromatographie sur une colonne de
gel de
silice en éluant avec un gradient DCM/Me0H de 0 à 5 % en Me0H. Après
concentration sous pression réduite, on obtient 2,37 g de 3-[(4-{3-Rtert-
butoxycarbonyl)(cyclopentyl)am ino]propyl}phényl)carbony1]-2-éthylindolizine-7-
carboxylate de propan-2-yle sous forme d'une gomme jaune.
Rendement = 43 %
8.5 Acide 34(4-{3-Rtert-
butoxycarbonyl)(cyclopentypaminolpropyllphényl)carbony11-
2-éthylindolizine-7-carboxylique
A une solution de 2,37 g (4,23 mmoles) de 3-[(4-{3-Rtert-
butoxycarbonyl)(cyclopentyl)am ino]propyl}phényl)carbony1]-2-éthylindolizine-7-
carboxylate de propan-2-yle dans 10 mL de dioxanne, on ajoute goutte à goutte
à TA
8,5 mL d'une solution aqueuse NaOH 1N et l'agitation est poursuivie 72 h. Le
mélange
réactionnel est refroidi à 0 C, traité en ajoutant goutte à goutte 10 mL d'une
solution
aqueuse HCI 1N puis extrait avec 2x200 mL de DOM. Les phases organiques sont
rassemblées, lavées avec 100 mL de saumure, séchées sur Na2SO4, filtrées, puis
concentrés sous pression réduite. On obtient ainsi 2,29 g d'acide 3-[(4-{3-
Rtert-
butoxycarbonyl)(cyclopentyl)am ino]propyl}phényl)carbony1]-2-éthylindolizine-7-
carboxylique sous forme d'un solide jaune utilisé tel quel à l'étape suivante.
Rendement = 100 %
8.6 N-({3-[(4-{3-Rtert-
butoxycarbonyl)(cyclopentypamino]propyllphényl)carbonyl]-2-
éthylindolizin-7-yllcarbonyl)-N-propan-2-ylglycinate de méthyle
Hormis l'étape de salification, on procède de la même façon qu'à l'exemple
2.2. Ainsi,
à partir de 2,29 g (4,42 mmoles) d'acide 3-[(4-{3-[(tert-butoxycarbonyl)
(cyclopentyl)amino]propyl}phényl)carbony1]-2-éthylindolizine-7-carboxylique,
de 0,96 g
(5,74 mmoles) de chlorhydrate de N-propan-2-ylglycinate de méthyle, de 1,71 g
(13,25
mmoles) de DIEA et de 2,13 g (6,62 mmoles) de TBTU dans 20 mL de DOM, on
obtient, après une purification sur colonne de silice en éluant avec un
gradient
AcOEt/cyclohexane de 0 à 40% de AcOEt, 2,0 g
de N-({3-[(4-{3-Rtert-
butoxycarbonyl)(cyclopentyl)am inceropyl}phényl)carbony1]-2-éthyl indolizi n-7-
yl}carbonyI)-N-propan-2-ylglycinate de méthyle sous forme d'une mousse jaune.
Rendement = 72 %
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
8.7 Chlorhydrate de N-{1-3-({443-(cyclopentylamino)propyllphényllcarbony1)-
2-
éthylindolizin-7-ylicarbonyll-N-propan-2-ylqlycinate de méthyle
A une solution de 2,0 g (3,06 mmoles) de N-({3-[(4-{3-[(tert-butoxycarbonyl)
(cyclopentyl)amino]propyl}phényl)carbony1]-2-éthylindolizin-7-y1}carbony1)-N-
propan-2-
ylglycinate de méthyle dans 20 mL de DOM, on ajoute goutte à goutte à 0 C une
solution 2N de chlorure d'hydrogène dans Et20 puis on laisse revenir à TA.
Après 24 h
d'agitation, le mélange réactionnel est concentré sous pression réduite et le
résidu
obtenu est trituré dans Et20, filtré sur un fritté et lavé avec Et20 puis
séché sous
pression réduite. On obtient ainsi 1,72 g de chlorhydrate de N-{[3-({443-
(cyclopentylamino)propyl]phényl}carbony1)-2-éthylindolizin-7-yl]carbony1}-N-
propan-2-
ylglycinate de méthyle sous forme d'une poudre jaune.
Rendement = 96 %
F( C) : 228
LC/MS : M = 032H41 N304 = 531 ; M+H = 532 ; Tr = 1,09 min (conditions B).
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,60 -9,50 (m, 1H) ; 8,70-8,50 (m, 1H) ; 7,70 (s, 1H) ; 7,60 (d, 2H) ; 7,40
(d, 2H) ; 6,90
(d, 1H) ; 6,70 (s, 1H) ; 4,20-4,00 (m, 3H) ; 3,75-3,65 (m, 3H) ; 3,50-3,40 (m,
1H) ; 3,00-
2,90 (t, 2H) ; 2,90-2,80 (t, 2H) ; 2,30-2,20 (m, 2H) ; 2,10-1,95 (m, 4H) ;
1,80-1,70 (m,
2H) ; 1,70-1,50 (m, 4H) ; 1,20-1,05 (m, 6H) ; 1,00 (t, 3H).
Exemple 9: composé n 9: Chlorhydrate de 2-buty1-3-({4[3-(dibutylamino)
propyllphényl}carbony1)-N-éthyl-N-[(2-méthyl-2H-tétrazol-5-
yl)méthyl]indolizine-7
-carboxamide
9.1 {2[(2-cyanoéthyl)aminol-2-oxoéthylléthylcarbamate de tert-butyle
A un mélange de 10,0 g (49,2 mmoles) de N-(tert-butoxycarbonyI)-N-
éthylglycine, de
6,89 g (98,41 mmoles) de 3-aminopropanenitrile et de 7,53 g (49,20 mmoles) de
HOBT dans 230 mL d'un mélange DCM/THF 8:2, on ajoute à 0 C et par petites
quantités 11,31 g (59,04 mmoles) de EDCI puis on laisse revenir lentement à TA
et on
poursuit l'agitation pendant 18h. Le mélange réactionnel est lavé
successivement avec
2x100 mL d'eau et 2x100 mL d'une solution saturée de K2003, séché sur MgSO4,
filtré
puis concentré sous pression réduite. On obtient ainsi 11,0 g de {2-[(2-
cyanoéthyl)
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
36
amino]-2-oxoéthyl} éthylcarbamate de tert-butyle sous forme d'un solide blanc
utilisé tel
quel à l'étape suivante.
Rendement = 88 %
9.2 {11-(2-cyanoéthyl)-1H-tétrazol-5-yllméthylléthylcarbamate de tert-
butyle
A un mélange de 6,0 g (23,50 mmoles) de {2-[(2-cyanoéthyl)amino]-2-
oxoéthyl}éthylcarbamate de tert-butyle et de 9,5 g (47,00 mmoles) de DIAD dans
48
mL de THF anh., on ajoute sous argon, par petites quantités, 12,32 g (47,00
mmoles)
de PPh3 puis 9,36 mL (70,50 mmoles) d'azoture de triméthylsilyle. Après 48 h
d'agitation à TA, le mélange réactionnel est repris par 250 mL d'AcOEt, lavé
successivement avec 2x100 mL d'eau et 2x100 mL de saumure, séché sur MgSO4,
filtré puis concentré sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur une colonne de gel de silice en éluant avec un gradient
AcOEt
/cyclohexane de 0 à 40 % en AcOEt. Après concentration sous pression réduite,
on
obtient 3,2 g de {[1-(2-cyanoéthyl)-1H-tétrazol-5-yl] méthyl}éthylcarbamate de
tert-
butyle sous forme d'une huile rougeâtre.
Rendement = 48 %
9.3 Ethyl(1H-tétrazol-5-ylméthyl)carbamate de tert-butyle
Un mélange de 3,3 g (11,77 mmoles) de {[1-(2-cyanoéthyl)-1H-tétrazol-5-yl]
méthyl}
éthylcarbamate de tert-butyle et de 17,7 mL d 'une solution aqueuse NaOH 1N
dans
24,0 mL de THF est agité 3 jours à TA. Le mélange réactionnel est ensuite
refroidi à
0 C, neutralisé en ajoutant goutte à goutte 17,7 mL d'une solution aqueuse HCI
1N
puis extrait avec 2x150 mL de DOM après addition de 40 mL de saumure. Les
phases
organiques sont rassemblées, lavées avec 50 mL de saumure, séchées sur Na2SO4,
filtrées puis concentrées sous pression réduite. On obtient ainsi 2,76 g de
éthyl(1 H-
tétrazol-5-ylméthyl)carbamate de tert-butyle sous forme d'une huile incolore
utilisée
telle quelle à l'étape suivante.
Rendement = 51 %
9.4 Ethylf(2-méthy1-2H-tétrazol-5-yl)méthyllcarbamate de tert-butyle
A une solution de 2,67 g (11,75 mmoles) d'éthyl(1H-tétrazol-5-
ylméthyl)carbamate de
tert-butyle dans 10,7 mL de DMF anh., on ajoute par petites quantités à 0 C,
sous
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
37
argon, 0,517 g (12,92 mmoles) de NaH à 60 % dans de l'huile. Après 30 min
d'agitation à 0 C, on ajoute goutte à goutte 0,73 mL (11,75 mmoles)
d'iodométhane et
l'agitation est poursuivie 18h à TA. Le mélange réactionnel est repris par 150
mL
d'AcOEt, lavé successivement avec 2x100 mL d'eau et 100 mL de saumure, séchée
sur Na2SO4, filtré puis concentré sous pression réduite. Le résidu obtenu est
purifié par
chromatographie sur une colonne de silice en éluant avec un gradient AcOEt
/cyclohexane de 0 à 40% en AcOEt. Après concentration sous pression réduite,
on
isole 0,95 g d'éthyl[(2-méthy1-2H-tétrazol-5-yl)méthyl]carbamate de tert-
butyle et 0,76 g
d'éthyl[(2-méthy1-2H-tétrazol-5-yl)méthyl]carbamate de tert-butyle sous forme
d'huiles
incolores.
Rendement = 60%
9.5 Chlorhydrate de N-R2-méthyl-2H-tétrazol-5-yl)méthylléthanamine
A une solution de 0.95 g (3,17 mmoles) d'éthyl[(1-méthy1-1H-tétrazol-5-
yl)méthyl]
carbamate de tert-butyle dans 6 mL de DOM, on ajoute 6mL d'une solution 2N de
chlorure dhydrogène dans Et20 et on poursuit l'agitation 18h à TA. Le mélange
réactionnel est ensuite concentré sous pression réduite, trituré dans Et20,
filtré et
séché sous pression réduite. On obtient ainsi 0,395 g de chlorhydrate de N-[(2-
méthy1-
2H-tétrazol-5-yl)méthyl]éthanamine sous forme d'un solide blanc utilisé tel
quel à
l'étape suivante.
Rendement = 56 %
9.6 Chlorhydrate de 2-buty1-3-({443-(dibutylamino)propyl]phényllcarbony1)-N-
éthyl-
N-[(2-méthyl-2H-tétrazol-5-y1)méthyl]indolizine-7-carboxamide
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 0,93 g
(1,90
mmoles) d'acide 2-buty1-3-({443-
(dibutylamino)propyl]phényl}carbonyl)indolizine-7-
carboxylique, de 0,36 g (2,0 mmoles) de chlorhydrate de N-[(1-méthy1-1H-
tétrazol-5-
yl)méthyl]éthanamine, de 0,74 g de (5,70 mmoles) de DIEA et de 0,92 g (2,85
mmoles)
de TBTU dans 9,5 mL de DOM, on obtient 0,91 g de chlorhydrate de 2-buty1-3-
({443-
(d ibutylamino)propyl]phényl}carbony1)-N-éthyl-N-[(2-méthyl-2H-tétrazol-5-
y1)méthyl]
indolizine-7-carboxamide sous forme d'une poudre blanche hygroscopique.
Rendement = 73 %
LC/MS : M = 036H51 N702 = 613 ; M+H = 614 ; Tr = 1,16 min (conditions B)
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
38
RMN1H (ppm, d6-DMSO, 400 MHz) :
10,40-10,30 (m, 1H) ; 9,40 (d, 1H) ; 7,80-7,70 (m, 1H) ; 7,60 (d, 2H) ; 7,50
(d, 2H) ;
7,00-6,90 (m, 1H) ; 7,70 (s, 1H) ; 5,00-4,80 (m, 2H) ; 4,40 (s, 3H) ; 3,55-
3,40 (m, 2H) ;
3,15-3,00 (m, 6H) ; 2,80-2,70 (t, 2H) ; 2,30-2,20 (t, 2H) ; 2,10-1,95 (m, 2H)
; 1,70-1,60
(m, 4H) ; 1,45-1,25 (m, 6H) ;1,20-1,10 (t, 2H) ; 1,10-1,00 (m, 2H) ; 1,00 (t,
6H) ; 0,70 (t,
3H).
Exemple 10: composé n 10: Chlorhydrate de 2-buty1-3- ({4-[3-(dibutylamino)
propyl]phényl}carbonyl) -N-éthyl-N- [(3-méthy1-1,2,4-oxadiazol-5-y1) méthyl]
indolizine-7-carboxamide
10.1 Ethyl[(3-méthy1-1,2,4-oxadiazol-5-yl)méthyl]carbamate de tert-butyle
A un mélange de 1,3 g (17,149 mmoles) de !'f-hydroxyéthanimidamide, de 3 g de
tamis moléculaire 3A en poudre dans 184 mL de THF anh, on ajoute par petites
quantités à 0 C sous argon, 1,9 g (29,92 mmoles) de NaH à 60 % dans l'huile.
Après 1
h d'agitation à TA, on ajoute une solution de 2,0 g (9,21 mmoles) de N-(tert-
butoxycarbony1)-N-éthylglycinate de méthyle dans 30 mL de THF anh. puis on
chauffe
le mélange réactionnel à reflux pendant 18h. Le mélange est ensuite filtré,
concentré
sous pression réduite, repris par 200 mL de DOM, lavé successivement avec
2x100
mL d'eau, 100 mL de saumure, séché sur Na2SO4, filtré puis à nouveau concentré
sous pression réduite. Le résidu obtenu est purifié par chromatographie sur
une
colonne de silice en éluant avec un mélange AcOEt/cyclohexane de 0 à 40 % en
AcOEt. Après concentration sous pression réduite, on obtient 1,65 g de
éthyl[(3-méthyl
-1,2,4-oxadiazol-5-yl)méthyl]carbamate de tert-butyle sous forme d'une huile
incolore.
Rendement = 74 %
10.2 Chlorhydrate de N-[(3-méthy1-1,2,4-oxadiazol-5-yl)méthylléthanamine
On procède de la même façon qu'à l'exemple 9.5. Ainsi, à partir de 1,65 g
(6,85
mmoles) de éthyl[(3-méthy1-1,2,4-oxadiazol-5-yl)méthyl]carbamate de tert-
butyle, on
obtient 1,05 g de chlorhydrate de N-[(3-méthy1-1,2,4-oxadiazol-5-
yl)méthyl]éthanamine
sous forme d'une poudre blanche.
Rendement = 86 %
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
39
10.3 Chlorhydrate de 2-buty1-3-({4-1-3-
(dibutylamino)propyllphényllcarbony1)-N-éthyl-
N-R3-méthyl-1,2,4-oxadiazol-5-y1)méthyllindolizine-7-carboxamide
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 0,52 g
(2,91
mmoles) de chlorhydrate de N-[(3-méthy1-1,2,4-oxadiazol-5-
yl)méthyl]éthanamine, de
1,3 g (2,65 mmoles) d' acide 2-buty1-3-({4[3-
(dibutylamino)propyl]phényl}carbonyl)
indolizine-7-carboxylique, de 1,03 g (3,97 mmoles) de TBTU dans 1,4 mL de DOM,
on
obtient 1,04 g de chlorhydrate de 2-buty1-3-({4[3-
(dibutylamino)propyl]phényl}carbonyl)
-N-éthyl-N-[(3-méthy1-1,2,4-oxadiazol-5-yl)méthyl]indolizine-7-carboxamide
sous forme
d'une gomme.
Rendement = 58 %
LC/MS : M = 037H51 N503 = 613 ; M+H = 614 ; Tr = 1,18 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
10,35-10,20 (m, 1H) ; 9,4 (d, 1H) ; 7,75 (s, 1H) ; 7,60 (d, 2H) ; 7,40 (d, 2H)
; 6,95 (d,
1H) ; 6,70 (s, 1H) ; 4,90 (s, 2H) ; 3,60-3,45 (m, 2H) ; 3,15-3,00 (m, 6H) ;
2,85-2,75 (t,
2H) ; 2,40 (s, 3H) ; 2,30-2,20 (t, 2H) ; 2,10-1,95 (m, 2H) ; 1,7-1,55 (m, 4H)
; 1,40-1,25
(m, 6H) ; 1,20 (t, 3H) ; 1,10-0,95 (m, 2H) ; 0,90 (t, 6H) ; 0,70 (t, 3H).
Exemple 11: composé n 11: Chlorhydrate de 2-buty1-3-({4[3-(dibutylamino)
propyllphényl}carbony1)-N-éthyl-N-(1H-tetrazol-5-ylméthyl)indolizine-7-
carboxamide
11.1 Chlorhydrate de 3-{5-Réthylamino)méthy11-1H-tétrazol-1-
yl}probanenitrile
On procède de la même façon qu'à l'exemple 9.5. Ainsi, à partir de 3,02 g
(11,42
mmoles) de {[1-(2-cyanoéthyl)-1H-tétrazol-5-yl]méthyl}éthylcarbamate de tert-
butyle,
on obtient 1,83 g de chlorhydrate de 3-{5-[(éthylamino)méthy1]-1H-tétrazol-1-
y1}
propanenitrile sous forme d'une poudre blanche.
Rendement = 74 %
11.2 2-butyl-N-{1-1 -(2-cyanoéthyl)-1H-tétrazol-5-yllméthyll-3-({443-
(dibutylamino)
propyllphényllcarbonyI)-N-éthylindolizine-7-carboxamide
Hormis l'étape de salification, on procède de la même façon qu'à l'exemple
2.2. Ainsi,
à partir de 2,0 g (4,08 mmoles) d'acide 2-buty1-3-({4[3-
(dibutylamino)propyl]phényl}
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
carbonyl)indolizine-7-carboxylique, de 0,97 g (4,48 mmoles) de chlorhydrate de
3-{5-
[(éthylamino)méthy1]-1H-tétrazol-1-Apropanenitrile, de 1,58 g (12,23 mmoles)
de DIEA
et de 1,97 g (6,11 mmoles) de TBTU dans 20 mL de DOM et d'une purification sur
une
colonne de silice en éluant avec un gradient DCM/Me0H de 0 à 5 % en Me0H,
après
concentration sous pression réduite, on obtient 1,35 g de 2-butyl-N-{[1-(2-
cyanoéthyl)-
1H-tétrazol-5-yl]méthyl}-3-({443-(dibutylamino)propyl]phényl}carbony1)-N-
éthylindolizine-7-carboxamide sous forme d'une mousse jaune.
Rendement = 50 %
11.3 Chlorhydrate de 2-buty1-3-({443-(dibutylamino)propyl]phényllcarbony1)-
N-éthyl-
N-(1H-tétrazol-5-ylméthypindolizine-7-carboxamide
Un mélange de 1,32 g (2,02 mmoles) de 2-butyl-N-{[1-(2-cyanoéthyl)-1H-tétrazol-
5-yl]
méthy1}-3-({4[3-(dibutylamino)propyl]phényl}carbony1)-N-éthylindolizine-7-
carboxamide
dans 5 mL de THF et 4 mL d'une solution aqueuse NaOH 1N est agité 18h à TA. Le
mélange réactionnel est ensuite neutralisé avec 4 mL d'une solution aqueuse
HCI1N,
on évapore le THF puis on extrait avec 2x50 mL de DOM. Les phases organiques
sont
rassemblées, lavées successivement avec 50 mL d'eau, 50 mL de saumure, séchées
sur Na2SO4, filtrées, traitées avec 2 mL d'une solution de chlorure
d'hydrogène 2N
dans Et20, puis concentrées sous pression réduite. Le résidu obtenu est
trituré dans
de l'éther, filtré puis séché sous vide. On obtient ainsi 1,19 g de
chlorhydrate de 2-
buty1-3-({443-(dibutylamino)propyl]phényl}carbony1)-N-éthyl-N-(1H-tétrazol-5-
ylméthyl)
indolizine-7-carboxamide sous forme d'une mousse hygroscopique.
Rendement = 92 %
LC/MS : M = 036H46N702 = 599; M+H = 600 ; Tr = 3,82 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :10,70-10,50 (m, 1H) ; 9,40 (d, 1H) ; 7,80 (s,
1H) ;
7,55 (d, 2H) ; 7,40 (d, 2H) ; 7,00 (d, 1H) ; 6,65 (s, 1H) ; 4,45 (s, 2H) ;
3,55-3,40 (m, 2H)
; 3,10-2,95 (m, 6H) ; 2,80-2,70 (t, 2H) ; 2,30-2,20 (m, 2H) ; 2,10-2,00 (m,
2H) ; 1,70-
1,60 (m, 4H) ; 1,40-1,25 (m, 6H) ; 1,15 (t, 3H) ; 1,05-0,95 (m, 2H) ; 0,90 (t,
6H) ; 0,65 (t,
3H).
Exemple 12: composé n 12: Chlorhydrate de N-[(2-buty1-3-{[4-(pipéridin-4-y1)
phényl]carbonyl}indolizin-7-yl)carbonyll-N-propan-2-ylglycinate de méthyle
12.1 Acide 411-(trifluoroacétyl)pipéridin-4-yeenzoïque
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
41
A une solution de 10,0 g (48,72 mmoles) d'acide 4-(pipéridin-4-yl)benzoïque
dans 490
mL de TH F, on ajoute goutte à goutte 20,34 mL (146,16 mmoles) de TFAA. Après
1 h
d'agitation à TA , le mélange réactionnel est concentré sous pression réduite,
repris
par 500 mL d'AcOEt, lavé successivement avec 200 mL d'eau et 200 mL de
saumure,
séché sur MgSO4, filtré puis à nouveau concentré sous pression réduite. Le
résidu
obtenu est ensuite trituré dans du pentane, filtré puis séché sous pression
réduite. On
obtient ainsi 11,24 g d'acide 4[1-(trifluoroacétyl)pipéridin-4-yeenzoïque sous
forme
d'un solide blanchâtre utilisé tel quel à l'étape suivante.
Rendement = 77 %
12.2 Chlorure de 4-11-(trifluoroacétyl)pipéridin-4-yllbenzoyle
Dans un tube scellé, un mélange de 11,2 g (37,18 mmoles) d'acide 441-
(trifluoroacétyl)pipéridin-4-yeenzoïque dans 35 mL (483 mmoles) de chlorure de
thionyle est chauffé à 70 C en présence d'une goutte de DMF. Après 5h à 70 C,
le
mélange réactionnel est ensuite concentré sous pression réduite. On obtient
ainsi
11,82 g de chlorure de 4[i-(trifluoroacétyl)pipéridin-4-yeenzoyle sous forme
d'un
solide blanchâtre utilisé tel quel à l'étape suivante.
Rendement = 100 %.
12.3 2-buty1-3-({4[i-(trifluoroacétyl)pipérid in-4-yl]phényllcarbonyl)i
ndolizine-7-
carboxylate de propan-2-yle
A une solution de 11,89 g (37,19 mmoles) de chlorure de 441-
(trifluoroacétyl)pipéridin-
4-yeenzoyle dans 41 mL de THF, on ajoute goutte à goutte une solution de 9,65
g
(37,19 mmoles) de 2-butylindolizine-7-carboxylate de 1-méthyléthyle et de 4,8
g (37,19
mmoles) de Dl EA puis on chauffe le mélange 5h à 85 C. A TA, le mélange
réactionnel
est concentré sous pression réduite, repris par 400 mL d'AcOEt, lavé
successivement
avec 200 mL d'eau et 200 mL de saumure, séché sur Na2SO4, filtré puis à
nouveau
concentré sous pression réduite. Le résidu obtenu est purifié par
chromatographie sur
une colonne de silice en éluant avec un mélange cyclohexane/AcOEt de 0 à 30 %
en
AcOEt. Après concentration sous pression réduite, on obtient 7,19 g de 2-buty1-
3-({441
-(trifluoroacétyl)pipéridin-4-yl]phényl}carbonyl)indolizine-7-carboxylate de
propan-2-yle
sous forme d'un solide blanchâtre avec une pureté déterminée par LC/MS de 90
%.
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
42
Rendement = 31 %
12.4 Acide 3-({4-11-(tert-butoxycarbonyl) pipéridin-4-yllphényllcarbony1)-2-
butylindolizine-7-carboxylique
Un mélange de 7,19 g (13,25 mmoles) de 2-buty1-3-({441-
(trifluoroacétyl)pipéridin-4-
yl]phényl}carbonyl)indolizine-7-carboxylate de propan-2-yle et de 4,58 g
(33,13
mmoles) de K2003 dans 270 mL de Me0H est agité 2 h à TA Le mélange réactionnel
est ensuite concentré sous pression réduite, repris par 200 mL d'eau, lavé
avec 2x100
mL de DOM, puis le précipité ainsi obtenu dans la phase aqueuse est filtré,
lavé avec
Et20 et séché sous pression réduite. On obtient ainsi 1,6 g d'un solide jaune
que l'on
met en solution dans 12 mL d'un mélange NaOH aq. 0,5N/dioxane 2 :1 auquel on
ajoute 0,95 g (4,36 mmoles) de Boc20. Après 4h d'agitation à TA, le mélange
réactionnel est refroidi à 0 C, neutralisé avec 30 mL d'une solution aqueuse
HCI 0,2 N
puis extrait avec 2x150 mL de DOM. Les phases organiques sont rassemblées,
lavées
avec 50 mL de saumure, séchées sur Na2SO4, filtrées puis concentrées sous
pression
réduite. On obtient ainsi 2,29 g d'acide 3-({4[1-(tert-
butoxycarbonyl)pipéridin-4-yl]
phényl}carbonyI)-2-butylindolizine-7-carboxylique sous forme d'une poudre
amorphe
utilisée telle quelle à l'étape suivante.
Rendement = 34 %
12.5 444-({2-buty1-7-[(2-méthoxy-2-oxoéthyl)(propan-2-y1)carbamoyl]indolizin-3-
yll
carbonyl)phényl]pipéridine-1-carboxylate de tert-butyle
Hormis l'étape de salification, on procède de la même façon qu'à l'exemple
2.2. Ainsi,
à partir de 2,29 g (4,54 mmoles) d'acide 3-({441-(tert-
butoxycarbonyl)pipéridin-4-
yl]phényl}carbony1)-2-butylindolizine-7-carboxylique, de 0,84 g (5,0 mmoles)
de
chlorhydrate de N-propan-2-ylglycinate de méthyle, de 1,76 g (13,63 mmoles) de
Dl EA
et de 2,19 g (6,81 mmoles) de TBTU dans 22 mL de DOM, on obtient 1,99 g de 444-
({2-buty1-7-[(2-méthoxy-2-oxoéthyl)(propan-2-y1)carbamoyl]indolizin-3-
y1}carbonyl)
phényl]pipéridine-1-carboxylate de tert-butyle sous forme d'une mousse
blanche.
Rendement = 67 %
12.6 Chlorhydrate de méthyl N-R2-buty1-3-{1-4-(cligéridin-4-
yl)rhényllcarbonyl}indolizin
-7-yl)carbonyll-N-progan-2-ylcilycinate
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
43
A une solution de 1,99 g (3,22 mmoles) de 444-({2-buty1-7-[(2-méthoxy-2-
oxoéthyl)
(propan-2-yl)carbamoyl]indolizin-3-yl}carbonyl)phényl]pipéridine-1-carboxylate
de tert-
butyle dans 7 mL de DOM, on ajoute 3 mL d'une solution 4N de chlorure
d'hydrogène
dans le dioxane. Après 8 h d'agitation à TA, le mélange réactionnel est
concentré sous
pression réduite, le résidu obtenu est trituré dans de Et20, filtré puis
concentré sous
pression réduite. On obtient ainsi 1,4 g de chlorhydrate de méthyl N-[(2-buty1-
3-{[4-
(pipéridin-4-y1) phényl]carbonyl}indolizin-7-yl)carbony1]-N-propan-2-
ylglycinate.
Rendement = 79 %
F( C) : 123
LC/MS : M = 031H39N304 = 517; M+H = 518 ; Tr = 0,99 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,50 (d, 1H) ; 8,90-8,70 (m, 2H) ; 7,65 (s, 1H) ; 7,60 (d, 2H) ; 7,40 (d, 1H)
; 6,90 (d, 1H)
; 6,65 (s, 1H) ; 4,10 (s, 2H) ; 4,10-3,95 (m, 1H) ; 3,70 (s, 3H) ; 3,45-3,35
(m, 2H) ; 3,10-
2,90 (m, 3H) ; 2,25-2,15 (m, 2H) ; 2,05-1,80 (m, 4H) ; 1,40-1,25 (m, 2H) ;
1,25-1,10 (m,
6H) ; 1,10-0,90 (m, 2H) ; 0,65 (t, 3H).
Exemple 13: composé n 13: Chlorhydrate de 4-{[2-buty1-3-({4[3-(dibutylamino)
propyllphényl}carbonyl)indolizin-7-yllcarbonyl}pipérazin-2-one
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 1,0 g (2,04
mmoles) d'acide 3-({441-(tert-butoxycarbonyl)pipéridin-4-
yl]phényl}carbony1)-2-
butylindolizine-7-carboxylique, de 0,25 g (2,45 mmoles) de pipérazin-2-one, de
0,66 g
(5,1 mmoles) de DIEA et de 0,98 g (3,06 mmoles) de TBTU dans 10 mL de DOM, on
obtient, après une purification sur une colonne de silice en éluant avec un
gradient
Me0H/DCM de 0 à 10% en Me0H suivie d'une étape de salification, 0,88 g de
chlorhydrate de 4-{[2-buty1-3-({443-
(dibutylamino)propyl]phényl}carbonyl)indolizin-7-
yl]carbonyl}pipérazin-2-one sous forme d'un solide jaune.
Rendement = 75 %
F( C) : 162
LC/MS : M = 0351-148N403 = 572; M+H = 573 ; Tr = 1,01 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,50-9,35 (m, 2H) ; 8,15 (s, 1H) ; 7,80 (s, 1H) ; 7,60 (d, 2H) ; 7,45 (d, 2H)
; 7,00 (d, 1H)
; 6,70 (s, 1H) ; 4,10 (s, 2H) ; 3,80-3,60 (m, 2H) ; 3,15-3,00 (m, 6H) ; 2,80-
2,70 (t, 2H) ;
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
44
2,30-2,20 (t, 2H) ; 2,05-1,90 (m, 2H) ; 1,70-1,55 (m, 4H) ; 1,50-1,25 (m, 6H)
; 1,10-1,00
(m, 2H) ; 0,95 (t, 6H) ; 0,65 (t, 3H).
Exemple 14: composé n 14: Chlorydrate N-{[3-({4[4-(cyclopentylamino)butyl]
phényl}carbony1)-2-éthyli ndol izi n-7-yllcarbony1)-N-propan-2 -ylglyci nate
de
méthyle
14.1 3-{[4-
(4-chlorobutyl)phényl]carbony1}-2-éthylindolizine-7-carboxylate de propan-
2-yle
Excepté l'addition de DIEA, on procède de la même façon qu'à l'exemple 1.4.
Ainsi, à
partir de 4,7 g (20,32 mmoles) de 2-éthylindolizine-7-carboxylate de propan-2-
yle, de
5,1 g (20,92 mmoles) de chlorure de 4-(4-chlorobutyl)benzoyle et de 2,63 g
(20,32
mmoles) de DIEA dans 20mL de THF anh., on obtient 6,15 g de 3-{[4-(4-
chlorobutyl)phényl]carbony1}-2-éthylindolizine-7-carboxylate de propan-2-yle
sous
forme d'une gomme orangée
Rendement = 71 %
14.2 3-({4-14-(cyclopentylamino)butyllphényl}carbony1)-2-éthylindolizine-7-
carboxylate de propan-2-yle
On procède de la même façon qu'à l'exemple 8.4. Ainsi, à partir de 6,15 g
(14,11
mmoles) de 3-{[4-(4-chlorobutyl)phényl]carbony1}-2-éthylindolizine-7-
carboxylate de
propan-2-yle, de 4,92 g (57,75 mmoles) de cyclopentylamine et de 2,52 g (15,16
mmoles) de KI dans 35 mL de CH3CN, on obtient 6,66 g de 3-({4-[4-
(cyclopentylamino)butyl]phényl}carbony1)-2-éthylindolizine-7-carboxylate de
propan-2-
yle sous forme d'une poudre jaune.
Rendement = 97 %
14.3 3-[(4-{4-Rtert-butoxycarbonyl)(cyclopentypaminolbutyllphényl)carbony11-2-
éthylindolizine-7-carboxylate de propan-2-yle
Un mélange de 6 ,66 g ((14,03 mmoles) de 3-({4[4-(cyclopentylamino)butyl]
phényl}carbonyI)-2-éthylindolizine-7-carboxylate de propan-2-yle, de 3,67 g
(16,84
mmoles) de Boc20 et de 1,42 g (14,03 mmoles) de TEA dans 60 mL de DOM est
agité
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
18 h à TA Le mélange est ensuite lavé successivement avec 50 mL d'eau et 50 mL
de
saumure, séché sur Na2SO4, filtré puis concentré sous pression réduite. L e
résidu
obtenu est purifié par chromatographie sur une colonne de silice en éluant
avec un
mélange AcOEt / cyclohexane de 0 à 30 % en AcOEt. Après concentration sous
pression réduite, on obtient 7,15 g de 3-[(4-{4-[(tert-
butoxycarbonyl)(cyclopentyl)
amino]butyl}phényl)carbony1]-2-éthylindolizine-7-carboxylate de propan-2-yle
sous
forme d'une huile orangée.
Rendement = 89 %
14.4 Acide 3-[(4-{4-Rtert-
butoxycarbonyl)(cyclopentypamino]butyllphényl)carbony1]-
2-éthylindolizine-7-carboxylique
On procède de la même façon qu'à l'exemple 8.5. Ainsi, à partir de 7,15 g
(12,44
mmoles) de 3-[(4-{4-Rtert-
butoxycarbonyl)(cyclopentypamino]butyl}phényl)carbonyl]-2-
éthylindolizine-7-carboxylate de propan-2-yle, on obtient 6,016 g d'acide 3-
[(4-{4-Rtert-
butoxycarbonyl)(cyclopentyl)amino]butyl}phényl)carbonyl]-2-éthylindolizine-7-
carboxylique sous forme d'une poudre jaune.
Rendement = 91 %
14.5 N-({3-[(4-{4-Rtert-
butoxycarbonyl)(cyclopentypamino]butyllphényl)carbonyl]-2-
éthylindolizin-7-yllcarbonyl)-N-propan-2-ylglycinate de méthyle
On procède de la même façon qu'à l'exemple 8.6. Ainsi, à partir de 1,1 g (2,07
moles)
d'acide 3-[(4-{4-[(tert-butoxycarbonyl) (cyclopentyl)amino] butyl}phényl)
carbonyI]-2-
éthylindolizine-7-carboxylique, de 0,52 g (3,10 mmoles) de chlorhydrate de N-
propan-
2-y1 glycinate de méthyle, de 0,80 g (6,20 mmoles) de Dl EA et de 0,99 g (3,10
mmoles)
de TBTU, on obtient 1,3 g de N-({3-[(4-{4-Rtert-
butoxycarbonyl)(cyclopentypamino]
butyl} phényl)carbonyI]-2-éthylindolizin-7-yl}carbony1)-N-propan-2-
ylglycinate de
méthyle sous forme d'une gomme jaune.
Rendement = 97 %
14.6 Ch loryd rate N-{1-3-({444-(cyclopentylami no)butyllphényl}carbonyI)-2-
éthylindolizin-7-yllcarbonyI}-N-oropan-2-ylolycinate de méthyle
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
46
On procède de la même façon qu'à l'exemple 8.7. Ainsi, à partir de 1,3 g (2,01
mmoles) de N-({3- [(4-{4- [(tert-butoxycarbonyl) (cyclopentyl)amino] butyl}
phényl)
carbonyI]-2-éthylindolizin-7-yl}carbony1)-N-propan-2-ylglycinate de méthyle,
on obtient
1,03 g de chloryd rate de N-{[3-({4-[4-(cyclopentylamino)
butyl]phényl}carbony1)-2-
éthylindolizin-7-yl]carbony1}-N-propan-2-ylglycinate de méthyle sous forme de
meringue jaune.
Rendement = 88 %
F( C) : 154
LC/MS : M = C33H43N304 = 545; M+H = 545; Tr = 1,13 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,45-9,35 (m, 1H) ; 8,75-8,60 (m, 2H) ; 7,65 (s, 1H) ; 7,55 (d, 2H) ; 7,40 (d,
2H) ; 6,90
(d, 1H) ; 6,70 (s, 1H) ; 4,10 (s, 2H) ; 4,10-3,95 (m, 1H) ; 3,70 (s 3H) ; 3,50-
3,35 (m, 1H)
; 2,95-2,85 (t, 2H) ; 2,75-2,65 (t, 2H) ; 2,30-2,20 (m, 2H) ; 2,00-1,85 (m,
2H) ; 1,70-1,45
(m, 10H) ; 1,15 (d, 6H) ; 1,05 (t, 3H).
Exemple 15: composé n 15: Chlorhydrate de N-{[3-({443-(1-aminocyclopentyl)
propyllphényl}carbony1)-2-éthyl indol izin-7-yllcarbony1)-N-propan-2-ylglyci
nate
de méthyle
15.1 1-(prop-2-yn-1-yl)cyclopentanecarboxylate de benzyle
A une solution de 8,30 mL (58,75 mmoles) de DIPA dans 100 mL de THF anh, on
ajoute goutte à goutte, à -40 C sous argon, 36,72 mL (58,75 mmoles) d'une
solution
1,6 M de n-BuLi dans le n-hexane et 34,07 mL de HMPA. Après 15 min d'agitation
à -
40 C, le mélange réactionnel est refroidi à -78 C puis on ajoute goutte à
goutte une
solution de 10,0 g (48,96 mmoles) de cyclopentanecarboxylate de benzyle. Après
15
min d'agitation à -78 C, on ajoute goutte à goutte 21,81 mL (195,82 mmoles)
d'une
solution à 80% w/v de bromure de propargyle dans le toluène. On laisse ensuite
revenir lentement à TA et après 1 h, le mélange réactionnel est traité avec
200 mL
d'une solution aqueuse saturée de chlorure d'ammonium puis extrait avec 2x200
mL
d'AcOEt. Les phases organiques sont rassemblées, lavées avec 100 mL de
saumure,
séchées sur MgSO4, filtrées puis concentrées sous pression réduite. Le résidu
obtenu
est purifié par chromatographie sur une colonne de silice en éluant avec un
gradient
AcOEt/cyclohexane de 0 à 30% en AcOEt. Après concentration sous pression
réduite,
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
47
on obtient 9,1 g de 1-(prop-2-yn-1-yl)cyclopentanecarboxylate de benzyle sous
forme
d'une huile orangée.
Rendement = 77 %
15.2 2-éthy1-3[(4-iodophényl)carbonyllindolizine-7-carboxylate de propan-2-yle
On procède de la même façon qu'à l'exemple 14.1. Ainsi, à partir de 22,0 g
(95,12
mmoles) de 2-éthylindolizine-7-carboxylate de propan-2-yle, de 25,35 g (95,12
mmoles) de chlorure de 4-iodo-benzoyle et de 12,30 g (95,12 mmoles) de DIEA
dans
100mL de THF, on obtient 34,3 g de 2-éthy1-3-[(4-
iodophényl)carbonyl]indolizine-7-
carboxylate de propan-2-yle sous forme d'un solide jaune.
Rendement = 78 %
15.3 3-{[4-(3-{1-[(benzyloxy)carbonyl]cyclopentyllprop-1-yn-1-
y1)phényl]carbony11-2-
éthylindolizine-7-carboxylate de propan-2-yle
Un mélange de 12 ,60 g (27,31 mmoles) de 2-
éthy1-3-[(4-iodophényl)
carbonyl]indolizine-7-carboxylate de propan-2-yle, 9,93 g (40,97 mmoles) de 1-
(prop-2-
yn-1-yl)cyclopentanecarboxylate de benzyle, de 3,53 g (27,31 mmoles) de DIEA
et
0,31 g (1,64 mmoles) de Cul dans 54 mL de CH3CN est agité 15 min à TA sous
argon
puis on ajoute 0,77 g (1,09 mmoles) de PdC12 (PPh3) et ensuite on chauffe le
mélange
réactionnel 5 h à 50 C. A TA, le mélange est repris par 300 mL d'AcOEt, lavé
successivement avec 2 x 100 mL d'eau et 100 mL de saumure, séché sur MgSO4,
filtré
puis concentré sous pression réduite. Le résidu obtenu est purifié par
chromatographie
sur une colonne de silice en éluant avec un gradient AcOEt/cyclohexane de 0 à
10 %
en AcOEt. Après concentration sous pression réduite, on obtient 10,5 g de 3-
{[4-(3-{1-
[(benzyloxy)carbonyl]cyclopentyl}prop-1-yn-1-yl)phényl]carbony1}-2-
éthylindolizine-7-
carboxylate de propan-2-yle sous forme d'une huile marron pure à environ 80 %
utilisée telle quelle à l'étape suivante.
Rendement = 54 % (corrigé)
15.4 Acide 1-{3-1-4-({2-éthy1-7-Rpropan-2-yloxy) carbonyll indolizin-3-y1}
carbonyl)
phényllpropyl}cyclopentanecarboxylique
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
48
Un mélange de 5,0 g (6,2 mmoles corrigé) de 3-{[4-(3-{1-[(benzyloxy)carbonyl]
cyclopentyl}prop-1-yn-1-yl)phényl]carbony1}-2-éthylindolizine-7-carboxylate de
propan-
2-yle, de 9,47 g (150 mmoles) de formiate d'ammonium et de 0,6 g de Pd-c 10%
dans
50 mL d'un mélange Me0H/dioxane 9 :1 est chauffé sous argon 9h à 90 C. Le
mélange réactionnel est ensuite concentré sous pression réduite, repris par
300 mL de
DOM, lavé successivement avec 2x100 mL d'eau et 100 mL de saumure, séché sur
MgSO4, filtré puis concentré sous pression réduite.Le résidu obtenu est
purifié par
chromatographie sur une colonne de silice en éluant avec un gradient Me0H/DCM
de
0 à 5% en Me0H. Après concentration sous pression réduite, on obtient 3 g
d'acide 1-
{344-({2-éthy1-7-[(propan-2-yloxy)carbonyl]indol izin-3-
yl}carbonyl)phényl]propyl}
cyclopentanecarboxylique sous forme d'un solide jaune.
Rendement = 70 %
15.5 3-{[4-(3-{1-[(tert-
butoxycarbonyl)amino]cyclopentyllpropyl)phényl]carbonyll-2-
éthylindolizine-7-carboxylate de propan-2-yle
A une solution de 5,36 g (10,95 mmoles) d'acide 1-{344-({2-éthy1-7-[(propan-2-
yloxy)
carbonyl]indolizin-3-yl}carbonyl)phényl]propyl}cyclopentanecarboxylique et de
2,22 g
(21,90 mmoles) de TEA dans du toluène, on ajoute goutte à goutte à TA 2,83 mL
(3,61
mmoles) de DPPA. Après 3h d'agitation à TA, le mélange réactionnel est repris
par
200 mL d'AcOEt, lavé successivement avec 2x 50 mL d'eau et 50 mL de saumure,
séché sur MgSO4, filtré puis concentré sous pression réduite. Dans un tube
scellé,
une solution du résidu obtenu et de 0,1 g (1 mmole) de CuCI dans 50 mL de t-
BuOH
anh. est chauffée 18h à 115 C. Le mélange réactionnel est concentré sous
pression
réduite puis purifié par chromatographie sur une colonne de sillice en éluant
avec un
gradient AcOEt/cyclohexane de 0 à 15% en AcOEt. Après concentration sous
pression réduite, on obtient 4,0 g de 3-{[4-(3-{1-[(tert-butoxycarbonyl)amino]
cyclopentyl}propyl)phényl]carbony1}-2-éhylindolizine-7-carboxylate de propan-2-
yle
sous forme d'une huile jaune.
Rendement = 65 %
15.6 Acid 3-{14-(3-{1-Rtert-
butoxycarbonyl)aminolcyclopentyl}propyl)phényllcarbonyl}
-2-éthylindolizine-7-carboxylici ue
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
49
On procède de la même façon qu'à l'exemple 8.5. Ainsi, à partir de 0,50 g (0.9
mmole)
de 3-([4-(3-{1-[(tert-butoxycarbonyl)amino] cyclopentyl)propyl)
phénylicarbony1}-2-
éhylindolizine -7-carboxyiate de propan-2-yle, on obtient 0,48 g d'acide
34[44341-
Rter1-butoxycarbonyl)am inolcyclopentyl)propyl)phénylicarbohyl)-2-éthylind ol
izi ne-7-
carboxylique sous forme d'une meringue jaune.
Rendement = 100 %
15.7 N-[(3-414-(341-Eftert-
butoxvcarbonvflaminolcvclopentvIloropephénylicarbone-
2-éthviindolizin-7-yncarbonv11-N-orooan-2-vlalvcinate de méthyle
On procède de la même façon qu'à l'exemple 8.6. Ainsi, à partir de 0,48 g
(0,94
m mole) d'acide 34[44341-[(te/1-buta xycarbonyna m ino]cyclopentyl)p ro
pyl)phé n yl]
carbonyI)-2-éthylindolizine-7-carboxylique, de chlorhydrate de N-propan-2-y1
glycinate
de méthyle, de 0,36 g (2,81 mmoles) de DIEA et de 0,45 g (1,40 mmoles) de
TBTU, on
obtient 0,43 g de N-[(34[4-(3-{1-Ktert-
butoxycarbonyl)aminoicyclopentyl}propyl)phényll
carbony1}-2-éthylindolizin-7-y1)carbonyli-N-propan-2-ylglycinate de méthyle
sous forme
d'une meringue jaune.
Rendement = 74 %.
15.8 Chlorhydrate de N-{13-(f443-(1-aminocyclooentvnoroovIlohénylIcarbonv1)-2-
éthvlindolizin-7-yllcarbonvII-N-orooan-2-v lalvcinate de méthyle
On procède de la même façon qu'à l'exemple 8.7.. Ainsi, à partir de 0,435 g
(0,69
moles) de N-[(34[4-
(3-{1-Rtert-
butoxycarbonyl)aminoicyclopentyl)propyl)phén ylicarbony1)-2-éthylindolizin-7-
yl)carbonyli-N-propan-2-yiglycinate de méthyle, on obtient 0,272 g de
chlorhydrate de
N-{[3-({443-(1-am inocyclopentyl) propyllphénylIcarbon yl) -2-
éthylindolizin-7-
ylicarbonyll-N-propan -2-ylglycinate de méthyle sous forme d'une poudre jaune.
Rendement = 69 %
F( C) : 176
LC/MS : M = C32H41 N304 = 531 ; M+H = 532 ; Tr = 1,13 min (conditions B)
RMN1H (ppm, d8-DMSO, 400 MHz) :
9,40 (d, 1H) ; 7,95-7,80 (m, 3H) ; 7,65 (s, 1H) ; 7,55 (d, 2H) ; 7,40 (d, 2H)
; 6,90 (d, 1H);
6,70 (s, 1H) ; 4,10 (s, 2H) ; 4,05-3,95 (m, 1H) ; 3,75 (s, 3H) ; 2,80-2,70 (t,
2H) ; 2,30-
2,20 (m, 2H) ; 1,80-1,50 (m, 12H) ; 1,15 (d, 6H) ; 1,00 (t, 3H).
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
Exemple 16 : composé n 16: Chlorhydrate de N-({2-éthy1-3-[(4-{3-[1-
(méthylamino)cyclopentyl]propyl}phényl)carbonyllindolizin-7-yl}carbony1)-N-
propan-2-ylglycinate de méthyle
16.1 Acide 3-{[4-(3-{1-Rtert-
butoxycarbonyl)(méthyl)amino]cyclopentyllpropyl)phényll
carbony1}-2-éthylindolizine-7-carboxylique
A une solution de 970 mg (1,73 mmoles) de 3-{[4-(3-{1-[(tert-butoxycarbonyl)
amino]cyclopentyl}propyl)phényl]carbony1}-2-éthylindolizine-7-carboxylate de
propan-2-
yle dans 5 mL de DMF anh., on ajoute par petites quantités, à TA sous argon,
140 mg
(3,43 mmoles) de NaH à 60% dans l'huile, Après 15 min, on ajoute goutte à
goutte à
TA 220 pl (3,43 mmoles) de iodométhane et on poursuit l'agitation 18 h. Le
mélange
réactionnel est ensuite traité avec 50 mL d'une solution aqueuse NH4CI sat,
puis extrait
avec 2x100 mL d'éther. Les phases organiques sont rassemblées, lavées
successivement avec 2x50 mL d'eau et 50 mL de saumure, séchées sur Na2SO4,
filtrées puis concentrées sous pression réduite. Le résidu obtenu est repris
par 10 mL
de dioxanne puis on ajoute goutte à goutte à TA, 4 mL d'une solution aqueuse
NaOH
1N. Après 18 h d'agitation, le mélange réactionnel est refroidi à 0 C puis
neutralisé
avec 4 mL d'une solution aqueuse HCI 1N et extrait avec 2x100 mL d'AcOEt. Les
phases organiques sont rassemblées, lavées successivement avec 2x50 mL d'eau
et
50 mL de saumure, séchées sur Na2SO4, filtrées puis concentrées sous pression
réduite. Le résidu obtenu est chromatographié sur une colonne de gel de silice
en
éluant avec un gradient DCM/Me0H de 0 à 20 % en Me0H. Après concentration sous
pression réduite, on obtient 733 mg d'acide 3-{[4-(3-{1-[(tert-butoxycarbonyl)
(méthyl)amino]cyclopentyl}propyl)phényl]carbony1}-2-éthylindolizine-7-
carboxylique
sous forme d'un solide orangé utilisé tel quel à l'étape suivante.
Rendement = 77%
16.2 N-[(3-{[4-(3-{1-Rtert-butoxycarbonyl)(méthyl)ami
no]cyclopentyllpropyl)phényll
carbony11-2-éthylindolizin-7-yl)carbonyl]-N-propan-2-ylglycinate de méthyle
Hormis l'étape de salification finale, on procède de la même façon qu'à
l'exemple 2.2.
Ainsi, à partir de 1,1 g ((2,08 mmoles) d'acide 3-{[4-(3-{1-[(tert-
butoxycarbonyl)
(méthyl)amino]cyclopentyl}propyl)phényl]carbony1}-2-éthylindolizine-7-
carboxylique et
de 0,7 g (4,17 mmoles) de chlorhydrate de méthyl N-propan-2-ylglycinate, on
obtient,
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
51
après une chromatographie sur une colonne de gel de silice en éluant avec un
gradient
cyclohexane/AcOEt de 0 à 50% en AcOEt, 1,07 g de N-[(3-([4-(3-(14(ferf-
butoxycarbonyl)(méthyl)aminolcyclopentyl}propyl)phényl]carbony1}-2-
éthylindolizin-7-y1)
carbonyfi-N-propan-2-ylglycinate de méthyle sous forme d'une meringue jaune.
Rendement =80%
16.3 Chlorhydrate de N-({2-éthyl-3- [(4-(341-(méthylamino) cyclopentv11
oroovli
ohèrwl) carbonyllindolizin-7-vlIcarbony1)-N-oropan-2-vIglycinate de méthyle
On procède de la même façon qu'à l'exemple 11.3.
Ainsi, à partir de 1,68 g (2,60 mmoles) de N-[(3-([4-(3-(1-Rfert-
butoxycarbonyl)(méthyl)
a m inolcyclopentyl}prop yl )ph ényljcarbonyI}-2-éthy I indolizin-7-
yl)carbony1]-N-propan-2-.
ylglycinate de méthyle, on obtient, après une chromatographie sur une colonne
de
phase Inverse RP18 en éluant avec un gradient CH3CN/H20 (HCI 0,01N) de 0 à 30%
en CH3CN de chlorhydrate de N-(12-éthy1-3-[(4-{341-(méthylamino)cyclopentyl]
propyl}phényl)carbonyllindolizin-7-earbony1)-N-propan-2-ylglycinate de méthyle
sous
forme d'une poudre jaune.
Rendement = 45%.
F( C) : 149.5
LC/IVIS M = C33H43N304 = 545 ; M+H = 546 ; Tr = 1,13 min (conditions B)
RMN1H (ppm, d8-DMSO, 400 MHz, T = 60 C)
9,40 (d, 1H) ; 8,70-8,60 (m, 2H) ; 7,65 (s, 1H) ; 7,55 (d, 2H) ; 7,40 (d, 2H)
; 6,85 (d, 1H);
6,70 (s, 1H) ; 4,15-4,05 (m, 3H) ; 3,70 (s, 3H) ; 2,75 (t, 2H) ; 2,50-2,40 (m,
3H) ; 2,30-
2,20 (m, 2H) ; 1,90-1,50 (m, 12H) ; 1,15 (d, 6H) ; 1,00 (t, 3H).
Exemple 17: composé n 17: Chlorhydrate de 3-({4[3-(tert-butylamino)propyll
phényl}carbony1)-N,2-diéthyl-N-[(2-méthyl-2H-tétrazol-5-yl)méthyllindolizine-7-
carboxamide
17.1 34(443-(terf-butylamino)oropyl1ohénylIcarbony1)-2-éthylindolizine-7-
carboxylate
de oropan-2-yle
Dans un tube scellé, un mélange de 2,35 g (5,7 mmoles) de 3-([4-(4-
chlorobutyl)
phényl]carbonyI)-2-éthylindolizine-7-carboxylate de propan-2-yle, de 2,4 mL
(22,8
mmoles) de tert-butylamine et de 0,99 g (5,9 mmoles) de KI dans 12 mL de CH3CN
est
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
52
chauffé 48 h. à 105 C. Le mélange réactionnel est repris par 100 mL d'AcOEt,
lavé
successivement par 2x30 mL d'eau et 30 mL de saumure, séché sur Na2SO4, filtré
puis
concentré sous pression réduite. Le résidu obtenu est concrétisé dans l'éther,
filtré et
lavé avec de l'éther. On obtient ainsi 3,53 g de 3-({4-[3-(tert-butylamino)
propyl]
phényl}carbonyI)-2-éthylindolizine-7-carboxylate de propan-2-yle sous forme
d'une
poudre jaune utilisée telle quelle à l'étape suivante.
Rendement = 70%
17.2 Acide 34{443- (tert-butylamino) propyll phényllcarbonyl) -2-
éthylindolizine-7-
carboxylique
A une solution de 3,53 g (7,9 mmoles) de 3-({4-[3-(tert-butylamino) propyl]
phényl}
carbonyI)-2-éthylindolizine-7-carboxylate de propan-2-yle dans 16 mL d'un
mélange
dioxanne/Me0H/THF 2:1:1, on ajoute goutte à goutte à TA 16 mL d'une solution
aqueuse NaOH 1N et l'agitation est poursuivie 18h. On refroidit le mélange à 0
C puis
on ajoute goutte à goutte 16 mL d'une solution aqueuse HCI 1N. Le précipité
ainsi
obtenu est ensuite filtré, lavé avec de l'eau puis séché sous pression
réduite. On
obtient ainsi 3,1 g d'acide 3-({443-(tert-butylamino)propyl]phényl}carbony1)-2-
éthylindolizine-7-carboxylique sous forme d'une poudre jaune utilisée telle
quelle à
l'étape suivante.
Rendement = 99%
17.3 Chlorhydrate de 3-({413-(tert-butylamino)propyl]phényllcarbony1)-N,2-
diéthyl-N-
1(2-méthy1-2H-tétrazol-5-yl)méthyl]indolizine-7-carboxamide
On procède de la même façon qu'à l'exemple 2.2. Ainsi, à partir de 0,8 g (1,97
mmoles) d'acide 3-({443-(tert-butylamino)propyl]phényl}carbony1)-2-
éthylindolizine-7-
carboxylique et de 0,36 g (2,56 mmoles) de chlorhydrate de N-[(2-méthy1-2H-
tétrazol-5-
yl)méthyl]éthanamine, on obtient après une chromatographie sur une colonne de
silice
en éluant avec un gradient DCM/Me0H de 0 à 10 % en Me0H, 0,9 g que l'on
reprend
par 5 mL de DCM puis on refroidit à 0 C, on ajoute 1,70 mL d'une solution 2N
de
chlorure d'hydrogène dans l'éther et on laisse revenir lentement à TA Le
précipité
obtenu est filtré, lavé avec de l'éther puis séché sous pression réduite. on
obtient ainsi
0,88 g de chlorhydrate de 3-({443-(tert-butylamino)propyl]phényl}carbony1)-N,2-
diéthyl-
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
53
N-[(2-méthy1-2H-tétrazol-5-yl)méthyl]indolizine-7-carboxamide sous forme d'une
poudre blanche.
Rendement = 84 %
F( C) : 175
LC/MS : M = C301-136N702 = 529; M+H = 530 ; Tr = 1,04 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,50 (d, 1H) ; 9,00-8,80 (m, 2H) ; 7,80-7,65 (m, 1H) ; 7,55 (d, 2H) ; 7,40 (d,
2H) ; 6,95-
6,85 (m, 1H); 6,70-6,60 (m, 1H) ; 4,95-4,80 (m, 2H) ; 4,35 (s, 3H) ; 3,50-3,35
(m, 2H) ;
2,95-2,70 (m, 4H) ; 2,30-2,15 (m, 2H) ; 2,10-1,95 (t, 2H) ; 1,25 (s, 9H) ;
1,20-0,95 (m,
6H).
Exemple 18: composé n 18: Chlorhydrate de 3-({443-(tert-butylamino)-3-
méthylbutyllphényl) carbony1)-N,2-diéthyl-N-[(2-méthy1-2H-tétrazol-5-
yl)méthyl]
indolizine-7-carboxamide
18.1 3-({413-(tert-butylamino)-3-méthylbut-1-yn-1-yl]phényllcarbony1)-2-
éthylindolizine-7-carboxylate de propan-2-yle
On procède de la même façon qu'à l'exemple 15.3. Ainsi, à partir de 2,2 g
(4,77
mmoles) de 2-éthy1-3-[(4-iodophényl)carbonyl]indolizine-7-carboxylate de
propan-2-yle
et de 1,27 mL (7,15 mmoles) de N-tert-buty1-2-méthylbut-3-yn-2-amine, on
obtient,
après une chromatographie sur colonne de silice en éluant avec un gradient
cyclohexane/AcOEt de 0 à 40% en AcOEt, 2,5 g de 3-({443-(tert-butylamino)-3-
méthylbut-1-yn-1-yl]phényl}carbony1)-2-éthylindolizine-7-carboxylate de propan-
2-yle
sous forme d'huile.
Rendement = 100 %
18.2 3-({443-(tert-butylamino)-3-méthylbutyllphényllcarbony1)-2-
éthylindolizine-7-
carboxylate de propan-2-yle
Un mélange de 2,5 g (5,29 mmoles) de 3-({4[3-(tert-butylamino)-3-méthylbut-1-
yn-1-yl]
phényl}carbonyI)-2-éthylindolizine-7-carboxylate de propan-2-yle et de 1,7 g
de Pd-c
10% dans 20 mL d'un mélange AcOEt/Et0H 1:1 est agité 1h sous 3 bars
d'hydrogène.
Le milieu réactionnel est ensuite filtré puis concentré sous pression réduite.
Le résidu
obtenu est chromatographié sur une colonne de silice en éluant avec un
gradient
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
54
cyclohexane/AcOEt de 0 à 40% en AcOEt. Après concentration sous pression
réduite,
on obtient 1,17 g de 3-({443-(tert-butylamino)-3-méthylbutyl]phénylIcarbony1)-
2-
éthylindolizine-7-carboxylate de propan-2-yle sous forme d'une gomme orangée.
Rendement = 46 %
18.3 Chlorhydrate de 3-(0-13-(ted-butylamino)-3-méthvlbutvIlPhénvl}carbony1)-
N,2-
diéthyl-N-U2-méthyl-2H-tétrazol-5-v1)méthvIlindolizine-7-carboxa m ide
En appliquant une séquence saponification-couplage peptidique comme décrit
dans les
exemples 17.2 et 17.4 respectivement, on obtient, à partir de 0,79 g (1,81
mmoles) de
34(443-(tert-butylamino)-3-méthylbutyllphényl}carbony1)-2-éthylindolizine-7-
carboxylate de propan-2-yle et après une trituration finale dans de l'éther,
0,52 g de
chlorhydrate de 3-({443-(tert-butylamino)-3-méthylbutyl]phénylIcarbony1)-N,2-
diéthyl-N-
[(2-méthyl-2H-tétrazol-5-y1)méthyl]indolizine-7-carboxamide sous forme d'une
poudre
verte.
Rendement = 48 %
F( C) : 122
LC/MS : M = C32H4.3N702 = 557 ; M-FH = 558; Tr = 1,05 min (conditions B)
RMN1H (ppm, de-DMSO, 400 MHz) :
9,45-9,30 (m, 1H) ; 8,3.0-8,10 (m, 2H) ; 7,80-7,65 (m, 1H) ; 7,55 (d, 2H) ;
7,40 (d, 2H) ;
7,00-6,85 (m, 1H); 7,65 (s, 1H) ; 5,00-4,80 (m, 2H) ; 4,35 (s, 3H) ; 3,60-3,30
(m, 2H) ;
2,80-2,70 (m, 2H) ; 2,25-2,15 (m, 2H) ; 2,15-2,05 (m, 2H) ; 1,55-1,40 (m, 15H)
; 1,20-
1,05 (m, 3H) ; 1,05-0,95 (m, 3H).
Exemple 19: composé n 19: Chlorhydrate de N-([34{443-(cyclopentylamino)-3-
méthylbutyl]phényl}carbony1)-2-éthylindolizin-7-yl]carbony1}-N-propan-2-
ylglycinate de méthyle
19.1 3-{F4-(3-amino-3-m éthvlbut-1-vn-1-eph én vlicarbonv1}-2-éthylindolizine-
7-
carboxvlate de propane-2-vie
=
On procède de la même façon qu'à l'exemple 15.3. Ainsi, à partir de. 6,0 g
(13,01
mmoles) de 2-éthy1-3-[(4-iodophényl)carbonyl]indolizine-7-carboxylate de
propan-2-yle
et de 1,68 mL (15,61 mmoles) de 2-méthylbut-3-yn-2-amine, on obtient après une
chromatographie sur une colonne de silice en éluant avec un gradient DCM/Me0H
de
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
0 à 10 % en Me0H, 5,15 g de 3-([4-(3-amino-3-méthylbut-1-yn-1-
yl)phényl]carbony1}-
2-éthylindolizine-7-carboxylate de propane-2-yle sous forme d'un Éolide jaune.
Rendement = 95,%
19.2 34(443-(cyclopentvlamino)-3-méthvlbut-1-vn-1-yllohénvIlcarbonv1)-2-
éthylindolizine-7-carbox ylate de propane-2-vie
Une solution de 5,15 g (12,36 mmoles) de 34[4-(3-amino-3-méthylbut-1-yn-1-y1)
phényl]carbonyI}-2-éthylindolizine-7-carboxylate de propane-2-yle et de 2,19
mL (24,7
mmoles) de cyclopentanone dans 25 mL de DCE est agitée 2 h à TA puis on ajoute
successivement 0,71 mL (12,36 mmoles) d'AcOH et 3,14 g (14,84 mmoles) de
NaBI-1(0Ac)3. Après 24 h d'agitation à TA, le mélange réactionnel est traité
avec 20 mL
d'une solution aqueuse NaHCO3 saturée puis extrait avec 2x50mL d'AcOEt. Les
phases organiques sont rassemblées, séchées sur Na2SO4, filtrées puis
concentrées
sous pression réduite. Le résidu obtenu est.chromatographié sur une colonne de
silice
en éluant avec un gradient DCM/Me0H de 0 à 5 % en Me0H. Après concentration
sous pression réduite, on obtient 5,99 g de 3-({443-(cyclopentylamino)-3-
méthylbut-1-
yn-1-yl]phényl}carbony1)-2-éthylindolizine-7-carboxylate de propane-2-yle sous
forme
d'un solide marron-vert utilisé tel quel à l'étape suivante.
Rendement = 100 %
19.3 Chlorhydrate de N-{(3-(f443-(cycloventvlamino)-3-
méthvlbutvIlohénvi}carbonv1)-
2-éthvlindol izin-7-vI1carbonvII-N-procia n-2-vlolvcinate de méthyle
En appliquant une séquence réduction-saponification-couplage peptidique, comme
décrit dans les exemples 18.3, 17.2 et 8.6 respectivement, on obtient, à
partir de 1.60g
(3.58mmoles) de 34(443-(cyclopentylamino)-3-méthylbut-1-yn-1-
yllphénylIcarbony1)-2-
éthylindolizine-7-carboxylate de propane-2-yle, 1.58g de chlorhydrate de N-{[3-
({443-
(cyclopentylamino) -3-méthylbutyl] phényl}carbony1)-2-éthylindolizin-7-yll
carbonyI}-N-
propan-2-ylglycinate de méthyle sous forme d'une poudre jaune.
Rendement = 79%
F( C) : 245
LC/MS : M = C34H45N304 = 559; M+H = 560 ; Tr = 1,18 min (conditions B)
RMNIH (ppm, de-DMSO, 400 MHz) :
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
56
9,50-9,35 (m, 1H) ; 8,60-8,40 (m, 2H) ; 7,65 (s, 1H) ; 7,60 (d, 2H) ; 7,40 (d,
2H) ; 6,90
(d, 1H); 6,70 (s, 1H) ; 4,15 (s, 2H) ; 4,10-4,00 (m, 1H) ; 3,80-3,60 (m, 4H) ;
2,80-2,70
(m, 2H) ; 2,30-2,20 (m, 2H) ; 2,10-1,90 (m, 4H) ; 1,80-1,70 (m, 4H) ; 1,70-
1,50 (m, 2H) ;
1,40 (s, 6H) ; 1,10 (d, 6H) ; 1,00 (t, 3H).
Exemple 20: composé n 20: Chlorhydrate de (R,S) N,2-diéthy1-3-({443-
(éthylamino)-4-méthylpentyllphényl}carbony1)-N-[(2-méthyl-2H-tétrazol-5-y1)
méthyl]indolizine-7-carboxamide
20.1 3-{[4-(chlorométhyl)phényl]carbony1}-2-éthylindolizine-7-carboxylate
de propane
-2-yle
A une solution de 8,66 g (37,43 mmoles) de propan-2-yle 2-éthylindolizine-7-
carboxylate de propan-2-yle, de 8,69 mL (74,86 mmoles) de lutidine et de 0,61
mL
(7,49 mmoles) de pyridine dans 75 mL de chlorobenzène, on ajoute 10,61 g
(56,14
mmoles) de chlorure de 4-(chlorométhyl)benzoyle puis on chauffe 2h à reflux.
Le
mélange réactionnel est ensuite repris par 300 mL d'AcOEt, lavé successivement
avec
2 x 150 mL d'eau et 150 mL de saumure, séché sur Na2SO4, filtré puis concentré
sous
pression réduite. Le résidu obtenu est chromatographié sur une colonne de gel
de
silice en éluant avec un gradient cyclohexane/AcOEt de 0 à 10 % en AcOEt.
Après
concentration sous pression réduite, on obtient 10,44 g de 3-{[4-
(chlorométhyl)phényl]
carbonyI}-2-éthylindolizine-7-carboxylate de propane-2-yle sous forme d'un
solide
jaune.
Rendement = 72 %
20.2 3-({4-Rdiéthoxyphosphoryl)méthyllphényllcarbony1)-2-éthylindolizine-7-
carboxylate de propan-2-yle
Un mélange de 15,0 g (39,08 mmoles) de 3-{[4-(chlorométhyl)phényl]carbony1}-2-
éthylindolizine-7-carboxylate de propane-2-yle et de 26.80 mL de triéthyl
phosphite est
chauffé 3 h à reflux. L'excès de triéthyl phosphite est évaporé sous pression
réduite. Le
résidu obtenu est repris par 500 mL d'AcOEt, lavé successivement avec 2x200 mL
d'eau et 100 mL de saumure, séché sur Na2SO4, filtré puis concentré sous
pression
réduite. Le résidu obtenu est chromatographié sur une colonne de silice en
éluant avec
un gradient cyclohexane/ AcOEt, de 0 à 100 %. Après concentration sous
pression
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
57
réduite, on obtient 12,8 g de 3-({4-
[(diéthoxyphosphoryl)méthyl]phényl}carbony1)-2-
éthylindolizine-7-carboxylate de propan-2-yle sous forme d'une huile marron
utilisée
telle quelle à l'étape suivante.
Rendement = 68%
20.3 N2-(tert-butoxycarbonyI)-N2-éthyl-N-méthoxy-N-méthyl-D,L-valinamide
A une solution de 7,18 g (27,58 mmoles) de N2-(tert-butoxycarbonyI)-N-méthoxy-
N-
méthyl-D,L-valinamide dans 92 mL de NMP anh., on ajoute par petites quantités
à 0 C,
sous argon, 1,66 g (41,37 mmoles) de NaH à 60 % dans de l'huile. Après 15 min
à
0 C, on ajoute goutte à goutte 4,41 mL (55,16 mmoles) de iodoéthane puis on
laisse
revenir lentement à TA et l'agitation est poursuivie 18h. Le résidu obtenu est
chromatographié sur une colonne de silice en éluant avec un gradient
cyclohexane/
AcOEt de 0 à 40 % en AcOEt. Après concentration sous pression réduite, on
obtient
6,25 g de N2-(tert-butoxycarbonyI)-N2-éthyl-N-méthoxy-N-méthyl-D,L-valinamide
sous
forme d'une huile incolore.
Rendement = 79 %
20.4 (R,S)-Ethyl[3-méthy1-1-oxobutan-2-yl]carbamate de tert-butyle
A une solution de 1,0 g (3,47 mmoles) de N2-(tert-butoxycarbonyI)-N2-éthyl-N-
méthoxy-
N-méthyl-D,L-valinamide dans 11 mL de THF anh., on ajoute goutte à goutte,
sous
argon, à -78 C, 3,64 mL (3,64 mmoles) d'une solution de LiAIH4 1N dans le THF.
Après 10 min d'agitation, le mélange réctionnel est agité 10 min à 0 C, dilué
avec 40
mL d'éther, traité successivement avec ¨2g de chlorure d'ammonium ajoutés par
petites quantités et de l'eau additionnée goutte à goutte jusqu'à l'obtention
de 2 phases
liquides. Le surnageant est ensuite prélevé, lavé successivement avec 20 mL
d'une
solution aqueuse HCI 1N et 20 mL de saumure, séché sur Na2SO4, filtré puis
concentré
sous pression réduite. Après concentration sous pression réduite, on obtient
1,17 g de
(R,S) éthyl[3-méthy1-1-oxobutan-2-yl]carbamate de tert-butyle sous forme d'une
huile
incolore utilisée telle quelle à l'étape suivante.
Rendement = 100%
20.5 (R,S) 34(4-W E)-3-Rtert-butoxycarbonyl) (éthyl)aminol -4-méthylpent-1-en-
1-y1}
phényl)carbony11-2-éthylindolizine-7-carboxylate de propan-2-yle
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
58
A une solution de 1,7 g (3,50 mmoles) de 3-({4-[(diéthoxyphosphoryl)méthyl]
phényl}
carbonyI)-2-éthylindolizine-7-carboxylate de propan-2-yle dans 10 mL de THF
anh., on
ajoute par petites quantités, sous argon, à 0 C, 0,15 g (3,64 mmoles) de NaH à
50% dans de l'huile. Après 30 min à 0 C, le mélange réactionnel est refroidi à
-78 C
puis on ajoute goutte à goutte une solution de 1,17 g (3,47 mmoles) de (R,S)
tert-butyl
éthyl[3-méthy1-1-oxobutan-2-yl]carbamate dans 5 mL de THF anh. On laisse
revenir
lentement à TA et l'agitation est poursuivie 18h. Le mélange réactionnel est
ensuite à
nouveau refroidi à 0 C, traité avec 30 mL d'une solution aqueuse NH4CI saturée
puis
extrait avec 3x70 mL d'AcOEt. Les phases organiques sont rassemblées, lavées
successivement avec 50 mL d'une solution aqueuse HCI 1N, 50 mL d'eau et 50 mL
de
saumure, séchées sur Na2SO4, filtrées puis concentrées sous pression réduite.
Le
résidu obtenu est chromatographié sur une colonne de silice en éluant avec un
gradient cyclohexane/AcOEt de 0 à 30 % en AcOEt puis avec un gradient DCM/Me0H
de 0 à 10% en Me0H. Après concentration sous pression réduite, on obtient 1,32
g de
(R,S) 3-[(4-{(1E)-3-Rtert-butoxycarbonyl)(éthyl)amino]-4-méthylpent-1-en-1-
yl}phényl)
carbonyI]-2-éthylindolizine-7-carboxylate de propan-2-yle sous forme d'une
gomme
orangée.
Rendement = 68%
20.6 (R,S) Acide 3-[(4-{(1E)-3-Rtert-butoxycarbonyl)(éthyl)amino]-4-méthylpent-
1-en-
1-yllphényl)carbony1]-2-éthylindolizine-7-carboxylique
A une solution de 1,98 g (3,53 mmoles) de (R,S) 3-[(4-{(1E)-3-[(tert-
butoxycarbonyl)
(éthyl)amino]-4-méthylpent-1-en-1-yl}phényl)carbony1]-2-éthylindolizine -7-
carboxylate
de propan-2-yle dans 22 mL d'un mélange THF/Me0H 10:1, on ajoute goutte à
goutte
à 0 C, 7,1 mL (7,1 mmoles) d'une solution aqueuse NaOH 1N puis on laisse
revenir
lentement à TA Après 18h d'agitation, le mélange réactionnel est refroidi à 0
C,
neutralisé avec 7,1 mL d'une solution HCI 1N et extrait avec 3x70 mL d'un
mélange
DCM/iPrOH 95 :5. Les phases organiques sont rassemblées, lavées avec 50 mL de
saumure, séchées sur Na2SO4, filtrées puis concentrées sous pression réduite.
On
obtient ainsi 2,19 g de (R,S) acide 3-[(4-{(1E)-3-Rtert-
butoxycarbonyl)(éthyl)amino]-4-
méthylpent-1-en-1-yl}phényl)carbony1]-2-éthylindolizine-7-carboxylique sous
forme
d'une poudre jaune utilisée telle quelle à l'étape suivante.
Rendement = 94 %
CA 02818279 2013-05-16
WO 2012/066234
PCT/FR2011/052661
59
20.7 (R,S) Ethy11(1 E)-1-(44(2-éthy1-74ét hylf (2-m éthy1-2H-tétrazol-5-y1)m
éthvil
carbamovnindolizin-3-v1)carbonyllphényll-4-méthyloent-1-en-3-yllcarbamate de
tert-
butyle,
On procède de la même façon qu'à l'exemple 2.2. Ainsi à partir de 1,25 g (2,41
mmoles) de (R,S) acide 3-[(4-{(1E)-3-Rtert-butoxycarbonyl)(éthyl)aminol-4-
méthylpent-
1-en-1-yllphényl)carbony11-2-éthylindolizine-7-carboxylique et de 0,47 g (2,65
mmoles)
de Chlorhydrate de N-[(2-méthy1-2H-tétrazol-5-yl)méthyl]éthanamine, on
obtient, après
une chromatographie sur colonne de silice en éluant avec un gradient
cyclohexane/AcOEt de 0 à 100 % d'AcOEt, 1,4 g de (R,S) éthyl[(1E)-1-{4-[(2-
éthyl-7- ,
{éthyl[(2-méthy1-2H-tétrazol-5-yl)méthyl]carbamoyl}indolizin-3-
Acarbonyllphény1)-4-
=
méthylpent-1-en-3-yl]carbamate de tert-butyle sous forme d'une meringue jaune.
Rendement = 91%
20.8 (R,S) Ethylf1-{44(2-éthy1-7-{éthyl f(2-méthyl-2H-tétrazol-5-vDméthyll
carbamovn
indolizin-3-v1)carbonyl1phény11-4-méthylpentan-3-yllcarbamate de tett-butyle
Un mélange de 1,4 g (2,19 mmoles) de (R,S) éthyl[(1E)-1-{4-[(2-éthyl-7-
{éthyl[(2-
méthyl-2H-tétrazol-5-Améthyllcarbamoyllindolizin-3-y1)carbonyl]phényl)-4-m
éthylpent-
1-en- 3-yl]carbamate de tert-butyle et de 0,14 g de Pd-C à 10% dans 30 mL de
Me0H
est agité 3h sous 5 bars d'hydrogène. Le mélange réactionnel est ensuite
filtré puis
concentré sous pression réduite. Le résidu obtenu est chromatographie sur une
colonne de silice en éluant avec un gradient DCM/Me0H de 0 à 10% en Me0H.
Après
concentration sous pression réduite, on obtient 1,12 g de (R,S) éthyl[1-{4-[(2-
éthyl-7-
{éthyl[(2-méthyl-2H-tetrazol-5-yl)méthyl]carbamoyllindolizin-3-
y1)carbonyllphény1)-4-
méthylpentan-3-ylicarbamate de tert-butyle sous forme d'une meringue jaune.
Rendement = 81%
20.9 Chlorhydrate de (R.S) N,2-diéthy1-3-({4-13-(éthylamino)-4-méthylcentyl1
phényl}carbony1)-N4 (2-méthy1-2H-tétrazol-5-v1)méthyllindolizine-7-carboxam
ide
On procède de la même façon qu'à l'exemple 8.7. Ainsi, à partir de 1,12 g
(1,78
mmoles) de (R,S) éthyl[144-[(2-éthyl-7- {éthyl[(2-méthyl-2H-tetrazol-5-y1)
méthyl]
carbamoyl) indolizin-3-yl)carbonyl]phény1)-4-méthylpentan-3-yearbamate de tert-
RECTIFIED SHEET (RULE 91) ISA/EP
=
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
butyle, on obtient 0,77 g de chlorhydrate de (R,S) N,2-diéthyI-3- ({4[3-
(éthylamino) -4-
méthylpentyl] phényllcarbony1)-N-[(2-méthyl-2H-tétrazol-5-
y1)méthyllindolizine-7-
carboxamide sous forme d'une poudre verdâtre.
Rendement = 93 %
F( C) :100
[ct.02o =
j +4.2 (c = 0,19; Me0H) =
LC/MS : M = C311-141N702 = 543; M+H = 544 ; Tr = 1,05 min (conditions B)
RMN1H (ppm, deDMSO, 400 MHz) :
9,45-9,35 (m, 1H) ; 8,80-8,60 (m, 1H) ;.8,30-8,10 (m, 1H) ; 7,80-7,70 (m, 1H)
; 7,55 (d,
2H) ; 7,45 (d, 2H) ; 7,00-6,90 (m, 1H) ; 6,75-6,85 (m, 1H) ; 5,00-4,80 (m, 2H)
; 4,40 (s,
3H) ; 3,50-3,35 (m, 2H) ; 3,15-2,75 (m, 5H) ; 2,30-2,15 (m, 2H) ; 2,15-2,00
(m, 1H) ;
2,00-1,80 (m, 2H) ; 1,35-0,80 (m, 15H).
Exemple 21: composé n 81: Chlorhydrate de N-{(2-buty1-3-({4-[(3R)-plpéridin-3-
yloxy]phényl}carbonyl)indolizin-7-ylicarbony1}-N-propan-2-ylg lyci nate de
méthyle
21.1 2-butv1-31U4-iodophényncarbonvnindolizine-7-carboxvlate de propane-2-yle
On procède de la même façon qu'à l'exemple 14.1. Ainsi, à partir de 30,0 g
(115,68
mmoles) de 2-butylindolizine-7-carboxylate de propane-2-yle et de 30,8 g
(115,68
mmoles) de chlorure de 4-iodo-benzoyle et de 14,84 g (114,82 mmoles) de DIEA,
on
Dbtient, après une chromatographie sur colonne de silice en éluant avec un
gradient
cyclohexane/AcOEt de 0 à 20% en AcOEt, 42 ,81 g de 2-buty1-3-[(4-iodophényl)
carbonyliindolizine-7-carboxylate de propane-2-yle sous forme d'un solide
jaune.
Rendement = 76%
21.2 3-1(4-{f(3R)-1-(tert-butoxycarbonvl)pipéridin-3-vI1oxylphényncarbonv11-2-
Dutylindolizine-7-carboxylate
Un mélange de 8,0 g (16,35 mmoles) de 2-buty1-3-[(4-
iodophényl)carbonendolizine-7-
mrboxylate de propane-2-yle, de 6,0 g (29,81 mmoles) de tert-butyl (3R)-3-
iydroxypipéridine-1-carboxylate, de 8,0 g (24,55 mmoles) de Cs2CO3, de 0,5 g
(2,77
-nmoles) de 1-10 phénanthroline et de 0,25 g (1,31 mmoles) de Cul dans 20 mL
de
oluène anh. est chauffé 18h à reflux sous argon. Le mélange réactionnel est
ensuite'
RECTIFIED SHEET (RULE 91) ISA/EP
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
61
repris par 200 mL d'AcOEt, lavé successivement avec 100 mL d'eau, et 50 mL de
saumure, séché sur Na2SO4, filtré puis concentré sous pression réduite. Le
résidu
obtenu est chromatographié sur une colonne de silice en éluant avec un
gradient
cyclohexane/AcOEt de 0 à 40 % en AcOEt. Après concentration sous pression
réduite,
on obtient 2,45 g de (3R)-1-(tert-butoxycarbonyl) pipéridin-3-y1 3-[(4-{[(3R)-
1-(tert-
butoxycarbonyl)pipéridin-3-yl]oxy}phényl)carbony1]-2-butylindolizine-7-
carboxylate sous
forme d'une poudre jaune.
Rendement = 21%
21.3 Acide 3-[(4-{[(3R)-1-(tert-butoxycarbonyl)pipéridin-3-
yl]oxylphényl)carbony1]-2-
butylindolizine-7-carboxylique
On procède de la même façon qu'a l'exemple 8.5. Ainsi, à partir de 2,54 g
(3,48
mmoles) de (3R)-1-(tert-butoxycarbonyl)
pipéridin-3-y1 3-[(4-{[(3R)-1-(tert-
butoxycarbonyl) pipéridin-3-yl]oxy}phényl)carbonyI]-2-butylindolizine-7-
carboxylate, on
obtient 0,65 g d'acide 3-[(4-{[(3R)-1-(tert-butoxycarbonyl)pipéridin-3-
yl]oxy}phényl)
carbonyI]-2-butylindolizine-7-carboxylique sous forme d'une meringue jaune.
Rendement = 36%
21.4 (3R)-314-({2-buty1-7-[(2-méthoxy-2-oxoéthyl)(propan-2-
y1)carbamoyl]indolizi n-3-
yllcarbonyl)phénoxy]pipéridine-1-carboxylate de tert-butyle
On procède de la même façon qu'a l'exemple 2.2. Ainsi, à partir de 0,65 g
(1,25
mmoles) d'acide 3-[(4-{[(3R)-1-(tert-butoxycarbonyl)pipéridin-3-
yl]oxy}phényl)carbony1]-
2-butylindolizine-7-carboxylique, de 0,31 g (1,87 mmoles) de chlorhydrate de
méthyl N-
propan-2-ylglycinate, de 0,48 g (3,75 mmoles) de DIEA et de 0 ,60 g (1,87
mmoles) de
TBTU, on obtient après une chromatographie sur colonne de silice avec un
gradient
DCM/Me0H de 0 à 10 % en Me0H 0,62 g de (3R)-344-({2-buty1-7-[(2-méthoxy-2-
oxoéthyl)(propan-2-y1)carbamoyl]indolizin-3-y1}carbonyl)phénoxy]pipéridine-1-
carboxylate de tert-butyle sous forme d'une gomme jaune.
Rendement = 78 %
21.5 Chlorhydrate de N-{12-buty1-3-({4[(3R)-pipéridin-3-yloxylohényl}carbonyl)
indolizin-7-yllcarbonyI}-N-oropan-2-ylolycinate de méthyle
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
62
On procède de la même façon qu'à l'exemple 8.7. Ainsi, à partir de 0,61 g
(0,97
mmoles) de tert-butyl (3R)-344-({2-buty1-7-[(2-méthoxy-2-oxoéthyl)(propan-2-
y1)
carbamoyl]indolizin-3-yl}carbonyl)phénoxy]pipéridine-1-carboxylate, on obtient
0,55 g
de chlorhydrate de N-{[2-buty1-3-({4-[(3R)-pipéridin-3-
yloxy]phényl}carbonyl)indolizin-7-
yl]carbony1}-N-propan-2-ylglycinate de méthyle sous forme d'une poudre jaune.
Rendement = 100 %
F( C) :141.5
[4,2 = -2.6 (c = 0,205; Me0H)
LC/MS : M = C31H36N306 = 533; M+H = 534 ; Tr = 1,09 min (conditions B)
RMN1H (ppm, d6-DMSO, 400 MHz) :
9,35-9,25 (m, 1H) ; 9,15-8,85 (m, 2H) ; 7,70-7,65 (m, 3H) ; 7,20 (d, 2H) ;
6,90-6,80 (m,
1H) ; 6,65 (s, 1H) ; 4,95-4,85 (m, 1H) ; 4,15 (s, 2H) ; 4,15-4,00 (m, 1H) ;
3,75-3,60 (m,
3H) ; 3,40-3,15 (m, 2H) ; 3,15-3,05 (m, 2H) ; 2,40-2,25 (m, 2H) ; 2,00-1,80
(m, 3H) ;
1,80-1,65 (m, 1H) ; 1,50-1,35 (m, 2H) ; 1,25-0,95 (m, 8H) ; 0,80 (t, 3H).
Le tableau qui suit illustre les structures chimiques et les propriétés
physiques de
quelques exemples de composés selon l'invention ;
0
TABLEAU 1
I.)
o
,-,
I.)
ô
o,
o,
I.)
TEMPS DE
Ce)
=P
RETENTION VALEUR POINT
N STRUCTURE NOM DU COMPOSE
LCUVMS,
DE FUSION ( C)
METHODE
Chiral
71" fµI
0 ¨
N / (S)-1-{2-Buty1-344-(3-dibutylamino-
propy1)-benzoyn- n
2 0 indolizine-7-carbonyll-pyrrolidine-2-
carboxylic acid 9 (A) gomme 0
---.. . methyl ester
co
H
(.,)
co
I\)
li)
IV
--(-13 Chiral
o
H
la
o I0
o
---- in
'---_, N / (R)-1-{2-Buty1-344-(3-dibutylamino-
propy1)-benzoyn I- H
3 indolizine-7-carbonyll-pyrrolidine-2-
carboxylic acid 9 (A) gomme (5)
0
methyl ester
-,
O
Cki
eld
n
. --- ¨ 2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn- 0=1'
4 ---... N / indolizine-7-carboxylic acid ethyl-(2-
methoxy-ethyl)- 9.6 (A) gomme
eD
L 0 amide
¨1--õ,
--,
ô
vi
---7-----'
I.)
--,
o
. .
1..
y ------
'---N.---------
0
I..
1..
-a-,
0 ----- --- ({2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
---,
indolizine-7-carbonyll-ethyl-amino)-acetic acid 9.3 (A)
gomme "
0
=P
methyl ester
N
0_ _o
--- 0
---
N----- ----
1,...., --, N /
6 0 ({2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
8.6 (A)
gomme c)
-õ,
111> indolizine-7-carbonyll-ethyl-amino)-
acetic acid 0
IV
CO
CS)
H
1.)
-.1
li:.
0 0
IV
0
H
0
I_
0
in
\I
7 o 3-({2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
1.09 (B)
gomme H
01
0 indolizine-7-carbonyll-ethyl-amino)-
propionic acid
N
I 0
o----f-r''' N ..---- ---
eld
e) N/
n
, ({344-(3-Cyclopentylamino-propy1)-
benzoy1]-2-ethyl-
8
* indolizine-7-carbonyll-isopropyl-amino)-
acetic acid 1.09 (B)
228
methyl ester
--,
N
ui
1..
c.,
c.,
CD
0
1J
N.....,õ(..." ".... N
,,,... ___ 0
I-,
\
NN 1õ,.., --_, N /
---
O
2-Buty1-344-(3-dibutylamino-propy1)-benzoy1F
9 0 indolizine-7-carboxylic acid ethyl-(2-
methy1-2H- 1.16 (B) gomme "
----\----1 . tetrazol-5-ylmethyl)-amide
=P
N
--lo-L
---- '= ----, N ,
0 1111 2-Buty1-344-(3-dibutylamino-propy1)-
benzoy1F n
indolizine-7-carboxylic acid ethyl-(3-methyl- 1.18 (B) gomme
0
N--__ \
'----\ [1,2,4]oxadiazol-5-ylmethyl)-amide
cs)
co
H
CO
IV
--I
tO
0
IV
0
,õõ, ____
H
l..J
N
I
\\N---- N N /
0
2-Buty1-344-(3-dibutylamino-propy1)-benzoy1F
in
I
11 0 indolizine-7-carboxylic acid ethyl-(1H-
tetrazol-5- 3.82 (A) gomme H
Ol
----- \ ----- \ II, ylmethyl)-amide
N
-----/---/
I 0
01..
0 N/
{[2-Buty1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
0.99 (B) 123 n
, - q
; . = 1- =
12
o Illee
N carbonylpsopropyl-aminol-acetic acid
methyl ester
--,
--,
ô
vi
I.)
--,
CD
0
1J
0
Oy---,
N ---...
---- --,
I.)
N_..J
'====.... N/ O
01
13 0 4-{2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
1.01 (B)
162
"
----\---\ . indolizine-7-carbonyll-piperazin-2-one
=P
N
-----7----/
0
A Ir_
N -"-. ---
0 .)......õ `-, N/
Ille ({344-(4-Cyclopentylamino-buty1)-
benzoy1]-2-ethyl-
14 0
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.13 (B) 154 n
o
methyl ester
1.)
co
cs)
H
N
op
IV
--I
t0
0
IV
0
H
0 X N/
I0
in
11/ [(3-{443-(1-Amino-cyclopenty1)-propylFbenzoy11-2-
I
15 0
ethyl-indolizine-7-carbony1)-isopropyl-aminoFacetic
1.13 (B) 176 H
6)
N acid methyl ester
O
0 N___1)
1
0 M. \
,-;
n
16 0 . [(2-Ethy1-3-{443-(1-methylamino-
cyclopenty1)-prope
benzoyll-indolizine-7-carbony1)-isopropyl-aminoF
1.13 (B) 149.5
0=1'
N
acetic acid methyl ester
--,
al
--,
ô
vi
I.)
--,
CD
0
I.)
N
,N
0
---- -----\
i¨,
N=N iss\
'..., N / 344-(3-tert-Butylamino-propy1)-benzoy1]-
2-ethyl- ô
17 0 indolizine-7-carboxylic acid ethyl-(2-
methy1-2H- 0.99 (B) 172 "
tetrazol-5-ylmethyl)-amide
=P
N
o
IsL
\N-N .,,,,j --, N
/ 344-(3-tert-Butylamino-3-methyl-buty1)-
benzoy1]-2- c)
18 . ethyl-indolizine-7-carboxylic acid
ethyl-(2-methy1-2H- 1,05 (B) 122
0
tetrazol-5-ylmethyl)-amide
1.)
co
N-7(
cs)
¨.1
H
CO
IV
--I
tO
I 0
IV
0
N ----"-
---- H
l..J
N/
I
0
({344-(3-Cyclopentylamino-3-methyl-buty1)-benzoy1]-
in
I
0
19
Ille 2-ethyl-indolizine-7-carbonyll-
isopropyl-amino)-acetic 1.18 (B)
245
acid methyl ester
H
01
N
Cr
0 Chiral
0 --
N / (N--.../
eld
S \ / 2-Ethy1-344-((S)-3-ethylamino-4-methyl-
penty1)- n
,-q
20 }..."-.- N
% I benzoyn-indolizine-7-carboxylic acid
ethyl-(2-methyl- 1.05 (B) 100 0=1'
N¨
\ 2H-tetrazol-5-ylmethyl)-amide
:
--,
.
ô
vi
I.)
--,
CD
0
1J
0
1J
"===... N /
O
lel 0 2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
21
indolizine-7-carboxylic acid benzyl-(2-methoxy-ethyl)- 1.33 (B)
gomme
"
-----\----\ . amide
=P
N
0
N----. ----
N /
2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
n
22 0 indolizine-7-carboxylic acid isopropyl-
(2-methoxy- 1.26 (B) gomme
-----\--1 .
0
ethyl)-amide
cs)
co
N
CO
H
CO
N
N
tO
N
0
0
H
=-=....õ_,,, 0,_)",... N
,õ. --- l..J
) --.., N /
I0
in
2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
I
23 0 indolizine-7-carboxylic acid ethyl-(2-
isopropoxy- 1.29 (B) gomme H(5)
----\----\ . ethyl)-amide
N
0
..",..õ...-- '-----==.../..., N
../ ..-- eld
N/
n
2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
0=1'
24 0 indolizine-7-carboxylic acid (2-ethoxy-
ethyl)- 1.32 (B) gomme
-----\----1 11, isopropyl-amide
--,
--,
N
O
1J
0
0
I¨,
CD
0
N
, C>-----------N ..---
_-- 0
I¨,
F N ./.
N
F
O
F
0 lii 2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
indolizine-7-carboxylic acid (2-methoxy-ethyl)-(2,2,2- 5.67 (A)
gomme
"
=P
trifluoro-ethyl)-amide
------\
0
0 )
({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
n
26 0 indolizine-7-carbonyll-ethyl-amino)-
acetic acid ethyl 1.22 (B) gomme
-----\---\ 1111 ester
cs)
0
N
CO
H
N
CD CO
--I
tO
0
IV
0
H
N---... -----
l..J
I
0 ) ,-.., N/
0
in
({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
I
27 0 indolizine-7-carbonyll-ethyl-amino)-
acetic acid 1.27 (B) gomme H
Ol
----- \---- \ * isopropyl ester
N
0
(:)I=rN ----
eld
0 ..õ..-1....õ ',.., N/
({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
n
, - q
; . = 1- =
28 0 indolizine-7-carbonyll-isopropyl-amino)-
acetic acid 1.22 (B) gomme
----\---1 . methyl ester
--,
--,
N
O
---X---/
fil
1J
01
01
I¨,
0
0
1J
0
1J
0 \ N /
O
({344-(3-Dibutylamino-propy1)-benzoyn-2-ethyl-
29 0
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.13 (B) 90 "
methyl ester
c,.)
=P
N
0
(1)1(N ----
0 )....õ -.... N /
30 0 * ({344-(3-Butylamino-propy1)-benzoyn-2-
ethyl-
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.01 (B) 89 n
o
methyl ester
1.)
N-- \
'----- \
-.1
0
co
H
CO
N
--I
tO
I 0
N
0
0
H1r,
N -*"...
---- tai
o
0 ........1,..õõ =====., N/ ({344-(3-tert-Butylamino-propy1)-
benzoyn-2-ethyl- in
i
31 0 indolizine-7-carbonyll-isopropyl-amino)-
acetic acid 1.06 (B) 204 H
Ol
methyl ester
N
o
hr.._
N -----" ---
eld
N /
n
({2-Ethy1-3-[4-(3-isopropylamino-propyl)-benzoyn-
0 .
;;1--
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.04 (B)
methyl ester
290.4
32
--,
N
I¨,
------(
O
CJI
1J
01
01
I¨,
CD
1J
0
0
I¨,
1J
hr'S ----- O
0,....õ..i N / ({344-(3-
Cyclopentylamino-propy1)-benzoy1]-2-ethyl-
33 indolizine-7-carbonyll-ethyl-amino)-
acetic acid ethyl 1.1 (B) 153 "
0
=P
ester
R 11,
N
0
......0,...(¨....õN ....., ___
0 ,...1......... --......... N/
0 ({344-(3-Cyclopentylamino-propy1)-
benzoy1]-2- n
34
11, isopropyl-indolizine-7-carbonyll-isopropyl-amino)- 1.12
(B)
247
acetic acid methyl ester
0
1.)
co
N
¨.1 H
N
--I
tO
I 0
N
0
0 H1(...õ
N -"*...
---- Lai
0 ...)..,.., N/
o
in
({344-(3-Cyclohexylamino-propy1)-benzoy1]-2-ethyl-
i
1.17 (B)
H
35 o indolizine-7-carbonyll-isopropyl-amino)-
acetic acid 225 (5)
Q Ille methyl ester
N
0
r,..N
,....,01 ........ ......_
eld
0 -... N /
n
[(3-{443-(2,2-Dimethyl-propylamino)-propyg-
36 o benzoy11-2-ethyl-indolizine-7-carbony1)-
isopropyl- 1.12 (B) 115 0=1'
Y-----1 . amino]-acetic acid methyl ester
--,
--,
ô
N cil
I.)
C.
C.
--,
0
0
N
0
--_- ---------N ---
-- --,
I.)
. 344-(3-Cyclopentylamino-propy1)-
benzoy1]-2-ethyl-
37 ,
indolizine-7-carboxylic acid (2-ethoxy-ethyl)-ethyl-
1.12 (B) 146.4
"
4=.
amide
N--__C
0
Oy--..,_
N - ---
N.....$) \ N/
n
4-{344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
0.83 (B)
122
38 0 indolizine-7-carbonyll-piperazin-2-one
.
N) iv
co
H
co
N
-4
N ti)
V
0 I0
H
re 77- N --- -
\N , ,
¨ N Lõ '-..._ N /
0
/
2-Ethy1-3-{443-(1-methyl-cyclopentylamino)-propylF
in
I
O
H
39
. benzoyll-indolizine-7-carboxylic acid ethyl-(2-methyl- 1.06
(B)
191.3
2H-tetrazol-5-ylmethyl)-amide
(5)
c N
0
IV' ir N - ,
.0
\ 1\1N L.....õ
-.... N / n
¨
344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
40 0 * indolizine-7-carboxylic acid ethyl-(2-
ethy1-2H-tetrazol- 1.01 (B) 117 0=1'
5-ylmethyl)-amide
--,
N
I¨,
---t
O
Ul
N
01
01
I¨,
CD
0
I.)
I.)
/N¨N i\s
-.... N / 344-(3-tert-Butylamino-propy1)-
benzoy1Findolizine-7- ô
41 0 carboxylic acid ethyl-(2-methy1-2H-
tetrazol-5- 0.81 (B) 141.5 "
-7( . ylmethyl)-amide
=P
N
o
r \iµ*1\1) V N----/ .
N¨N ',.....
/ 344-(3-tert-Butylamino-propy1)-benzoy1]-
2-cyclobutyl- n
42 0 * indolizine-7-carboxylic acid ethyl-(2-
methy1-2H- 1.01(B) 195 C
0
tetrazol-5-ylmethyl)-amide
1.)
NI_
CO
GO
H
CO
IV
--I
tO
0
IV
0
N-_,,,,------N
.. H
..-- ____
l..J
/N ' ,
0
43 0 ile 2-Ethy1-344-(-3-ethylamino-4,4-dimethyl-
penty1)-
,,
benzoyn-indolizine-7-carboxylic acid ethyl-(2-methyl-
gomme 0
H
01
2H-tetrazol-5-ylmethyl)-amide
--,,,N
0
',... N /
N
n
cC 344-(3-tert-Butylamino-propy1)-benzoy1]-
2-ethyl-
;;1--
44 \ i, 0 * indolizine-7-carboxylic acid ethyl-(1-
methy1-1H- 3.6 (B, 10mn) 149
\
pyrazol-3-ylmethyl)-amide
--,
N
I¨,
----t
O
fil
1J
01
01
I¨,
CD
\
1J
0
0
I¨, . \o
1J
N ---
O
N ./'
344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
,J ---,
45 indolizine-7-carboxylic acid ethyl-(1-
methy1-1H- 0.93 (B) 173 "
0 Ill pyrazol-4-ylmethyl)-amide
c,.)
=P
N--7K
0
_____e------ir'S ----- ----
0¨N ) N /
344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
n
o
11, indolizine-7-carboxylic acid ethyl-(5-
methyl-isoxazol- 1.01 (B)
3-ylmethyl)-amide
175
46
0
N
CO
¨.1
H
___....\(N
e. ,
1.)
-.1
tO
0 Chiral
N
0
H
N=.--CIN
I
-,... N/
0
in
47 0 lie (R)-1-{344-(3-tert-Butylamino-propy1)-
benzoy1]-2-
I
etheindolizine-7-carbonyll-pyrrolidine-3-carbonitrile 0.96 (B)
272 H
Ol
N(
O Chiral
N. ' I , /
V
eld
n
48 0 111 {344-(3-tert-Butylamino-propy1)-
benzoy1]-2-ethyl-
indolizin-7-y1}-((S)-3-hydroxy-pyrrolidin-1-y1)-
0.84 (B) 124
0=1'
methanone
O
fil
1J
01
01
I¨,
0
CD
I.)
N
0
N /
I.)
\
- , N ,
N¨N /,
O
/ 344-(3-tert-Butylamino-propy1)-benzoy1]-
2-ethyl-
49 0/ 111 indolizine-7-carboxylic acid 2-methy1-
2H-tetrazol-5- 1.19 (B) 203 "
=P
ylmethyl ester
N-7(
00 Chiral
_... ......._
(S)-1-{344-(3-tert-Butylamino-propy1)-benzoy1]-2-
n
50 0 etheindolizine-7-carbony11-2-methyl-
pyrrolidine-2- 1.13 (B) 241
ille carboxylic acid methyl ester
0
N
CO
-.1 H
iN
ai co
1.)
-.1
tO
0 Chiral
N
0),.0
0
_..._
H
l..J
'...,. N /
I0
* 344-(3-tert-Butylamino-propy1)-benzoy1]-
2-ethyl-
I
indolizine-7-carboxylic acid (R)-2-methoxy-1-methyl- 1.37 (B)
189 in
51 0
H
61
ethyl ester
N-?(
0 Chiral
344-(3-tert-Butylamino-propy1)-benzoy1]-2-ethyl-
52 0 lie indolizine-7-carboxylic acid (R)-5-oxo-
pyrrolidin-3-y1 0.82 (B) 162 0=1'
ester
NI__
I¨,
O
fil
I.)
01
01
I¨,
CD
0
I.)
0
4.----N ---
--,
I.)
0 j N/
O
0
N 1-{344-(3-Cyclopentylamino-propy1)-
benzoy1]-2-ethyl-
53 0
0.87 (B) 176 "
[R= . indolizine-7-carbonyIH1,4]diazepan-5-one
4=.
N
0
N----- ----
0 ....)........ ---, N /
[(3-{4-[3-(tert-Butyl-methyl-amino)-propylFbenzoy11-2-
n
o
54
lie ethyl-indolizine-7-carbony1)-isopropyl-aminoFacetic 1.06
(B)
252.1
0
acid methyl ester
N
co
-.1
H
-Ç
N
--I
tO
0
N
0
/ Olc
N .-**- ---
H
l..J
0 ..).....õ ===... N /
I
0
Ille [(2-Ethy1-3-{443-(ethyl-isopropyl-amino)-propyn-
benzoyll-indolizine-7-carbony1)-isopropyl-aminoF
1.08 (B) 195.1 0,,
55 0
H
Ol
acetic acid methyl ester
(-_(
0
A y.....
N-****. ---
eld
,-q
56 0 ({344-(3-Dibutylamino-propy1)-
benzoy1Findolizine-7-
0=1'
----\---1 * carbonyll-
isopropyl-amino)-acetic acid methyl ester 1.08 (B) 92
--,
--,
N
O
----/---/
fil
1J
01
01
I-,
CD
0
1J
ID
h-r N -----
1J
0 ),..,..õ ',.õ N /
-a-,
57 0 ({344-(3-Dibutylamino-propy1)-
benzoy1Findolizine-7-
0.98 (B)
gomme
"
-----\---1 * carbonyll-isopropyl-amino)-acetic acid
=P
N
0
0.,....,,,,,
N..."- ---
I g ) N/
({344-(3-Dibutylamino-propy1)-benzoy1]-2-ethyl-
n
o
----\---1 * isopropyl ester
-.1
o
n)
CO
H
N
-.1 co
---7--/
n)
-.1
tO
0
IV
0
N
, 0
I¨:
y, ...".. ---
y,
l..J
I0 õ....-1...õ ',... N /
0
({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
in
i
59 0
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.3 (B) gomme H
------ \ ----- \ *
isopropyl ester 61
N
----/----/
0
N---- ---
eld
({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
0
0=1'
--,
N
-a-,
ui
1..
c.,
c.,
I 0
CD
1J
N --**- ---
ID
I¨,
O
..),..õ --.... N/ 1J
O
61 0 * ro lamino- ro -benzo 1
({3-[4-(3-DiP PY P PY1) Y ]-2-ethyl-
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.05 (B) gomme
I.)
=P
methyl ester
N--,
7----/ \¨__
0
..õ,.01(\ N ,...., ........
0 \ N /
[(2-Buty1-3-{443-(butyl-ethyl-amino)-propylFbenzoyll-
n
62 0
indolizine-7-carbony1)-isopropyl-aminoFacetic acid
1.14 (B) gomme
( . methyl ester
-.1
o
n)
CO
H
N
CO CO
---7---/
N
--I
tO
0
N
0
()Iri,1 ----
H
l..J
O
1.1_,, N / I
0
63 0 lie ({2-Buty1-344-(3-dibutylamino-propy1)-
benzoy1F
indolizine-7-carbonyll-isobutyl-amino)-acetic acid
1.26 (B) gomme
H
61
N-- \ , methyl ester
i -
0
01r.
---
eld
O
..õ..1..õ \ N/ n
,-q
64 0 *
N-- ({2-Buty1-344-(1-methyl-piperidin-4-y1)-
benzoyn-
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
0.9(B) 193 0=1'
--,
--,
ô
vi
I.)
--,
CD
I 0
1J
0 õIr,
I-,
O
* 0 {[2-Ethy1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
carbonylpsopropyl-aminol-acetic acid methyl ester
0.98 (B) 234
65
"
=P
N
L o
N-="- ---
) N /
2-Buty1-3-(4-piperidin-4-yl-benzoy1)-indolizine-7-
n
o .
N carboxylic acid diethylamide 1.07 (B) 149.6
66
0V
I
CO
¨.1
H
CD
CO
IV
-4
tO
0
IV
0
H
i
in
67 o ({2-Buty1-344-(piperidin-4-yloxy)-
benzoy1Findolizine-
1.09 (B)
147 I
H
Ol
7-carbonyll-isopropyl-amino)-acetic acid methyl ester
NO le
0
0 Chiral
0 ..)....., ====., N/
n
({2-Buty1-3444(S)-piperidin-3-yloxy)-benzoy1]-
68 0 indolizine-7-carbonyll-isopropyl-amino)-
acetic acid 1.09 (B) 147.3 0=1'
methyl ester
--,
--,
0.
vi
I.)
--,
CD
Chiral
1J
01(,N
I¨,
0 ) =-=., N i
1J
0 111, (S)-2-({2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
ô
69 indolizine-7-carbonyll-ethyl-amino)-
propionic acid 1.24 (B) gomme "
=P
N methyl ester
i
0
N ---
)
70 0 2-Buty1-344-(3-dibutylamino-propy1)-
benzoyn-
1.34 (B)
gomme n
----- \----1 * indolizine-7-carboxylic acid benzyl-
ethyl-amide
co
0
N
CO
H
N
0 CO
---/----/
N
--I
tO
0
N
0
0
L. ___
H
l..J
I
0
) -, N i'
in
2-Buty1-344-(3-butylamino-propy1)-benzoyn-
i
71 0 Ille indolizine-7-carboxylic acid ethyl-(2-
methoxy-ethyl)- 1.08 (B) gomme H
01
amide
N____\
'---"\
0
===,,r,,O..õ,õ,",N ....... ____
eld
N /
n
2-Buty1-344-(3-dibutylamino-propy1)-benzoyn-
0
72indolizine-7-carboxylic acid (2-isopropoxy-ethyl)-
1.37 (B) gomme
-----\---1 . isopropyl-amide
--,
--,
N
---7---/
O
fil
1J
01
01
I¨,
0
CD
N
IN ----
0
I-,
.õ. 0 ...)....õ \ N /
N
O
73 0 * [(2-Buty1-3-{4434(3R,5S)-3,5-dimethyl-
piperidin-1-
y1)-propylFbenzoyll-indolizine-7-carbony1)-isopropyl-
1.14 (B) 125
"
=P
amino]-acetic acid methyl ester
.,
...0" ......
.1 0
N -
N / --
(Benzyl-{2-buty1-344-(3-(3-propy1)-
n
õy .......
74 benzoyn-indolizine-7-carbonyll-amino)-
acetic acid 1.3 (B) gomme
0 0
0
-----\ -.--N le methyl ester
co
H
-%
CO
N
IV
----7--/
-4
tO
0
IV
0
0.1c
N --"... --""
H
0
l..J
I
LTI
0 ({2-Buty1-344-(3-diethylamino-propy1)-
benzoy1F I
H
75
0.97 (B) gomme (5)
( * indolizine-7-carbonyll-isopropyl-amino)-acetic
acid
N
(
0
01r,
,-q
76 0 ({344-(3-tert-Butylamino-propy1)-
benzoy1]-2-ethyl-
0.97 (B)
162 0=1'
-7( . indolizine-7-carbonyll-isopropyl-amino)-acetic
acid
--,
--,
ô
vi
N
I.)
Cr
Cr
--,
CD
0
I.)
0
---N' -T N ----,
"
\- ..õ) , N I
NN - 344-(3-Cyclopentylamino-propy1)-
benzoy1]-2-ethyl- ô
77 0 indolizine-7-carboxylic acid ethyl-(2-
methy1-2H- 1.02 (B) 104 "
[R= . tetrazol-5-ylmethyl)-amide
=P
N
0
, NIõ...^.,N ..õ,.. .......
¨N
\ Ne.-- N 1,,,... ',... N /
* 344-(3-tert-Butylamino-propy1)-benzoy1]-2-methyI-
indolizine-7-carboxylic acid ethyl-(2-methy1-2H-
78 0
0.89 (B)
153 n
0
tetrazol-5-ylmethyl)-amide
1.)
CO
N
CO H
N
--I
tO
0
N
0
l..J
0 ..õ."..... ===,. N/
0
0 * [(2-Ethy1-3-{443-(1-isopropylamino-
cyclopenty1)-
79
propyg-benzoyll-indolizine-7-carbony1)-isopropyl-
1.19 (B) 190.7 in
I
H
Ol
le N---,( amino]-acetic acid methyl ester
--K.....-'N
N'o-
s h
0 ---
n
\ N / 2-Buty1-3-(4-piperidin-4-yl-benzoy1)-
indolizine-7-
lei
N carboxylic acid ethyl-(3-methyl-
[1,2,4]oxadiazol-5- 1.03 (B) gomme
ylmethyl)-amide
0
0=1'
--,
--,
ô
vi
I.)
--,
o
0 Chiral
jfN ="*".
0 N ({2-Buty1-344-((R)-piperidin-3-yloxy)-
benzoyn-
indolizine-7-carbonyll-isopropyl-amino)-acetic acid
1.09 (B) 141.5
81 0 methyl ester
0
o
co
CO
CO
0
0
in
;===1".
Solubilité=
0
= 1..)
o
L'évaluation de la solubilité des composés de l'invention est réalisée à pffl
(à partir d'un tampon phosphate pH=6.01) par HPLC en
1..)
ô
utilisant un gradient H20 I CH3CN I CH3S03H par rapport à un échantillon de
référence (une solution diluée du produit à évaluer qui o,
o,
1..)
r...)
sert d'étalon interne). Les résultats de solubilité S sont exprimés en mg/mL.
Généralement les composés de la présente invention
présentent une une solublité S k4 mg/mL à pH il. Parmi eux on peut citer les
solubilités des composés suivants dans le tableau ci-
xi
m
cl dessous :
--I .
-TI TABLEAU 2
Fr
o
ci)
=
r)
rn .
rn
o
H
1.)
-73
. co
4>
co
H
RESULTAT co
STRUCTURE NOM DU COMPOSE
SOLUBILITE SOL UBILITE -1
u)
to
(mg/mL)
i-i
0
....
H
D
0
rn
i
-o
0 Chi
.ral
H
--0
a)
1r" .
. --- --- (S)-1-{2-Buty1-344-(3-
dibutylamino-
2
5.3
o pyrrolidine-2-carboxylic acid methyl ester '''
n
0=1-
e
-a
w
c,
c,
o
L-N-----
1..
-a-,
0 --- _- ({2-Buty1-344-(3-dibutylamino-propy1)-
---.. N ,''
benzoyn-indolizine-7-carbonyll-ethyl- 5.9
5.4 "
0
=P
amino)-acetic acid methyl ester
N
0,0
L _.,
N - ¨
====, N / ({2-Buty1-344-(3-dibutylamino-propy1)-
n
6 0 benzoyn-indolizine-7-carbonyll-ethyl-
4.9 4.3
le amino)-acetic acid
0
N
CO
H
CO
CO
N
........7....../N
tO
N
0 0
0
H
l..J
ON> ---- r-----
I
0
\ 3-({2-Buty1-344-(3-dibutylamino-propy1)-
in
i
benzoyn-indolizine-7-carbonyll-ethyl- 7.2
6.2 H
01
----- \ ------- \ \ / amino)-propionic acid
N
0
()...--r-------N --"--
----- eld
0 ____...--L--- --...._ N/
n
0 ({344-(3-Cyclopentylamino-propy1)-
8 = benzoy1]-2-ethyl-indolizine-7-carbonyll-
4.9 6.21 0=1'
isopropyl-amino)-acetic acid methyl ester
N
I..
C
I..
-a-,
ui
1..
c.,
c.,
CD
0
1,=)
0
- N
1,=)
\ ..
N--,--., [---,,,,.
- -- -,-,.. _NI- = ,> O
2-Buty1-344-(3-dibutylamino-propy1)-
9 0 benzoyn-indolizine-7-carboxylic acid ethyl-
7.22 5.82 "
-----\----, = (2-methy1-2H-tetrazol-5-ylmethyl)-amide
c,.)
=P
N
0
1,1'\OE'irril
0 11> 2-Buty1-344-(3-dibutylamino-propy1)-
benzoyl] -indolizine-7-carboxylic acid
(-)
4.98 5.1
N ethyl-(3-methyl-[1,2,4]oxadiazol-5-
0
1.)
----\¨\ ylmethyl)-amide
co
H
CO
CO
IV
tO
IV
0
0
H
l..J
N,N ...- ____
,
\\N-N l....õ -...... N /
0
2-Buty1-344-(3-dibutylamino-propy1)-
in
i
11 0 benzoeindolizine-7-carboxylic acid ethyl-
0.24 5 H
01
----\---\ * (1H-tetrazol-5-ylmethyl)-amide
_.....x......./N
0
..,..01c
0 .......1.õ ,.... N /
n
* [(2-Ethy1-3-{443-(1-methylamino-
16 0
cyclopenty1)-propylFbenzoyll-indolizine-7- 0.63
5.38
0=1'
I
N carbony1)-isopropyl-aminoFacetic acid
--,
a methyl intenter --
,
ô
vi
I.)
--,
CD
0
I.)
N
, N
0
---- .-----. \
--,
N= N /,, \
"....õ N / 344-(3-tert-Butylamino-propy1)-benzoy1]-2-
ô
17 0 ethyl-indolizine-7-carboxylic acid ethyl-(2-
8.23 5.62 "
-7( lie methy1-2H-tetrazol-5-ylmethyl)-amide
4=.
N
o
N ' -
;N¨N ..õ.1 ... N / 344-(3-tert-Butylamino-3-methyl-buty1)-
18 0 lie benzoyI]-2-ethyl-indolizine-7-carboxylic
acid ethyl-(2-methy1-2H-tetrazol-5- 7.88
6.1 n
0
I.)
ylmethyl)-amide
co
N_...7(
CO
H
CO
I \ )
--.1
-4
li:.
IV
0
0
H
Lrr-----"N ---
--- l..J
I
0 _1 =,, N /
({344-(3-Cyclopentylamino-3-methyl- 0
in
0 butyI)-benzoy1]-2-ethyl-indolizine-7-
I
H
19
a,o
carbonyll-isopropyl-amino)-acetic acid 7.2
5.84 (5)
methyl ester
N
C
0 Chiral
0 --
eld
N / (1\1-...../
. / 2-Ethy1-344-((S)-3-ethylamino-4-methyl-
n
,-q
..-----1 \I
N 1 penty1)-benzoy1Findolizine-7-carboxylic
20
10,0
6,0 0=1'
acid ethyl-(2-methy1-2H-tetrazol-5-
:
.7.: ylmethyl)-amide
--,
--,
ô
vi
I.)
--,
CD
I.)
0
--,
'----------N Y - -L%-. ,
O
, 2-Buty1-344-(3-dibutylamino-propy1)-
23 ¨0 benzoyn-indolizine-7-carboxylic acid ethyl-
6.17 5.38 "
------\------\ =
(2-isopropoxy-ethyl)-amide =P
N
0
.
.õ.....õ0.1.r ,
N '" ----
0 ...) ,....õ N /
({2-Buty1-344-(3-dibutylamino-propy1)- n
26 0 benzoyn-indolizine-7-carbonyll-ethyl-
1.14 6,0
-----\---1 *
amino)-acetic acid ethyl ester 0
1.)
CO
H
CO
N
CO N
---.7.---/
CO --I
tO
N
0
0
H
N /
0
({2-Buty1-344-(3-dibutylamino-propy1)-
in
i
28 0 benzoyn-indolizine-7-carbonyll-isopropyl-
2.42 5.9 H
(3)
------\----\ 111 amino)-acetic acid methyl ester
N
1 .
0-11---N -
. _[.. ,, N /
n
1111 ({344-(3-Butylamino-propy1)-benzoy1]-2-
30 0
ethyl-indolizine-7-carbonyll-isopropyl- 10,0
6.05
0=1'
amino)-acetic acid methyl ester
N-- \
I..
O
Cil
N
C: \
C: \
I..
0
I 0
I.)
0
0s
I.)
0,)
, N-- ,..( \
({344-(3-tert-Butylamino-propy1)-benzoy1]- -a-
,
31 0 2-ethyl-indolizine-7-carbonyll-isopropyl-
2.8 6.08
"
----7( 0
amino)-acetic acid methyl ester =P
N
0
---- ---
g N /
0 ({2-Ethy1-344-(3-isopropylamino-propy1)-
n
32
Ille benzoyn-indolizine-7-carbonyll-isopropyl-
10,0
6.3
amino)-acetic acid methyl ester
0
1.)
co
N
H
-------(
CO
CO
CO
N
--I
tO
N
I 0
0
H
l..J
01(....
0
0 ..õ.1..,_ "...._ N/ ({344-(3-Cyclohexylamino-propy1)-
in
i
35 benzoyI]-2-ethyl-indolizine-7-carbonyll-
1.57 6.3 H
6)
0
Q* isopropyl-amino)-acetic acid methyl ester
N
o
'',.... =-..."-N ....' --
eld
n
) , N / 344-(3-Cyclopentylamino-propy1)-
37 0 lie benzoyI]-2-ethyl-indolizine-7-carboxylic
10,0 6.4 0=1'
acid (2-ethoxy-ethyl)-ethyl-amide
N--0
I..
I..
-a-,
ui
1..
c.,
c.,
CD
N
0
0
I¨,
,
N-Nir N-- / \ N
N
N \' L - -,
-a
, , 344-(3-tert-Butylamino-propy1)-benzoy1]-2-
__I
40 0 * ethyl-indolizine-7-carboxylic acid ethyl-(2-
10,0 5.54 "
=P
ethy1-2H-tetrazol-5-ylmethyl)-amide
---7
0
---
,, N / 344-(3-tert-Butylamino-propy1)-benzoy1]-2-
n
44
CCN
ethyl-indolizine-7-carboxylic acid ethyl-(1- 10,0
6,0
\
0
methy1-1H-pyrazol-3-ylmethyl)-amide
1.)
co
H
N
CO
------t CO
0
I \ )
--I
tO
I \ )
N
0
H
0
rst,,,,,
I
0
N - - ---- 344-(3-tert-Butylamino-propy1)-benzoy1]-2-
in
I
45 _J -.._. N i' ethyl-indolizine-7-carboxylic acid ethyl-(1-
10,0 6,0 H
01
0 Ille methy1-1H-pyrazol-4-ylmethyl)-amide
N
0
344-(3-tert-Butylamino-propy1)-benzoy1]-2-
46 0 ethyl-indolizine-7-carboxylic acid ethyl-(5-
1.73 6,0 0=1'
lemethyl-isoxazol-3-ylmethyl)-amide
--,
--,
......\( N
O
Ul
N
0
0
I¨,
CD
1J
Chiral
0 00
I¨,
1J
N ---- N / --- (S)-1-{344-(3-tert-Butylamino-propy1)-
ô
---,
50 0 benzoy1]-2-ethyl-indolizine-7-carbony11-2-
8.98 6.1
"
Ille methyl-pyrrolidine-2-carboxylic acid
methyl ester
=P
,N
0
---
41) N / 1-{344-(3-Cyclopentylamino-propy1)-
n
53 N benzoyI]-2-ethyl-indolizine-7-carbonyll-
6.93 5.2
0
0
Cl? . [1,4]diazepan-5-one
co
_.
1.)
CO
H
CO
IV
N
--I
tO
IV
0
H
---
I
0 X --, N i' [(2-Ethy1-3-{4[3-(ethyl-isopropyl-amino)-
0
in
I
55 0 11 propyg-benzoyll-indolizine-7-carbony1)- 8.82
5.86 H
01
isopropyl-aminoFacetic acid methyl ester
0
({344-(3-Dibutylamino-propy1)-benzoy1]-
56 0 indolizine-7-carbonyll-isopropyl-amino)-
8.3 6,0 0=1'
--\----\ Ille acetic acid methyl ester
--,
--,
N
----7---/
O
fil
1J
01
01
I¨,
0
0
1J
0
I¨,
({344-(3-Dibutylamino-propy1)-benzoy1]-2-
58 0 ethyl-indolizine-7-carbonyll-ethyl-amino)-
6.3 5.7 I.)
---\---1 *
acetic acid isopropyl ester c,.)
=P
N
---.7---/
0
____
({2-Buty1-344-(3-dibutylamino-propy1)-
n
59 0 benzoyn-indolizine-7-carbonyll-isopropyl-
5.7 5.4
-----\--1 *
amino)-acetic acid isopropyl ester 0
N
CO
H
N
CO CO
-----r¨j
i\-) N
--I
tO
N
)'C'
0
H
l..J
I
Ors , : /
0
({344-(3-Dipropylamino-propy1)-benzoy1]-
0,,
61 0 II 2-ethyl-indolizine-7-carbonyll-isopropyl-
8.93 6.4 H
01
amino)-acetic acid methyl ester
N__\_____
0
eld
n
N / [(2-Buty1-3-{443-(butyl-ethyl-amino)-
62 0 propyg-benzoyll-indolizine-7-carbony1)-
5.3 6.18 0=1'
( Ille isopropyl-aminoFacetic acid methyl ester
--,
--,
N
O
---7---/
CJI
1J
0
0
I¨,
CD
1 C Chiral
N
0
N
o) ,
69 0 * (S)-2-({2-Buty1-344-(3-dibutylamino-
propy1)-benzoeindolizine-7-carbonyll- 5.72
5.6
"
4=.
ethyl-amino)-propionic acid methyl ester
0
----
N /
({2-Buty1-344-(3-diethylamino-propy1)-
n
75 0 benzoeindolizine-7-carbonyll-isopropyl- 8.4
10.14
( * amino)-acetic acid
0
N
CO
H
N
CO
CO
N
l0
N
0
0
H
I
0
0 ,...../.,,. "...., N/ ({344-(3-tert-Butylamino-propy1)-benzoy1]-
in
i
76 2-ethyl-indolizine-7-carbonyll-isopropyl-
6.2 4.12 H
01
0
-7( . amino)-acetic acid
N
o
....,01r.
0 .õ...1....õ \ N'
[(2-Ethy1-3-{443-(1-isopropylamino- n
,-q
79 0 le cyclopenty1)-propylFbenzoyll-indolizine-7-
carbony1)-isopropyl-aminoFacetic acid 8.02
5.99 0=1'
methyl ester
--,
ô
vi
I.)
--,
CD
1J
0
,0,......".. N.",
N II
1J
--N
0 --- 2-Buty1-3-(4-piperidin-4-yl-benzoy1)-
-a-,
c.,
80 -...,. N / indolizine-7-carboxylic acid ethyl-(3-
4.2 5.9 "
0 *
N methyl-[1,2,4]oxadiazol-5-ylmethyl)-amide
=P
0 Chiral
...... ......_
({2-Buty1-3444(R)-piperidin-3-yloxy)-
N /
81 benzoyn 10
6.19
-indolizine-7-carbonyll-isopropyl-
n
0 & amino)-acetic acid methyl ester
0
IV
CO
H
0,0
CO
CD
IV
e.
tO
IV
0
H
l..J
I
0
in
I
H
Ol
eld
n
,-q
;===1--
-a-,
ui
1..
c.,
c.,
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
Effet des composés sur la fibrillation atriale gauche
L'effet des composés de l'invention sur la réfraction atriale et sur
l'induction de brefs
épisodes de fibrillation/flutter atriale causé par des battements atriaux
prématures de
l'oreillette gauche, a été étudié chez le porc de souche German Landrace
anesthésié au
pentobarbital et soumis à une thoracotomie (Knobloch et al.
Electrophysiological and
antiarrhyhmic effects of the novel IKur channel blockers, S9947 and S20951, on
left vs.
right pig atrium in vivo in comparison with the IKr blockers dofetilide,
azimilide, d,l-sotalol
and ibutilide", Naunyn-Schmiedebergss Arch Pharmacol 2002, 366: 482-487). La
vulnérabilité atriale gauche chez ce modèle de porc est également un paramètre
valide
pour tester l'efficacité de composés anti-arythmiques atriaux et a démontré sa
prédictivité chez l'homme (Knobloch et al.).
Méthode
Les animaux étaient prémédiqués avec 2 mL de Rompune2% intramusculaire (i.m.)
et
2mL de ZoletillOO , et anesthesiés avec 5 mL de Narcoren0 (pentobarbital, 160
mg/mL=25-30 mg/kg i.v.) injecté en intraveineux (i.v.) bolus suivi d'une
perfusion
intraveineuse continue de pentobarbital à 12-17 mg/kg/h. Le coeur était exposé
après
une thoracotomie gauche et soutenu par un berceau péricardique. Les animaux
sont
ventilés par assistance respiratoire (Air/oxygène). L'analyse des gaz du sang
(p02;
p002) était réalisée à intervales réguliers pour controler l'apport en oxygène
donné par
le respirateur et maintenir une p02 >100 mm Hg et une pCO2 < 35 mm Hg.
Pour enregistrer les paramètres hémodynamiques, des catheters électroniques de
types
Millar PC 350 sont implantés dans l'artère fémorale gauche (BPs/d :
abbréviations
anglaises pour blood pressure systolic / distolic), l'artère pulmonaire et
dans le ventricule
gauche via l'artère carotide droite (LVP; LVEPD, et HR : abbréviations
anglaises pour
left ventricular pressure, left ventricular end-diastolic pressure et heart
rate
respectivement).
Les ECGs (électrocardiographies) de surface bipolaires sont enregistrés au
moyen
d'électrode-aiguilles implantées en sous-cutané en dérivation II ou III.
Une électrode pour potentiel d'action monophasique est placée dans
l'oreillette droite via
une voie veineuse, et une autre sur l'épicarde de l'oreillette gauche pour la
mesure de la
réfraction atriale.
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
96
Les données électrophysiologiques sont enregistrées et stockées en continue
sur le
disque dur d'un ordinateur via un système d'acquisition et d'analyse en ligne
(Hem
Notocord Evolution, Croissy-sur-Seine, France).
Les réfractions atriales gauche et droite sont mesurées selon le protocole
d'incrémentation S1-S2 avec des longueurs de cycle de base de 240, 300 and
400ms
avant et après l'administration du véhicule ou du composé à tester à des
intervalles
réguliers (15, 30, 60, 90, 120 min).
Les épisodes de brèves fibrillations atriales qui suivent fréquemment le
battement
prémature S2 sont notés et comparés avec l'enregistrement de base
(vulnérabilité atriale
gauche : maximum 45 min avant et après l'injection du composé à tester).
L'évaluation de l'intervalle QT était réalisée pendant le pacing auriculaire
droit dont la
fréquence était augmentée de 10 battements par minute par rapport à la
fréquence
sinusale pendant les 15 premières minutes après l'administration pour éviter
de devoir
corriger la durée de l'intervalle QT et le potentiel d'action monophasique
(MAP) par
rapport à la fréquence cardiaque. Dans ce but, une électrode de stimulation
est placée
sur la partie proximale de l'oreillette droite. Cette procédure permet de
différencier les
composés qui affectent la repolarisation ventriculaire (la prolongation de
l'intervalle QT
est un effet indésirable, car il favorise les arythmies ventriculaires).
L'enregistrement électrophysiologique (ECG et MAP) permet d'identifier les
effets
secondaires types qui sont souvent relatifs au blocage des canaux potassiques,
sodiques et calciques au niveau cardiaque (prolongation du QT, bloc auriculo-
ventriculaire, retards de conduction). Le suivi hémodynamique permet de
distinguer les
effets adverses relatifs au blocage inapproprié des canaux potassiques
[augmentation
de la pression arterielle (PA) et de la pression pulmonaire (PP)], des canaux
sodiques et
calciques (effets inotropes négatifs, chute de pression artérielle).
Résultats:
Le composé de l'invention est évalué sur 2 à 4 porcs à 3mg/kg i.v., bolus ou
en perfusion
de 15 min, et avec 3 fréquences de pacing (150, 200 and 250bpm). Les résultats
obtenus sont exprimés en % d'augmentation des périodes réfractaires atriale
droite et
gauche (LAERP et RAERP respectivement), en % de diminution de la vulnérabilité
atriale gauche (épisodes de fibrillation atriale induite par S2, LAV) par
rapport à la ligne
de base et la durée d'action est exprimée en heure (h). Les composés n 2 à 81
de
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
97
l'invention qui prolongent la LAERP d'au moins 20%, inhibent la LAV d'au moins
60%,
prolongent le QTc de 5ms au maximum et induisent un effet inotrope négatif de
20% au
maximum ou une augmentation de la PA ou de la PP de 5 mm de Hg au maximum.
Il apparaît donc que les composés selon l'invention ont une activité
pharmacologique
intéressante, notamment des propriétés antiarythmiques.
Les composés selon l'invention peuvent donc être utilisés pour la préparation
de
médicaments, en particulier de médicaments antiarythmiques.
Ainsi, selon un autre de ses aspects, l'invention a pour objet des médicaments
qui
comprennent un composé de formule (I), ou un sel d'addition de ce dernier à un
acide
pharmaceutiquement acceptable du composé de formule (I).
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans le
traitement
et la prévention des arythmies atriales et ventriculaires : la tachyarythmie
atriale, la
fibrillation atriale, le flutter atrial, la tachycardie atriale, la
tachyarythmie ventriculaire, les
extrasystoles ventriculaires, la tachycardie ventriculaire, le flutter
ventriculaire et la
fibrillation ; de l'angine de poitrine, de l'hypertension, de l'insuffisance
circulatoire
cérébrale, de l'insuffisance cardiaque, de l'infarctus du myocarde compliqué
ou non
d'insuffisance cardiaque ou de la prévention de la mortalité post-infarctus,
de l'accident
vasculaire cérébral.
Ainsi, selon un autre de ses aspects, l'invention a pour objet l'utilisation
d'un composé de
formule (I) pour la préparation d'un médicament destiné au traitement des
syndromes
pathologiques du système cardio-vasculaire.
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques comprenant, en tant que principe actif, un composé selon
l'invention.
Ces compositions pharmaceutiques contiennent une dose efficace d'au moins un
composé selon l'invention, ou un sel pharmaceutiquement acceptable dudit
composé,
ainsi qu'au moins un excipient pharmaceutiquement acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'Homme du
métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration
orale, sublinguale, sous-cutanée, intramusculaire, intra-veineuse, topique,
locale,
intratrachéale, intranasale, transdermique ou rectale, le principe actif de
formule (I)
CA 02818279 2013-05-16
WO 2012/066234 PCT/FR2011/052661
98
ci-dessus, ou son sel, peut être administré sous forme unitaire
d'administration, en
mélange avec des excipients pharmaceutiques classiques, aux animaux et aux
êtres
humains pour le traitement des troubles ou des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale
telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les
solutions ou suspensions orales, les formes d'administration sublinguale,
buccale,
intratrachéale, intraoculaire, intranasale, par inhalation, les formes
d'administration
topique, transdermique, sous-cutanée, intramusculaire ou intraveineuse, les
formes
d'administration rectale et les implants. Pour l'application topique, on peut
utiliser les
composés selon l'invention dans des crèmes, gels, pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscaramellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique
habituelle, le dosage approprié à chaque patient est déterminé par le médecin
selon le
mode d'administration, le poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention, ou un
de ses sels pharmaceutiquement acceptable.