Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02906251 2015-09-14
wo 2014/140492 1
PCT/FR2014/050578
PROCEDE DE RECUPERATION SELECTIVE DES TERRES RARES D'UNE
SOLUTION ACIDE AQUEUSE DE SULFATE RICHE EN ALUMINIUM ET EN
PHOSPHATES
La présente invention concerne un procédé de récupération sélective des terres
rares lourdes, moyennes et légères d'une solution acide aqueuse de sulfate
comprenant en outre des phosphates et de l'aluminium et éventuellement du
titane, du fer III et du fer II.
Les minerais tels que les minerais de pyrochlore contiennent de nombreux
éléments d'intérêt, parfois en de faibles proportions. Les terres rares font
partie
de ces éléments. Les terres rares peuvent être également produites à partir de
minerai de monazite, de bastnaésite et de loparite. Ces terres rares ont de
nombreuses applications d'intérêt dans divers domaines. Par exemple le
lanthane (La) est un composant de catalyseurs employés dans le raffinage
d'hydrocarbures, le néodyme (Nd) est largement utilisé dans les aimants
NdFeB, l'europium (Eu) et le terbium (Tb) sont des dopants pour les plasmas et
les écrans LCD. L'yttrium (Y) est quant à lui utilisé dans les céramiques YAG
(Yttrium Aluminium Garnet). Il est donc intéressant de pouvoir les extraire et
les séparer des autres éléments présents. Les terres rares peuvent être
divisées
chimiquement en trois groupes :
- Terres rares légères : La, Ce, Pr, Nd
- Terres rares moyennes : Sm, Eu, Gd, Tb, Dy
- Terres rares lourdes : Ho, Er, Tm, Yb, Lu + Y.
Ces éléments, régulièrement assimilés à un seul et même groupe, ont un
comportement chimiquement proche, mais assez différent suivant les réactions
envisagées. Dans le contexte de la présente invention, on considère que le
scandium ne fait pas partie des terres rares. En effet, le scandium (Sc),
pourtant souvent assimilé à la famille des terres rares, possède un
CA 02906251 2015-09-14
wo 2014/140492 2
PCT/FR2014/050578
comportement chimique différent des éléments de la série des lanthanides
(terres rares). La demande en terres rares moyennes et lourdes est plus
importante qu'en terres rares légères alors qu'en général leur teneur dans les
minerais est plus faible et qu'elles sont plus difficiles à récupérer. Il est
donc
important de pouvoir trouver un procédé permettant de les récupérer avec un
bon rendement.
Lors de la lixiviation du minerai de pyrochlore, en particulier du minerai
issu du
gisement de Mabounié, situé au Gabon, la mise en solution des éléments de
valeur (Nb, terres rares (TR), Ta et U) est quantitative. Le lixiviat obtenu
contient non seulement des terres rares légères, moyennes et lourdes mais
également du fer, en particulier du fer ferrique (Fe III), de l'aluminium
(AI), du
titane et des phosphates (P). Cette lixiviation est en particulier décrite
dans la
demande de brevet WO 2012/093170. Or la présence d'aluminium, et dans une
moindre mesure de fer ferrique, gêne la récupération des terres rares et en
particulier des terres rares moyennes et lourdes. Comme cela a été montré
dans les exemples ci-dessous, les réactions classiques et connues de
récupération des terres rares ne permettent pas de toutes les récupérer, et en
particulier de récupérer les terres rares lourdes, ni la totalité des terres
rares
moyennes:
- Précipitation des sels doubles de terres rares: les terres rares lourdes
précipitent peu (rendement inférieur à 10%), les terres rares moyennes
précipitent partiellement (rendement moyen de 50%), et les terres rares
légères précipitent quantitativement (rendement de 90%) ; ce procédé
ne permet donc pas de récupérer suffisamment de terres rares lourdes
et moyennes.
- Extraction par solvant/Résine échangeuse d'ions : la présence de fer
ferrique et d'aluminium limite les constantes d'extraction des terres
CA 02906251 2015-09-14
WO 2014/140492 3
PCT/FR2014/050578
rares, qui, présentes en faibles quantités, ne peuvent s'extraire
correctement.
La demande de brevet US2009/0272230 décrit un procédé de récupération de
terres rares à partir de minerais de monazite et d'apatite. Ces minerais
contiennent beaucoup de phosphates, d'aluminium et de fer. Le procédé
proposé comporte :
- une étape de lixiviation du minerai avec un acide pour dissoudre
complètement le minerai d'apatite dans la liqueur de lixiviation ;
- une étape de précipitation des terres rares de cette liqueur sous forme
de phosphates de terres rares par addition d'ammoniaque ou
d'hydroxydes de calcium ;
- un traitement du résidu par un grillage acide, puis par une lixiviation
avec de l'eau pour produire une liqueur de lixiviation aqueuse riche en
terres rares ;
- la séparation des impuretés incluant le thorium et le fer de cette liqueur
en introduisant un additif de neutralisation tel que l'oxyde de magnésium
ou le carbonate de magnésium ;
- la précipitation des terres rares de la liqueur post - neutralisation, en
particulier en utilisant du carbonate ou la précipitation par sels doubles.
Ces minerais contiennent essentiellement des terres rares légères. Ainsi le
problème de la récupération des terres rares lourdes n'est pas abordé.
En outre la quantité de phosphates présents dans le résidu de lixiviation des
minerais obtenus est en excès par rapport au fer. Il est donc préconisé dans
cette demande de rajouter du fer dans le résidu pour atteindre la
stoechiométrie
requise (Fe/P = 1).
De plus, le problème de la récupération des terres rares en présence de fortes
teneurs en aluminium ne se pose pas. En effet la solution contenant les terres
CA 02906251 2015-09-14
WO 2014/140492 4
PCT/FR2014/050578
rares à récupérer ne contient pas de fortes teneurs en aluminium. La présence
d'aluminium n'est donc pas gênante pour ladite récupération.
Enfin, en raison de la présence des terres rares légères que l'on cherche à
récupérer, il n'est pas possible de neutraliser la liqueur contenant ces
terres
rares avec n'importe quelle base. En particulier il n'est pas possible
d'utiliser
une base contenant du calcium, pourtant moins couteuse et
d'approvisionnement plus aisée, car il y aurait précipitation de gypse ce qui
entrainerait des terres rares.
Les inventeurs se sont aperçus de façon surprenante qu'il était possible de
récupérer avec un bon rendement les terres rares lourdes malgré la présence
de fer ferrique, et surtout d'aluminium dans la solution de départ. Pour ce
faire,
ils ont découvert qu'il était nécessaire de précipiter sélectivement
l'aluminium
en utilisant les phosphates déjà présents par neutralisation à un pH bien
précis,
à condition que l'aluminium soit en excès par rapport aux phosphates. Cette
étape permet d'épurer (ou appauvrir) la solution en aluminium et en
phosphates. Il suffit ensuite de rajouter des phosphates à la solution obtenue
pour cette fois précipiter les terres rares lourdes.
La présente invention concerne donc un procédé de récupération sélective des
terres rares d'une solution acide aqueuse de sulfate comprenant des
phosphates, de l'aluminium et des terres rares lourdes, et éventuellement des
terres rares moyennes, du fer II et du titane, caractérisé en ce qu'il
comprend
les étapes successives suivantes:
- a) neutralisation à un pH compris entre 3 et 4, avantageusement à un pH de
3,5, d'une solution acide aqueuse de sulfate comprenant des phosphates, de
l'aluminium et des terres rares lourdes, et éventuellement des terres rares
moyennes, du fer II et du titane, la solution ayant un ratio molaire Al/P > 1,
avantageusement Al/P k 1,5, en particulier Al/P 2,
et une concentration en
CA 02906251 2015-09-14
WO 2014/140492 5
PCT/FR2014/050578
sulfates > 100 g/L, avantageusement _k200 g/L, en particulier d'environ 270
g/L, par ajout d'une base, de façon à précipiter le phosphate et l'aluminium
et
l'éventuel titane,
- b) séparation liquide/solide entre le précipité formé par le phosphate et
l'aluminium et l'éventuel titane et la solution aqueuse de sulfate et,
- c) récupération de la solution aqueuse de sulfate,
- d) ajout de phosphates à la solution aqueuse de sulfate obtenue à l'étape
c)
tel que le ratio molaire de la solution obtenue PO4/TR soit > 4, de façon
avantageuse PO4/TR est 120, en particulier PO4/TR est de
façon
particulière PO4/TR est 20, de façon encore plus particulière PO4/TR = 5, de
façon à précipiter les phosphates de terres rares lourdes et les éventuels
phosphates de terres rares moyennes,
- e) séparation liquide/solide entre le précipité formé par les phosphates
de
terres rares lourdes et les éventuels phosphates de terres rares moyennes et
la
solution aqueuse de sulfate,
- f) récupération du précipité formé par les phosphates de terres rares
lourdes
et les éventuels phosphates de terres rares moyennes.
Au sens de la présente invention, on entend par terres rares (TR) , les
terres
rares choisies parmi La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu +
Y
et leurs mélanges. En particulier le scandium (Sc) ne fait pas partie des
terres
rares selon la présente invention. Avantageusement les terres rares sont
classées en trois groupes :
- Terres rares légères (LRE): La, Ce, Pr, Nd;
- Terres rares moyennes (MRE): Sm, Eu, Gd, Tb, Dy;
- Terres rares lourdes (HRE): Ho, Er, Tm, Yb, Lu + Y.
L'étape a) du procédé selon la présente invention permet d'épurer (ou
d'appauvrir) la solution en phosphates, en aluminium et en titane (si le
titane
CA 02906251 2015-09-14
WO 2014/140492 6
PCT/FR2014/050578
est présent) afin d'obtenir une solution contenant les terres rares lourdes et
les
éventuelles terres rares moyennes dans laquelle au moins 90% en masse
d'aluminium, des phosphates et de l'éventuel titane ont été supprimés,
avantageusement au moins 95% en masse, par rapport à la masse totale
présente au départ dans la solution. En effet, sans être lié par la théorie,
il
semble que la majorité du phosphate, de l'aluminium et de l'éventuel titane
(au
moins 90% en masse, avantageusement au moins 95% en masse par rapport à
la masse totale présente au départ dans la solution) précipitent. En
particulier,
du fait de son affinité pour l'aluminium, le phosphate semble précipiter
préférentiellement sous forme de phosphate d'aluminium AlPO4 à un pH
compris entre 3 et 4, avantageusement de 3,5, préférentiellement aux
phosphates de terres rares. Une fois les phosphates éliminés, l'aluminium
restant précipitera quantitativement sous forme d'hydroxyde d'aluminium, ce
qui permettra l'élimination de l'aluminium restant. Les phosphates étant en
défaut par rapport à l'aluminium, les terres rares lourdes et les éventuelles
terres rares moyennes ne précipiteront pas ou très peu sous forme de
phosphates (au plus 40 - 50%). Au contraire, la précipitation de l'aluminium
sous forme de phosphates est quantitative. Ainsi la majorité des terres rares
lourdes et des éventuelles terres rares moyennes restera dans la solution de
sulfate (au moins 50-60% en masse par rapport à la masse totale de la solution
acide aqueuse de sulfate initiale).
La base utilisable dans l'étape a) du procédé selon la présente invention peut
être n'importe quelle base. Elle est de façon avantageuse choisie parmi NH4OH,
KOH, un composé de sodium basique, tel que par exemple NaOH ou Na2CO3,
un composé de magnésium basique, tel que par exemple MgO ou MgCO3, un
composé de calcium basique, tel que par exemple CaCO3, CaO et Ca(OH)2, et
leurs mélanges, de façon encore plus avantageuse choisie parmi le MgCO3 un
composé de calcium basique et leurs mélanges.
CA 02906251 2015-09-14
WO 2014/140492 7
PCT/FR2014/050578
Dans un mode de réalisation particulièrement avantageux du procédé selon la
présente invention, la base de l'étape a) est un composé de calcium basique,
avantageusement choisi parmi CaCO3, CaO, Ca(OH)2 et leurs mélanges, de
façon avantageuse il s'agit du CaCO3. Ce type de base est particulièrement
avantageux car il est peu onéreux. En outre, étant donné que l'on ne cherche à
récupérer que les terres rares lourdes, l'utilisation d'une telle base est
possible
puisque la précipitation sous forme de gypse n'entraîne que majoritairement
les
terres rares légères, modérément les terres rares moyennes, et marginalement
les terres rares lourdes.
Avantageusement, la température de l'étape a) du procédé selon la présente
invention est comprise entre 20 et 90 C, en particulier elle est d'environ 70
C.
De façon avantageuse, la durée de l'étape a) est comprise entre 30 min et 6 h
et elle est avantageusement de 1 h.
L'étape d) du procédé selon la présente invention sert à extraire toutes les
terres rares présentes dans la solution par précipitation sous forme de
phosphates de terres rares. Puisque la majorité des phosphates de la solution
a
déjà été éliminée lors de l'étape a) du procédé selon la présente invention
(avantageusement au moins 90% en masse, avantageusement au moins 95%
en masse par rapport à la masse totale présente au départ dans la solution
acide aqueuse de sulfate), il est nécessaire d'en rajouter lors de l'étape d).
La
précipitation est alors quantitative puisqu'il n'y a quasiment plus
d'aluminium
dans la solution (avantageusement la solution contient moins de 10% en masse
d'aluminium par rapport à la solution aqueuse de sulfate initiale, de façon
avantageuse, moins de 5% en masse).
Avantageusement, le phosphate utilisé dans l'étape d) est choisi parmi le
Na3PO4, le K3PO4, le (NH4)3PO4 et leurs mélanges, en particulier il s'agit du
Na3PO4.
CA 02906251 2015-09-14
WO 2014/140492 8
PCT/FR2014/050578
De façon avantageuse, la solution aqueuse de sulfate à l'étape d) à un pH
compris entre 3 et 4, avantageusement il est de 3,5.
Avantageusement, la température de l'étape d) du procédé selon la présente
invention est comprise entre 50 C et le point d'ébullition qui est
avantageusement de 90 C, en particulier elle est comprise entre 70 C et le
point d'ébullition.
De façon avantageuse, la durée de l'étape d) est comprise entre 30 minutes et
2 heures. Avantageusement elle est inférieure ou égale à 1 heure.
Dans un mode de réalisation particulier de la présente invention, la solution
acide aqueuse de sulfate comprenant des phosphates, de l'aluminium et des
terres rares lourdes, et éventuellement des terres rares moyennes, du fer II
et
du titane, est le lixiviat obtenu par attaque acide d'un minerai de pyrochlore
en
milieu sulfate, par exemple telle que décrite dans la demande de brevet WO
2012/093170. En particulier cette solution contient :
- AI: au moins 7g/L, avantageusement entre 7 et 14 g/L;
- P : entre 1 et 6g/L, avantageusement entre 3 et 6 g/L, en particulier
entre 4 et 6g/L ;
- TR lourdes et moyennes: au moins 100 mg/L, avantageusement entre
200 et 300 mg/L;
- S : entre 66 g/L et 100 g/L, avantageusement entre 70 et 80g/L ;
- Ti : 1g/L, avantageusement s'il est présent entre 0,5 et
1g/L.
La solution acide aqueuse de sulfate peut également contenir du fer (Fe)
avantageusement au moins 50g/L, de façon avantageuse entre 50 et 70 g/L, en
particulier sous forme de Fe II.
Dans un autre mode de réalisation particulier de la présente invention, le
procédé selon la présente invention comprend une étape supplémentaire g) de
CA 02906251 2015-09-14
WO 2014/140492 9
PCT/FR2014/050578
lavage du précipité obtenu à l'étape f), avantageusement par repulpage à
l'eau,
de façon avantageuse à température ambiante.
La récupération des terres rares lourdes et des éventuelles terres rares
moyennes à partir du précipité obtenu à l'étape f) ou à l'étape g) peut-être
mise
en oeuvre par des méthodes bien connues de l'homme du métier, telles que par
exemple la purification par conversion en hydroxydes de terres rares.
Avantageusement le rendement de récupération des terres rares lourdes du
procédé selon la présente invention est supérieur à 50 %, de façon
avantageuse supérieur ou égal à 60 A).
Dans encore un autre mode de réalisation du procédé selon la présente
invention, la solution acide aqueuse de sulfate comprenant des phosphates, de
l'aluminium, des terres rares lourdes et des terres rares moyennes, et
éventuellement du fer II et du titane, comprend en outre des terres rares
légères et on cherche à récupérer toute les terres rares (moyennes, lourde et
légères). Or les terres rares légères sont partiellement entraînées par la
précipitation de gypse lors de l'étape a), si cette dernière est mise en
oeuvre
avec un composé de calcium basique. En outre il y a des pertes en terres rares
légères et en terres rares moyennes par précipitation sous forme de phosphates
lors de l'étape a) quelle que soit la base utilisée. Donc si l'on souhaite
récupérer
les terres rares légères et l'ensemble des terres rares moyennes, et donc
éviter
les pertes, le procédé selon la présente invention comprend avant l'étape a),
une étape préalable A) de précipitation par sel double des terres rares
légères
(avantageusement au moins 85% en masse, en particulier 90% en masse, par
rapport à la masse totale des terres rares moyennes présente dans la solution
initiale acide aqueuse de sulfate) de façon à récupérer une solution acide
aqueuse de sulfate appauvrie (ou épurée) en terres rares légères
(avantageusement au maximum il reste 15% en masse de terres rares légères,
CA 02906251 2015-09-14
WO 2014/140492 10
PCT/FR2014/050578
en particulier 10% en masse, par rapport à la masse totale des terres rares
légères présentes dans la solution initiale acide aqueuse de sulfate) et
comprenant des phosphates, de l'aluminium, des terres rares lourdes et des
terres rares moyennes, et éventuellement du fer II et du titane. En
particulier
l'étape de précipitation par sels double précipite non seulement les terres
rares
légères mais également une partie des terres rares moyennes (environ 50% en
masse par rapport à la masse totale des terres rares moyennes présente dans
la solution initiale acide aqueuse de sulfate) et de façon avantageuse, une
minorité de terres rares lourdes (au plus 15% en masse, en particulier 10% en
masse, par rapport à la masse totale des terres rares lourdes présente dans la
solution initiale acide aqueuse de sulfate). Ainsi après cette étape il reste
dans
la solution acide aqueuse de sulfate au moins 50% en masse des terres rares
moyennes par rapport à la masse totale des terres rares moyennes présente
dans la solution initiale acide aqueuse de sulfate, et avantageusement au
moins
85% en masse des terres rares lourdes, en particulier 90% en masse, par
rapport à la masse totale des terres rares lourdes présente dans la solution
initiale acide aqueuse de sulfate.
Le procédé de précipitation de sel double de terres rares légères de l'étape
A)
est bien connu de l'homme du métier. En particulier il s'agit d'une
précipitation
par sel double de sodium, d'ammonium ou de potassium, avantageusement par
sel double de sodium. Dans le cas de la précipitation par sel double de
sodium,
avantageusement l'étape A) a lieu par ajout de sulfate de sodium ce qui
conduit
à la formation d'un composé de terres rares insolubles selon la réaction
suivante :
TR2(SO4)3 + Na2SO4 + 2 H20 -> 2 NaTR(SO4)2,H20.
De façon avantageuse, l'ajout de Na + est effectué en excès par rapport aux
terres rares de façon à obtenir une récupération quantitative des terres rares
légères.
CA 02906251 2015-09-14
WO 2014/140492 11
PCT/FR2014/050578
Afin de récupérer ces terres rares légères, le précipité est séparé de la
solution
acide aqueuse de sulfate appauvrie en terres rares légères. Il est
avantageusement lavé, par exemple avec de l'eau et une solution à 5 % de
Na2SO4.
De façon avantageuse la température de l'étape A) est comprise entre 50 C et
le point d'ébullition, qui est en particulier de 90 C. Avantageusement la
durée
de l'étape A) est comprise entre 30 minutes et 3 heures. En particulier elle
est
de 1 heure.
Avantageusement, grâce à cette étape A), le rendement de récupération des
terres rares légères est supérieur à 85 %, de façon avantageuse supérieur ou
égal à 90%, des terres rares moyennes est supérieur à 50% et des terres rares
lourdes est supérieur à 10%.
Dans un mode supplémentaire de réalisation du procédé selon la présente
invention la solution acide aqueuse de sulfate comprenant des phosphates, de
l'aluminium et des terres rares lourdes, et éventuellement des terres rares
moyennes, des terres rares légères, du titane et du fer II, comprend en outre
du fer III. En particulier la teneur en fer III est inférieure ou égale à
20g/L,
avantageusement comprise entre 5 et 20g/L, de façon très avantageuse
comprise entre 10 et 20g/L. La présence du fer III favorise la précipitation
de
phosphates sous forme de phosphates de fer ferrique (FePO4) lors de la
neutralisation de la solution à l'étape a) du procédé selon la présente
invention.
La quantité de phosphates étant en défaut par rapport à Al et Fe(III) (ratio
molaire (Al + FeIII)/P >1 puisque ratio molaire Al/P >1), le fer ferrique
précipite également sous d'autres formes que celle phosphate, notamment par
précipitation d'hydroxydes de fer ferrique lors de l'étape a). Toutefois une
telle
précipitation a tendance à entraîner d'autres éléments tels que des terres
rares
dans le précipité. En outre, afin de précipiter tout le fer ferrique, il est
nécessaire de rajouter une quantité supplémentaire de base à l'étape a), ce
qui
CA 02906251 2015-09-14
WO 2014/140492 12
PCT/FR2014/050578
entraîne la formation de gypse supplémentaire lorsqu'une base tel qu'un
composé de calcium basique est utilisée. Il est donc intéressant, afin
d'améliorer le rendement de récupération des terres rares lourdes, des terres
rares moyennes, et même des terres rares légères lorsqu'elles sont présentes,
de rajouter dans le procédé selon la présente invention une étape B), avant
l'étape a) et après l'étape éventuelle A), de réduction du fer III en fer II,
avantageusement par ajout de Fe (par exemple sous forme de poudre de fer),
de S02 ou d'un autre agent réducteur. De façon avantageuse cette étape
permet d'obtenir une teneur en fer ferrique (Fe III) < 1 g/L dans la solution
acide aqueuse de sulfate obtenue comprenant des phosphates, de l'aluminium
et des terres rares lourdes, et éventuellement des terres rares moyennes,
légères, du titane et du fer II.
De façon avantageuse, grâce aux étapes A) et B), le rendement de récupération
des terres rares moyennes est >80%, avantageusement supérieur ou égale à
85%.
Dans un dernier mode de réalisation du procédé selon la présente invention,
avant l'étape a) le ratio molaire Al/P de la solution acide aqueuse de sulfate
comprenant des phosphates, de l'aluminium et des terres rares lourdes, et
éventuellement des terres rares moyennes, légères, du fer II, du fer III et du
titane, est <1. Cela signifie que les phosphates sont en excès par rapport à
l'aluminium. Dans ce cas, afin de pouvoir mettre en uvre le procédé selon la
présente invention, il est nécessaire de rajouter une étape C), après les
étapes
éventuelles A) et B) et avant l'étape a), de dopage de la solution avec de
l'aluminium de façon à obtenir un ratio molaire Al/P>1 qui permet de mettre en
oeuvre l'étape a) du procédé selon la présente invention tout en minimisant
les
pertes en terres rares lourdes et en éventuelles terres rares moyennes par
précipitation sous forme de phosphates.
CA 02906251 2015-09-14
WO 2014/140492 13
PCT/FR2014/050578
La présente invention sera mieux comprise à la lumière de la description des
dessins et des exemples qui suivent.
La figure 1 représente le rendement de précipitation (%) des terres rares sous
forme de sels de sulfates doubles de sodium et de terres rares en fonction du
type de terres rares, obtenu dans les conditions de l'exemple comparatif 1.
La figure 2 représente le rendement de précipitation ( /0) des phosphates
d'aluminium ou de Gd (terre rare moyenne) en fonction du pH, obtenu dans les
conditions de l'exemple comparatif 2.
La figure 3 représente le rendement de précipitation (%) des phosphates de
terres rares légères, moyennes et lourdes (La, Gd et Y) en fonction du pH,
obtenu dans les conditions de l'exemple comparatif 2.
La figure 4 représente le rendement de précipitation (%) des terres rares
moyennes et lourdes et de l'aluminium sous forme de phosphates, obtenu dans
les conditions de l'exemple 1 lors de l'étape a) du procédé selon la présente
invention.
La figure 5 représente le rendement de précipitation (%) des terres rares
moyennes et lourdes sous forme de phosphates, obtenu dans les conditions de
l'exemple 2 lors de l'étape d) du procédé selon la présente invention lorsque
le
ratio molaire PO4/TR = P/TR = 40 ou PO4/TR = 120.
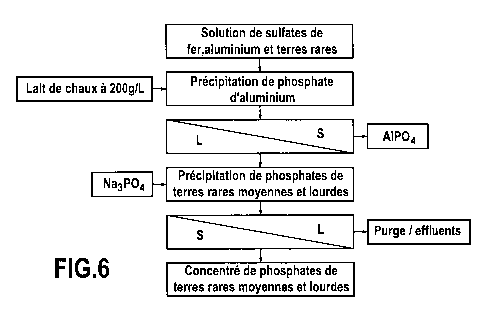
La figure 6 représente le schéma du procédé selon la présente invention tel
qu'utilisé dans l'exemple 3 (étapes a), b), c), d), e) et f) selon la présente
invention).
La figure 7 représente le rendement de récupération (%) des terres rares
légères, moyennes et lourdes, obtenu dans les conditions de l'exemple 3.
La figure 8 représente le schéma du procédé selon la présente invention tel
qu'utilisé dans l'exemple 4 (étapes A), a), b), c), d), e) et f) selon la
présente
invention) (SD = sels doubles de sulfates de terres rares et de sodium, MRE/
CA 02906251 2015-09-14
WO 2014/140492 14
PCT/FR2014/050578
HRE = Medium Rare Earth/Heavy Rare Earth = terres rares moyennes / terres
rares lourdes).
La figure 9 représente le schéma du procédé selon la présente invention tel
qu'utilisé dans l'exemple 5 (étapes A), B), a), b), c), d), e) et f) selon la
présente invention) (SD = sels doubles de sulfates de terres rares et de
sodium,
MRE/ HRE = Medium Rare Earth/Heavy Rare Earth = terres rares moyennes /
terres rares lourdes).
La figure 10 représente le rendement de précipitation (%) de l'yttrium sous
forme de phosphates (c'est-à-dire les pertes en yttrium) et la concentration
résiduelle en aluminium (en g/L) dans la solution en fonction de la teneur en
Fe
(III) en g/L et de la quantité de base Ca(OH)2 ajoutée lors de l'étape a) de
neutralisation selon la présente invention dans les conditions suivantes : 70
C,
2 heures (exemple 5).
La figure 11 représente le rendement de précipitation (%) des terres rares Ce,
Gd et Y et de Fe lors de l'étape d) du procédé selon la présente invention à
la
température de 100 C pendant une durée de 1 heure en fonction du ratio
molaire PO4/TR (exemple 6).
La figure 12 représente le rendement de récupération (%) des terres rares à
chaque étape, obtenu en utilisant le procédé selon la présente invention dans
les conditions de l'exemple 6.
Exemple comparatif 1: Ajout de sodium pour précipiter les terres
rares
Cette réaction est bien connue en milieu sulfate. Un ajout de sulfate de
sodium
conduit à la formation d'un composé de terres rares insoluble, selon la
réaction
suivante : TR2(SO4)3 + Na2SO4 + H20 -> 2 NaTR(SO4)21H20.
Les paramètres optimisés de cette réaction qui donnent les meilleurs
rendements sont les suivants :
CA 02906251 2015-09-14
WO 2014/140492 15
PCT/FR2014/050578
- T = 90 C
- [Na]ajouté = 5 g/L
- Temps de séjour : 1 h
- Lavage du solide : Eau / 5% Na2SO4
La solution (obtenue par lixiviation acide en milieu sulfate de minerai de
pyrochlore) sur laquelle cette étape va être mise en oeuvre présente la
composition suivante :
- Fe: 50 à 70 g/L tel que Fe(III) à ¨ 10 ¨ 20 g/L
- Al : 8 à 14 g/L
- P : 4 à 6 g/L
- Mn : 5 à 7 g/L
- TR : 1 à 3 g/L
- Th : 0,1 à 0,3 g/L
- SO4: 250 à 300 g/L
Dans ces conditions, les rendements de récupération (%) des terres rares
légères, moyennes et lourdes sont présentés dans la figure 1.
Conclusion : Les sels doubles de terres rares légères sont insolubles, ce qui
permet d'en récupérer 90%.
Inconvénient : La solubilité des sels doubles de terres rares décroît avec
l'augmentation du numéro atomique de l'élément, d'où une récupération de
50% des terres rares moyennes et seulement 10% des terres rares lourdes
pour les teneurs en Na considérées.
Exemple comparatif 2 : Utilisation des phosphates présents en
solution pour précipiter des phosphates de terres rares
Le minerai de pyrochlore contient une source de phosphates (venant de
l'apatite notamment) : par conséquent, lors de l'attaque sulfurique du minerai
CA 02906251 2015-09-14
WO 2014/140492 16
PCT/FR2014/050578
de pyrochlore, la totalité de ces phosphates présents sont attaqués et se
retrouvent en solution. Ainsi, une solution type sur laquelle doit être mis en
oeuvre le procédé selon la présente invention contient ¨ 15 g/L de phosphates
(P043-) pour ¨ 270 g/L de sulfates (S042-).
Une des principales sources de minerai de terres rares est la monazite, un
phosphate de terres rares (TRP04). Ce minerai est attaqué en voie sulfate et
la
récupération des terres rares se fait de manière simple :
- La solution obtenue après attaque contient essentiellement des
sulfates/phosphates de terres rares et de thorium (¨ 30 g/L de TR pour
¨ 6 g/L de Th)
- Une neutralisation avec une base type ammoniaque permet d'augmenter
le pH de la solution à 1,5-2, dans une gamme où les phosphates de
terres rares sont insolubles. Un phosphate de terres rares est alors
obtenu avec une bonne pureté.
- Dans certains cas, le thorium peut être séparé des terres rares par une
double neutralisation : précipitation de ThPO4 avant pH 1,5, puis
précipitation de TRPO4 à pH 2.
Suivant cette idée, nous avons réalisé des tests de neutralisation de la
solution
obtenue par lixiviation acide en milieu sulfate de minerai de pyrochlore
présentant la composition suivante :
- Fe: 50à 70 g/L tel que Fe(III) à ¨ 10 ¨ 20 g/L
- Al : 8 à 14 g/L
- P : 4 à 6 g/L
- Mn : 5 à 7 g/L
- TR : 1 à 3 g/L
- Th : 0,1 à 0,3 g/L
- SO4: 250 à 300 g>L
CA 02906251 2015-09-14
WO 2014/140492 17
PCT/FR2014/050578
avec pour but de déterminer une gamme de pH où les phosphates de terres
rares précipitent avec une bonne sélectivité vis-à-vis des autres métaux
présents.
Les conditions opératoires sont les suivantes :
- Température : 70 C,
- Temps de séjour : 3 heures,
- Base ajoutée : NH4OH 30%,
- Lavage du solide obtenu à l'eau.
Les rendements de précipitation obtenus pour le Gd à partir de la solution
dont
la concentration est indiquée ci-dessus en fonction du pH sont représentés
dans
la figure 2.
Etant donné la concentration en sels, les courbes de pH de précipitation sont
déplacées vers la droite : ainsi, les terres rares légères commencent à
précipiter
sous forme phosphate à pH 2,5 et les terres rares lourdes à partir de pH 3. Ce
procédé présente deux inconvénients :
- Les terres rares légères précipitent avec de bons rendements, mais en
même temps que la totalité de l'aluminium, ce qui donne une pureté très
médiocre du concentré (ratio molaire n(AI)/n(TR) ¨ 26) ;
- Les terres rares moyennes et lourdes ne précipitent qu'à 30%.
Ce faible rendement de précipitation n'est pas cohérent avec le faible produit
de
solubilité des phosphates de terres rares : on comprend mieux ce rendement de
précipitation si l'on suit la quantité de phosphates présents en solution lors
de
la neutralisation à un pH plus élevé comment présenté dans la figure 3.
Ainsi, à partir de pH 3, la totalité des phosphates présents en solution est
précipité, sous forme de phosphates d'aluminium, thorium, terres rares
légères.
Par conséquent, il ne reste plus de phosphates disponibles à pH 3 pour
terminer
la précipitation des phosphates de terres rares moyennes et légères. Le
CA 02906251 2015-09-14
WO 2014/140492 18
PCT/FR2014/050578
rendement de précipitation des MRE/HREPO4 stagne donc à 30% à pH plus
élevé.
Conclusion : Possibilité de précipiter la totalité des terres rares légères
Inconvénients : La pureté du précipité est médiocre car tout l'aluminium
précipite dans la même gamme de pH que les terres rares légères. Il n'y a pas
assez de phosphates disponibles en solution pour précipiter toutes les terres
rares moyennes et lourdes.
Exemple comparatif 3 : Dopage de la solution en phosphates pour
favoriser la précipitation des terres rares moyennes et lourdes
Les conditions de précipitation de l'exemple comparatif 2 sont reprises, avec
en
plus un ajout (environ 3g/L en plus) de phosphates (sous forme de Na3PO4)
pour étudier l'influence sur le rendement de précipitation des terres rares
moyennes et lourdes.
Cet ajout de phosphates n'a pas d'impact : la quantité de P présente est en
tel
défaut que, le phosphate d'aluminium précipitant avant les terres rares
moyennes et lourdes, le phosphate ajouté est purgé sous forme de phosphate
d'aluminium.
En effet les ratio molaires: [n(AI)/n(Pll
solution exemple comparative 2 " 2 et ici
[n(ADin(P)lsolution exemple comparative 3 " 1,2.
Ainsi, même en doublant presque la quantité de phosphates, ceux-ci servent
avant tout à précipiter l'aluminium sous forme phosphate et l'influence sur le
rendement de précipitation des terres rares lourdes est inexistant.
Conclusion : Le dopage en phosphate n'a aucun effet sur le rendement de
précipitation des terres rares.
CA 02906251 2015-09-14
WO 2014/140492 19
PCT/FR2014/050578
Inconvénient : AlPO4 précipite avant les phosphates de terres rares moyennes
et lourdes et l'aluminium est en net excès par rapport aux phosphates donc le
moindre ajout de phosphate favorise la précipitation du phosphate d'aluminium.
Exemple 1 : mise en oeuvre de l'étape a) du procédé selon la présente
invention
Nous avons vu que la quantité de phosphates présents en solution est trop
faible (notamment par rapport à l'aluminium) pour espérer récupérer des
phosphates de MRE/HRE, même en dopant au préalable la solution en
phosphate. Ainsi, en fonctionnant à l'inverse, nous pouvons essayer de purger
les phosphates et l'aluminium dans un premier temps afin d'obtenir une
solution
contenant les terres rares moyennes et lourdes, purifiée ou appauvrie en Al et
P.
Conditions opératoires
Les solutions de départ utilisées pour la précipitation du phosphate
d'aluminium
ont approximativement la composition indiquée dans le tableau 1 suivant :
Tableau 1
Fe 52 g/I
Al 7,7 g/I
4 g/I
Al/P (molaire) 2,2
Mn 3 g/I
Ca 0,2 g/I
72,1 g/I
La 71 mg/I
Ce 130 mg/I
Pr 16,7 mg/I
Nd 70 mg/I
Sm 18 mg/I
Eu 7,5 mg/I
CA 02906251 2015-09-14
WO 2014/140492 20
PCT/FR2014/050578
Gd 22 mg/I
Tb 5,1 mg/I
Dy 19 mg/I
Ho 4,3 mg/I
Er 11 mg/I
Tm <0,5 mg/I
Yb 6,2 mg/I
Lu <0,5 mg/I
76 mg/I
Sc 16 mg/I
<0,5 mg/I
Th 97 mg/I
Les conditions utilisées sont les suivantes :
- Ajout de Ca(OH)2 sous forme de lait de chaux à 200 g/L
- Neutralisation de la solution à pH 3,5
- Temps de séjour : 6 heures
- Température : 70 C
- Lavage du solide obtenu par repulpage à l'eau
Résultats
Les rendements de précipitation des terres rares moyennes et lourdes et de
l'aluminium sous forme de phosphates sont représentés figure 4. On remarque
que la précipitation de l'aluminium est quantitative, alors que celle des
terres
rares moyennes et lourdes est limitée à 20 - 40 % environ.
Cette étape permet d'obtenir une solution résultant de l'attaque du minerai de
pyrochlore contenant les terres rares moyennes et lourdes purifiée (ou
appauvrie) en aluminium et phosphates. Elle permet donc d'épurer (ou
d'appauvrir) la solution en aluminium et en phosphate tout en limitant la
coprécipitation des terres rares. La présence en solution de phosphates issus
de
la matrice du minerai a ainsi été utilisée pour précipiter l'aluminium par
CA 02906251 2015-09-14
WO 2014/140492 21
PCT/FR2014/050578
neutralisation sous forme de phosphate d'aluminium, le reste de l'aluminium
précipitant sous forme d'hydroxyde d'aluminium, ces précipitations étant
sélectives vis-à-vis des terres rares.
Cela permettra de tester plusieurs voies de récupération des terres rares
moyennes et lourdes qui ont échoué jusqu'ici du fait de la présence
d'aluminium.
Cette réaction est sélective car les conditions suivantes sont réunies :
- Les phosphates sont en défaut par rapport à l'aluminium : le ratio
molaire Al/P est supérieur à 1;
- Le milieu a été concentré en sulfates afin de favoriser la cornplexation
des sulfates de terres rares. En effet, les phosphates de terres rares
moyennes et lourdes précipitent à pH un peu plus élevé et donc sont
moins perdus avec AlPO4.
Dans ces conditions, la précipitation de phosphates de terres rares est
limitée.
D'un point de vue économique, l'ajout d'une base type chaux (Ca(OH)2) ou
calcaire (CaCO3) permet d'obtenir un procédé ayant une bonne rentabilité.
Exemple 2: mise en oeuvre de l'étape d) du procédé selon la présente
invention
L'objectif est de précipiter sélectivement et quantitativement les terres
rares
présentes en faible concentration dans une solution aqueuse de sulfate ne
contenant quasiment plus d'aluminium ni de phosphates.
Les phosphates de terres rares étant très peu solubles, un ajout de phosphates
est réalisé pour favoriser leur précipitation.
La composition de la solution pour les essais de précipitation des terres
rares
est indiquée dans le tableau 2 ci-après.
CA 02906251 2015-09-14
WO 2014/140492 22
PCT/FR2014/050578
Tableau 2
La 36 mg/I Fe 48,3 g/I
Ce 49 mg/I Al 0,16 g/I
Pr 8 mg/I p 15 mg/I
Nd 26 mg/I Mn 2,6
g/I
Sm 10 mg/I Ca 0,9 g/I
Eu 4,4 mg/I Sr 5,2 mg/I
Gd 14 mg/I Ti 4,5 mg/I
Tb 3,3 me Zr 5,0 mg/I
Dy 13 mg/I s 49,7 g/I
Ho 3 mg/I U <0,5 mg/I
Er 8 mg/I Th <4 mg/I
Tm <0,5 mg/I Sc < 1 mg/I
Yb 4 mg/I
Lu <0,5 mg/I
Y 53 mg/I
La précipitation de phosphates de terres rares a été réalisée par ajout de
phosphates sous forme de Na3PO4.
Les conditions utilisées pour la précipitation sont les suivantes :
- Température : 70 C
- Temps de séjour : 2 heures
- Ajout de Na3PO4,10 H20 tel que:
o Essai 1: [Na]ajoutée = 5 g/L, soit un ratio molaire PO4/TR = P/TR
= 40 mol/mol
o Essai 2 : [Na]ajoutée = 15 g/L, soit un ratio molaire PO4/TR = P/TR
= 120 mol/mol
- Lavage du solide par repulpage à l'eau à température ambiante
Résultats
Les rendements de précipitation des terres rares sont donnés dans la figure 5.
Les rendements de précipitation du thulium et du lutétium n'ont pas pu être
CA 02906251 2015-09-14
WO 2014/140492 23
PCT/FR2014/050578
calculés car ces éléments présentaient des concentrations en-dessous des
limites de détection.
La précipitation des terres rares légères, moyennes et lourdes est
quantitative
(environ 90%, à l'exception du praséodyme à 70%). La stoechiométrie n'exerce
pas d'influence significative sur le rendement de précipitation, ce qui laisse
penser que la quantité de réactifs à ajouter peut être diminuée à l'avenir
(tel
que le ratio molaire P/TR = PO4/TR soit inférieur à 40).
Exemple 3 : mise en oeuvre des étapes a), b), c), d), e) et f) du
procédé selon la présente invention
Conditions opératoires
La solution initiale pour récupérer les terres rares est indiquée dans le
tableau 3
ci-après.
Tableau 3
Fe 52 g/I
Al 7,7 g/I
4 g/I
Al/P (molaire) 2,1
Mn 3 g/I
Ca 0,2 g/I
72,1 g/I
La 71 mg/I
Ce 130 mg/I
Pr 16,7 mg/I
Nd 70 mg/I
Sm 18 mg/I
Eu 7,5 mg/I
Gd 22 mg/I
Tb 5,1 mg/I
CA 02906251 2015-09-14
WO 2014/140492 24
PCT/FR2014/050578
Dy 19 mg/I
Ho 4,3 mg/I
Er 11 mg/I
Tm <0,5 mg/I
Yb 6,2 mg/1
Lu <0,5 mg/1
Y 76 mg/I
Sc 16 mg/I
<0,5 mg/I
Th 97 mg/I
Les conditions utilisées pour la précipitation du phosphate d'aluminium (étape
a) du procédé) sont les suivantes :
- Ajout de Ca(OH)2 sous forme de lait de chaux à 200 g/L
- Neutralisation de la solution à pH 3,5
- Temps de séjour : 6 heures
- Température : 70 C
- Lavage du solide obtenu par repulpage à l'eau
Les conditions utilisées pour la précipitation des phosphates de terres rares
(étape d) du procédé) sont les suivantes :
- Température : 70 C
- Temps de séjour : 2 heures
- Ajout de Na3PO4,10 H20 tel que : {Na] ajoutée = 5 g/L, soit un ratio
molaire PO4/TR = P/TR = 40
- Lavage du solide par repulpage à l'eau à température ambiante.
Le schéma du procédé utilisé est représenté à la figure 6.
Résultats
CA 02906251 2015-09-14
WO 2014/140492
PCT/FR2014/050578
Suite à cet enchaînement d'étapes, le rendement de récupération des terres
rares pour le schéma du procédé proposé est représenté figure 7. Les
rendements de précipitation du thulium et du lutétium n'ont pas pu être
calculés car ces éléments présentaient des concentrations en-dessous des
5 limites de détection.
Ce procédé permet de récupérer les terres rares sous forme phosphates avec
de très bons rendements dans une solution contenant initialement des
quantités importantes de fer, aluminium et phosphore.
La perte en terres rares lors de la neutralisation pourra être diminuée par
10 optimisation des conditions de précipitation d'AIP04. Les rendements de
récupérations des terres rares légères varient entre 50 et 60%, et les terres
rares moyennes et lourdes sont récupérées avec un rendement de 65 à 75%.
La précipitation des terres rares sous forme de phosphates est donc :
- limitée lors de la neutralisation d'AIP04 (30 à 40% environ de
terres rares
15 moyennes et lourdes entraînées) ;
- quantitative lors de l'ajout de phosphate de sodium (rendements de
précipitation de 90% environ).
Exemple 4: Précipitation des terres rares légères sous forme de sels
doubles + purge des phosphates par précipitation de l'aluminium +
20 dopage en phosphates pour récupérer les terres rares moyennes et
lourdes non précipitées (mise en uvre du procédé selon la présente
invention : étapes A), a), b), c), d), e) et f))
Il n'est pas possible de récupérer les terres rares légères sous forme
phosphates car AlPO4 précipite en même temps lors de l'étape a). Une
25 précipitation de sels doubles des terres rares légères (selon l'exemple
comparatif 1) est donc réalisée en première étape. Ensuite, nous pouvons
purger les phosphates et l'aluminium dans un premier temps afin d'obtenir une
CA 02906251 2015-09-14
WO 2014/140492 26
PCT/FR2014/050578
solution contenant les terres rares moyennes et lourdes, épurée ou appauvrie
en Al et P. Un dopage à ce moment-là en phosphates devrait permettre de
précipiter les phosphates de terres rares moyennes et lourdes.
Nous réalisons donc les étapes comme indiqué dans le schéma du procédé de
la figure 8 à partir de cette solution et suivons le rendement TR au cours de
chaque étape. La solution initiale de sulfate aqueuse acide a la composition
suivante :
Fe: 50 à 70 g/L tel que Fe(III) à ¨ 10 ¨ 20 g/L
Al : 8 à 14 g/L
- P : 4 à 6 g/L
- Mn : 5 à 7 g/L
- TR : 1 à 3 g/L
Th : 0,1 à 0,3 g/L
SO4: 250 à 300 g/L.
Les conditions opératoires sont les mêmes que dans l'exemple 3.
Le bilan étape par étape montre que :
- 90% des LRE, 50% des MRE et 10% des HRE précipitent lors de la
première étape de formation des sels doubles ;
- La quasi-totalité du phosphore (P) et de l'aluminium (AI) précipite par
neutralisation à pH 3,5, de même que 40-50% des MRE/HRE
- Les terres rares restantes en solution précipitent avec un excès de
phosphate ajouté (ratio molaire n(PO4)/n(TR) ¨ 100 avec un rendement
de 100%).
Conclusion : il est possible de récupérer les MRE/HRE après élimination du P
et Al initialement présent, par dopage de la solution en phosphates
CA 02906251 2015-09-14
27
WO 2014/140492
PCT/FR2014/050578
Inconvénient : les pertes TR lors de l'étape de précipitation d'Al et P sont
encore importantes et la quantité stoechiométrique de PO4 par rapport aux
terres rares est élevée, ce qui impacte la pureté du produit.
Exemple 5 : Optimisation de la perte des terres rares lors de l'étape de
précipitation Al/P (étape d)) par diminution de la concentration en
Fe(III) : (mise en oeuvre du procédé selon la présente invention :
étapes A), B), a), b), c), d), e) et f))
La présence de fer ferrique (Fe III) venant de la solution amont (solution
aqueuse acide de sulfate comprenant les terres rares) engendre deux
phénomènes :
- La présence de Fe(III) favorise la précipitation de phosphate de fer
ferrique (FePO4) lors de la neutralisation de la solution à pH 3,5 et la
précipitation de gypse et donc l'entrainement des terres rares dans le
gypse;
- La quantité de phosphates étant en net défaut par rapport à Al, Fe(III),
Th, LRE, le fer ferrique précipite également sous d'autre forme que celle
phosphate, notamment par précipitation d'hydroxydes de fer ferrique,
connus pour pomper de nombreux éléments en solution ;
L'idée est donc de neutraliser la solution dans les mêmes conditions pour
précipiter le phosphore et l'aluminium, mais en étudiant l'impact de la
réduction
de la solution : par ajout d'un réducteur (Fe ou SO2 par exemple), le Fe(III)
est réduit à différentes concentrations avant la réaction de neutralisation
afin
d'étudier son influence. On va donc utiliser le schéma du procédé illustré à
la
figure 9.
On regroupe dans le graphique illustré à la figure 10 le rendement de
précipitation (= de perte) des terres rares (yttrium Y en /0) et la
concentration
résiduelle en aluminium dans la solution après précipitation lors de cette
étape
CA 02906251 2015-09-14
28
wo 2014/140492
PCT/FR2014/050578
de neutralisation en fonction de la concentration initiale en Fe(III) dans la
solution (0 ¨ 5 ¨ 10 g/L) et de la quantité de base ajoutée en g/L. Les
conditions réactionnelles sont les suivantes : température 70 C ; durée de
réaction 2 heure ; base utilisée : Ca(OH)2, composition de la solution
initiale
aqueuse de sulfate : Fe : 50 à 70 g/L tel que Fe(III) à ¨ 10 ¨ 20 g/L; AI: 8 à
14 g/L ; P : 4 à 6 g/L ; Mn : 5 à 7 g/L ; TR : 1 à 3 g/L ; Th : 0,1 à 0,3 g/L
; SO4
: 250 à 300 g/L.
Conclusion : Plus la concentration initiale en Fe(III) est faible, plus la
perte en
MRE/HRE est faible. Il est donc fort probable que la présence de Fe(III)
implique deux inconvénients :
- une quantité de base supplémentaire doit être ajoutée pour précipiter le
fer
ferrique, ce qui entraîne une précipitation plus importante de gypse et donc
plus de pertes en terres rares moyennes et lourdes;
- la précipitation de Fe(OH)3 qui peut pomper une partie des terres rares.
II est donc nécessaire de réduire quasiment la totalité du fer ferrique, en
particulier de façon à ce que ([Fe(III)] < 1 g/L), pour minimiser cette perte
terres rares et donc augmenter le rendement du procédé selon la présente
invention.
Exemple 6: Optimisation de la quantité de Na3PO4 ajoutée lors de la
précipitation des MRE/HRE (étape d)) du procédé selon la présente
invention
La composition de la solution type obtenue après épuration en Al et P est
indiqué dans le tableau 4 ci-dessous. Les concentrations en TR sont
susceptibles de varier à +/- 20%.
Tableau 4
CA 02906251 2015-09-14
WO 2014/140492 29
PCT/FR2014/050578
Fe 40-60 g/I La 36 mg/I
Al <200 mg/I Ce 49 mg/I
= <50 mg/I Pr 8 mg/I
Mn 2-5 g/I Nd 26 mg/I
Ca 1 g/I Sm 10 mg/I
Sr lu 10 mg/I Eu 4,4 mg/I
Ti < 100 mg/I Gd 14 mg/I
Zr < 100 mg/I Tb 3,3 mg/I
= 40-60 g/I Dy 13 mg/I
= <0,5 mg/I Ho 3 mg/1
Th <4 mg/I Er 8 mg/I
Sc < 1 mg/I Tm <0,5 mg/I
Yb 4 mg/I
Lu <0,5 mg/I
Y 53 mg/I
Le seul élément pouvant désormais poser problème est le Fe(II) : le phosphate
de fer ferreux est plus soluble que celui de MRE/HRE et doit précipiter à pH
plus
élevé. Mais le rapport entre les deux éléments ne joue pas en faveur des
terres
rares : n(Fe) = n(Fe(II)) et n(Fe)/n(TR) ¨ 500.
En jouant sur les paramètres suivants : température, temps de séjour, quantité
stoechiométrique (QS) PO4/TR, les conditions opératoires ont pu être
optimisées
pour diminuer la quantité de réactifs à ajouter. Les premiers essais de
précipitation avaient été effectués à une QS de 100, ce qui est rédhibitoire
d'un
point de vue économique.
On suit le rendement de précipitation (%) des terres rares (Ca, Gd et Y) et du
fer dans la solution aqueuse en fonction de la QS PO4/TR comme illustré à la
figure 11. Les conditions opératoires de l'étape d) sont les suivantes :
température 100 oc; temps de séjour : 1 heure, phosphate : Na3PO4.
La sélectivité de la réaction est excellente : une faible QS permet de
précipiter
la totalité des terres rares avec peu de fer ferreux. Cela est permis grâce à
une
CA 02906251 2015-09-14
wo 2014/140492
PCT/FR2014/050578
température élevée (100 C) et un temps de séjour délibérément court (< 1h)
qui permet de limiter la réoxydation du Fe(II) en Fe(III) au cours du temps,
et
donc de limiter l'utilisation des PO4 présents pour précipiter un phosphate de
Fe(III).
5 Ainsi, avec une QS inférieure à 20, il est possible de précipiter la
totalité des
terres rares sous forme phosphate, avec seulement 5% de rendement pour le
fer. Les essais ont prouvé qu'une QS de 5 était l'optimum.
Conclusion : dans des conditions économiquement rentables, il est possible de
précipiter la totalité des terres rares restantes après l'élimination de
l'aluminium
10 et du phosphore, avec une pureté relativement bonne (teneur en phosphate
de
terres rares de ¨ 10% pour une QS de 5). La présence en grande quantité de
fer ferreux n'est donc pas une contrainte.
Sélectivité de la précipitation En solution avant
Dans le concentré
des phosphates de terres rares précipitation
après précipitation
Ratio molaire Fe/TR ¨ 500 ¨ 6 - 7
Conclusion globale : Avec l'enchaînement d'étapes comme illustré à la figure
15 9, les rendements (%) obtenus à chaque étape sont représentés à la
figure 12.
Soit : 95% pour les légères, 85% pour les moyennes et 75% pour les lourdes.
On en déduit donc la perte terres rares lors de l'étape de précipitation Al et
P (étape a) du procédé selon la présente invention) : 5% pour les légères, 15%
pour les moyennes et 25% pour les lourdes.