Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
1
Composition comprenant du Bifidobacterium animalis ssp. lactis
La présente invention concerne une composition à base d'au
moins probiotique pour son utilisation dans le traitement curatif de la prise
de poids corporel chez l'être humain en surpoids et/ou dans le traitement
préventif de la prise de poids corporel chez l'être humain en surpoids ou
ayant été en surpoids.
Par les termes en surpoids , on entend, au sens de la
présente invention, que l'être humain présente une accumulation anormale
et/ou excessive de graisse corporelle, principalement abdominale, ce qui
présente un risque pour sa santé. Dans le cadre de la présente invention,
le terme surpoids comprend aussi le cas particulier, et extrême, de
l'état d'obésité chez l'être humain.
Par les termes ayant été en surpoids , il faut entendre au
sens de la présente invention que l'être humain a subi une perte de poids
et présente un poids considéré comme normal (basé sur BMI ou tour de
taille/hanche) depuis une période comprise entre 3 et 5 ans.
Il est difficile d'élaborer un indice simple qui permette de
mesurer le surpoids et l'obésité au niveau d'un panel d'une population
donnée. Par exemple, l'échelle utilisée pour mesurer l'indice de surpoids et
d'obésité chez les enfants et les adolescents, de par le fait que leur
organisme subit un certain nombre de changements physiologiques liés à
leur croissance, diffère de celui utilisé chez l'adulte. Dès lors, en fonction
de l'âge, l'OMS (Organisation Mondiale de la Santé) met à la disposition
du public, différentes méthodes de mesure du poids corporel en fonction
de l'âge de l'individu ou de l'âge moyen de l'échantillon d'individus.
A titre illustratif, le surpoids peut s'évaluer chez l'adulte sur
base de l'Indice de Masse Corporelle (IMC ou BMI pour Body Mass Index),
qui représente une mesure simple du poids par rapport à la taille
couramment utilisée pour estimer le surpoids et l'obésité chez l'adulte. Il
correspond au poids divisé par le carré de la taille, exprimé en kg/m2.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
2
L'IMC présente l'avantage de s'appliquer aux deux sexes et
à toutes les tranches d'âge adultes. Il doit toutefois être considéré comme
une indication approximative car il ne correspond pas nécessairement au
même pourcentage de masse graisseuse selon les individus.
Dans ce contexte, l'OMS définit, sur base de l'IMC, les
valeurs seuils suivantes pour déterminer si un adulte présente un surpoids
ou une obésité:
- un état normal de poids correspond à un IMC compris entre 20 et
25;
- un état de surpoids correspond à un IMC compris entre 25 et 30;
et
- un état d'obésité correspond à un IMC égal ou supérieur à 30.
Toutefois, il est à noter que l'IMC ne donne aucune indication
quant à la répartition de la graisse abdominale par rapport à la graisse
sous-cutanée.
Cet indice, même s'il présente l'avantage d'uniformiser la
classification aux deux sexes et à toutes les tranches d'âge des individus
adultes, peut de préférence être interprété de manière complémentaire
avec un autre indicateur qui peut être, par exemple, la mesure du tour de
taille de l'individu.
Ainsi, un individu masculin adulte présentant un tour de taille
supérieur à 100 cm est considéré comme étant en surpoids. Ce seuil est
de 88 cm chez la femme adulte.
Ce paramètre peut être généralisé à toutes les tranches
d'âge en mesurant le rapport tour de taille (A) / tour de hanches (H).
Le surpoids est observé pour un rapport supérieur à 1 chez
l'individu masculin et supérieur à 0,85 chez l'individu de sexe féminin.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
3
Le terme traitement s'applique dans le cadre de cette
invention dès lors que le surpoids chez l'être humain et en particulier
l'obésité humaine, a été reconnu comme une maladie par l'OMS.
Par le terme curatif , il faut entendre, au sens de la
présente invention, l'action qui vise à réduire le poids corporel d'un être
humain en surpoids et/ou à réduire la prise de poids corporel chez l'être
humain en surpoids. Le traitement curatif implique donc l'action qui vise à
atteindre, de préférence pendant et/ou après diète, un poids corporel
considéré comme normal chez l'être humain, c'est-à-dire avec un risque
moindre pour la santé, dans une plage de valeurs prédéterminée, basée,
par exemple sur l'IMC, qui est compris entre 20 et 25, de préférence égal à
22.
Par les termes risque moindre pour la santé , il y a lieu
d'interpréter dans le cadre de la présente invention que, à un poids
corporel considéré normal, le risque de développer un syndrome
métabolique est négligeable.
En particulier, l'action curative vise principalement la
diminution de la graisse abdominale chez l'individu ou au moins une
diminution de l'accumulation de la graisse abdominale.
Par le terme préventif , il faut entendre, au sens de la
présente invention, l'action qui vise à stabiliser le poids corporel d'un être
humain en surpoids ou qui a été en surpoids (c'est-à-dire qui a perdu du
poids) et donc à empêcher ou limiter la prise de poids corporel chez l'être
humain en surpoids ou qui a été en surpoids, de préférence pendant
et/ou après diète. Le traitement préventif implique aussi l'action qui vise à
maintenir, de préférence pendant et/ou après diète, un poids corporel
stable, de préférence considéré comme normal chez l'être humain, dans
une plage constante de valeurs prédéterminée, basée, par exemple, sur
l'IMC (pour rappel, entre 20-25), mais le poids corporel normal peut aussi
être interprété à la lumière du rapport A/H inférieur à 0,85 chez l'individu
de sexe féminin, et inférieur à 1,00 chez l'individu de sexe masculin.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
4
Actuellement, à l'échelle mondiale, le surpoids et l'obésité
sont responsables (du fait des maladies associées, comme le diabète de
type 2 ou les maladies cardiovasculaires) de plus décès que l'insuffisance
pondérale.
En particulier, le surpoids et l'obésité ont atteint les
proportions d'une épidémie mondiale (compte tenu que près de 3 millions
de personnes au moins décèdent chaque année de pathologies liées à
leur surpoids ou leur obésité) et ne sont plus limités aux pays dits riches
mais touchent désormais également les pays à revenu faible ou
intermédiaire.
Il est en outre démontré qu'un IMC élevé, parfois
conjointement à un rapport A/H élevé, constitue un facteur favorisant,
d'une part, le syndrome métabolique qui est défini dans le cadre de la
présente invention comme une association de facteurs de risques pour
la santé : une hypertension artérielle, une hypertriglycéridémie, un taux
bas en cholestérol HDL, un état d'obésité androïde (par exemple, une
accumulation de graisse abdominale), et une élévation de la glycémie.
Ces indicateurs constituent de fait une base de définition qui est
commune aux actuelles trois définitions principales connues : celle de
l'OMS (publiée en 1998 puis amendée en 1999), celle du National
Cholesterol Education Program (NCEP-ATPIII) publiée en 2001, et celle
de la Fédération Internationale du Diabète publiée en 2005.
En pratique, le syndrome métabolique se traduit par les
indicateurs suivants, de manière non exhaustive : un taux d'insuline
anormalement élevé ; un diabète de type 2; une hypercholestérolémie
(associée à un taux bas de bon cholestérol HDL) ; une
hypertension ; une augmentation significative de la prise de poids
corporel au cours du temps, surtout s'il s'agit d'une obésité abdominale ;
une hypertriglycéridémie ; une stéatose hépatique ; le développement
d'un état inflammatoire systémique; et une hypertrophie des adipocytes.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
Par ailleurs, le risque de maladies chroniques se traduit par
les indicateurs suivants, de manière non exhaustive : les troubles
musculo-squelettiques, en particulier l'arthrose; ou certains types de
cancers.
5 La
problématique de prise de poids corporel incontrôlée
amenant au surpoids chez l'être humain est donc un problème sociétal
avéré ayant un impact non négligeable sur la santé, au niveau mondial.
C'est dans cette perspective que l'OMS a établi, dans sa
stratégie mondiale de prévention de la prise de poids excessive, des
recommandations concernant l'alimentation et l'exercice physique.
Adoptée par l'Assemblée Mondiale de la Santé (AMS) en 2004, cette
stratégie définit les mesures nécessaires pour encourager les gens à
suivre une alimentation saine et à faire régulièrement de l'exercice.
Toutefois, si cette stratégie repose sur des recommandations
prévenant la prise de poids, elle ne propose pas d'indications quant aux
traitements curatif et préventif de la prise de poids chez les individus en
surpoids ou ayant été en surpoids et qui présentent un risque de reprise
de poids. En effet, actuellement, la problématique de prise de poids
incontrôlée ne cible plus seulement les individus normopondéraux (c'est-à-
dire qui présentent un IMC normal et/ou un tour de taille normal)
susceptibles de prendre du poids, mais surtout les individus déjà en
surpoids dès lors que l'OMS indique que près de 1,4 milliard de
personnes âgées de 20 ans et plus présentent d'ores et déjà un
surpoids. Parmi elles, plus de 200 millions d'hommes et près de 300
millions de femmes sont obèses, et globalement, plus d'un adulte sur dix
dans le monde est obèse.
Il existe donc un réel besoin de disposer d'un traitement qui
permette la réduction ou la prévention du surpoids et de l'obésité chez
l'être humain en surpoids. De préférence, ce traitement doit être peu
contraignant dès lors que l'on sait qu'une raison principale liée au surpoids
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
6
et à l'obésité est le manque d'assiduité à suivre un régime précis associé à
un traitement qui peut être parfois lourd.
En particulier, la présente invention s'inscrit dans le cadre
d'une relation de cause à effet connue qui associe des modifications du
microbiote intestinal au développement de l'obésité (Ley et co., 2006.
Nature, 444: 1022-1023; Nadal et co., 2008. Int J. Obes., 33(7): 758-67).
De nombreuses études ont été menées dans ce contexte et
ont alimentées l'état de l'art actuel incluant un large panel de documents
mentionnant l'utilisation de traitements à base de probiotiques dans le
cadre du surpoids et de l'obésité.
En particulier, il a été montré que le microbiote contribue à
maintenir l'hôte en bonne santé. En effet, l'état équilibré du microbiote
contribue à la régulation de l'homéostasie intestinale et à l'équilibre
immunitaire, de sorte que, tout déséquilibre du microbiote est interprété
comme participant au développement du syndrome métabolique, en
particulier chez les individus présentant une prédisposition génétique à
développer ce syndrome (Parks et al., Cell Metab, 2012).
La mise en évidence de la relation microbiote - prise de poids
a été le moteur pour un large panel d'études qui ont fait l'objet de
différentes demandes de brevet, dont les plus pertinentes sont
commentées ci-dessous.
Il y a tout d'abord lieu de mentionner la demande de brevet
internationale W02007043933 qui propose l'utilisation des souches de
Lactobacillus casei F19 et L. acidophilus NCFB 1748, et le Bifidobacterium
lactis Bb12, sous la forme de laits fermentés, pour réduire l'appétit et le
dépôt des graisses dans certains tissus, et ainsi, contrôler le poids
corporel, chez l'être humain. Cependant, il semble que ce soit plutôt
l'action conjointe du calcium et des protéines laitières qui soient à
l'origine
de l'effet revendiqué dans cette demande plutôt que la présence des
souches de bactéries susmentionnées. En outre, cet effet ne cible que
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
7
l'expression des gènes liés au métabolisme de l'intestin grêle et ne porte
donc pas sur les autres organes et tissus impliqués dans la prise de poids.
Ensuite, le document US20100061967A1 propose
également l'utilisation d'une composition de bactéries pour moduler
l'expression des peptides régulant le mécanisme de satiété, cette
modulation prenant place de manière exclusive dans le tractus gastro-
intestinal.
La demande de brevet internationale W02009153662
divulgue quant à elle l'utilisation d'une composition à base de
Bifidobacteriesa et de Lactobacilles dans le traitement du diabète, une
maladie reprise dans la liste des indicateurs associés au syndrome
métabolique induit par le surpoids ou l'obésité, et ce, en se basant
exclusivement sur la capacité que présentent ces microorganismes à
réduire l'inflammation des tissus périphériques mais sans pour autant agir
sur le système nerveux central, et donc par exemple sur le mécanisme de
la régulation centrale de la satiété.
En outre, le document US20100150890 renseigne l'utilisation
de probiotiques bactériens dans une composition pour stimuler la fonction
du système nerveux sympathique de sorte que le métabolisme, et donc la
dépense énergétique, soit stimulée. Toutefois, il a été montré que le tonus
sympathique est également actif chez certains individus obèses et, ainsi,
son activation ne constitue pas une alternative fiable dans le cadre du
traitement du surpoids et de l'obésité.
La demande de brevet US20100111915 présente l'utilisation
générique d'une composition de probiotiques bactériens comme une
alternative dans le cadre de la prévention de l'obésité chez l'enfant. Selon
US20100111915, cette utilisation se base sur les effets bifidogènes des
probiotiques, bien que ce document ne renseigne aucun fondement
tangible qui permette d'établir que l'augmentation du nombre de
bifidobactéries dans l'intestin puisse être à l'origine de cette action
préventive de l'apparition de l'obésité chez l'enfant.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
8
Le document US20050112112 propose l'utilisation d'une
composition de microorganismes générant des polymères de sucre, non-
digestibles par l'être humain, à partir de monosaccharides et de
disaccharides présents dans le tractus gastro-intestinal, réduisant ainsi de
facto l'absorption de sucres dans le corps.
Enfin, le document JP10306028 renseigne par ailleurs une
action inhibitrice de l'absorption par l'organisme du cholestérol, et ce, par
l'utilisation de bifidobactéries combinées au chitosan.
Malheureusement, l'utilisation des compositions de l'état de
la technique, si elle permet une réduction du surpoids ou de l'obésité et
une réduction des symptômes associés au syndrome métabolique (on
parle par exemple de rémission), elle ne permet pas un maintien à long
terme de plus de 3 à 5 ans (on parle par exemple de guérison) du poids
corporel au niveau de normalité souhaité (c'est-à-dire correspondant par
exemple à un IMC entre 20 et 25).
Dans le cadre de la présente invention, il y a lieu de
distinguer la rémission de la guérison. Un individu est dit en rémission si,
lors des examens médicaux (mesure du poids, du tour de taille, etc.), on
ne décèle plus de surpoids. Mais on ne parle de guérison qu'après un
certain délai supplémentaire, qui varie en fonction du type de surpoids. En
général, quand la rémission dure depuis 3 ou 5 ans, il est considéré qu'il y
a guérison.
La présente invention a pour but de pallier le manquement
de l'état de la technique en fournissant une composition telle que décrite
au début caractérisée en ce que ledit probiotique est Bifidobacterium
animalis ssp. lactis n LMG P-28149.
La souche selon l'invention a été déposée par le BCCM
(Belgian Coordinated Collections of Micro-organisms) et le LMG
(Laboratorium voor Microbiologie - Bacteriênverzameling) le 27 janvier
2014 selon le traité de Budapest, sous le numéro LMG P-28149.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
9
Dans le cadre de la présente invention, la composition
comprend de préférence le probiotique est Bifidobacterium animes ssp.
lactis n LMG P-28149 à l'état vivant. Par les termes à l'état vivant , on
entend une concentration en bactéries vivantes dans la composition
comprise entre 108 et 1013 cfu par gramme de composition.
Dans le cadre de la présente invention, il a été observé que
cette souche de probiotique particulière présente une action positive
significative sur la satiété et également une restauration du microbiote
intestinal associé à la limitation de prise de poids corporel.
Il a été notamment observé le rôle de la présence du
Bifidobacterium animalis ssp. lactis n LMG P-28149 dans la recolonisation
du tractus intestinal par Akkermansia muciniphila, une bactérie réputée
pour son rôle dans la prévention de l'obésité chez l'être humain dont le
niveau est fortement réduit chez l'individu en surpoids ou obèse.
En outre, il a été par ailleurs observé de manière surprenante
l'action anti-inflammatoire et immuno-régulatrice de la souche selon
l'invention qui est associée à la restauration de l'expression du facteur de
transcription PPARy, impliqué dans la fonction des lymphocytes T
régulateurs du tissu adipeux blanc.
Ainsi, la composition selon l'invention permet notamment le
traitement curatif ou préventif du dérèglement du microbiote intestinal et
des maladies inflammatoires associées à ce dérèglement chez l'être
humain en surpoids.
La présente composition vise donc de manière avantageuse
le traitement curatif ou préventif du syndrome métabolique lié au surpoids
chez l'être humain.
Il a donc été démontré, selon la présente invention, que la
composition à base du Bifidobacterium animes ssp. lactis n LMG P-
28149 présente notamment les effets suivants sur l'organisme, lesquels
s'accompagnent d'une réduction du gain de poids corporel sous régime
riche en graisses, de préférence pendant et/ou après une diète, ou d'une
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
stabilisation du poids corporel : une amélioration de la sensibilité à
l'insuline ; une réduction du développement de la masse graisseuse
abdominale et sous-cutanée: une réduction de la taille des adipocytes ;
une réduction de l'infiltration cellulaire des tissus adipeux blancs, en
5 particulier par les macrophages pro-inflammatoires ; une réduction des
marqueurs inflammatoires ; une limitation de la stéatose du foie ; et une
limitation ou une réduction du taux de mauvais cholestérol.
Comme on peut le constater, la composition suivant
l'invention comprenant au moins le probiotique Bifidobacterium animalis
10 ssp. lactis n LMG P-28149 agit sur divers facteurs liés au surpoids.
Dans le cadre de la présente invention, il a été aussi
démontré l'action préventive et curative sur la prise de poids ainsi que
l'action sur le syndrome métabolique chez l'être humain en surpoids, non
seulement de la souche spécifique Bifidobacterium animalis ssp. lactis n
LMG P-28149, à l'état vivant ou non, mais aussi des composés issus de
cette souche.
Dans ce contexte, la composition selon l'invention peut
comprendre en outre au moins un ou une combinaison d'au moins deux
éléments de probiotique, chaque élément étant issu du Bifidobacterium
animalis ssp. lactis n LMG P-28149 et étant choisi parmi le groupe
constitué de constituants de la paroi cellulaire, des organites cellulaires,
des acides nucléiques, des constituants de la membrane cellulaire, et
des métabolites cellulaires.
A titre illustratif et non-limitatif, les constituants de la paroi
cellulaire sont choisis dans le groupe constitué de peptidoglycanes, de
protéines, de polysaccharides, de l'acide téichoïque, ou d'une
combinaison de ces derniers.
A titre illustratif et non-limitatif, les métabolites sont choisis
dans le groupe constitué des acides organiques, des acides
inorganiques, des protéines, des peptides, des acides aminés, des
enzymes, des lipides, des carbohydrates, des glycolipides, des
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
11
glycoprotéines, des vitamines, des sels, des métaux, ou une
combinaison de ceux-ci.
Dans un mode de réalisation particulier, la composition selon
l'invention comprend du butyrate, ou au moins un de ses dérivés, et/ou
du propionate, ou au moins un de ses dérivés, l'induction dudit butyrate
et/ou dudit propionate étant favorisée par Bifidobacterium animalis ssp.
lactis n LMG P-28149.
Eventuellement, la composition selon l'invention comprend
au moins un probiotique additionnel, ledit probiotique additionnel étant
choisi dans le groupe constitué des probiotiques suivants : Archaea,
Firmicu tes, Bacteroide tes, Proteobacteria,
Actinobacteria,
Verrucomicrobia, Fu soba cteria ,
Metanobacteria, Spirochaetes,
Fibrobacters, Deferribacteres, Deinococcus, Thermus, Cyanobacteria,
Methanobrevibacterium, Lactobacillus,
Peptostreptococcus,
Ruminococcus, Coprococcus, Subdolingranulum, Dorea, Bulleidia,
Anaerofustis, Gemella, Roseburia, Catenibacterium, Dialister,
Anaerotruncus, Staphylococcus, Micrococcus, Propionibacterium,
Enterobacteriaceae (non-pathogène), Faecalibacterium, Bacteroides,
Parabacteroides, Prevotella, Eubacterium, Akkermansia, Bacillus,
Butyrivibrio, et Clostridium, ou une combinaison de ceux-ci.
De préférence, la composition selon l'invention peut
comprendre en outre au moins une souche de champignon et/ou de
levure, ladite souche étant choisie dans le groupe suivant :
Saccharomyces, Candida, Pichia, Debaryomyces, Torulopsis,
Aspergillus, Rhizopus, Mucor, et Penicillium.
De préférence, la composition selon l'invention comprend
un véhicule d'encapsulation de probiotique dans lequel ledit
Bifidobacterium animalis ssp. lactis n LMG P-28149 et éventuellement
ledit au moins un probiotique additionnel sont encapsulés.
De manière avantageuse, ledit champignon et/ou ladite
levure sont également encapsulés dans ledit véhicule.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
12
Alternativement, le véhicule d'encapsulation comprend au
moins une substance choisie dans le groupe constitué de l'alginate, du
chitosan, de la pectine, du pullulan, de la gélatine, du carraghénane, du
gel agar ou une combinaison de ceux-ci.
De manière préférentielle, ladite au moins une substance
est un hydrocolloïde.
De manière avantageuse, la composition selon l'invention
comprend au moins une source nutritive choisie dans le groupe constitué
d'un monosaccaride, d'un polysaccharide, d'un aminoacide, d'un
peptide, d'une protéine, d'une vitamine, d'un extrait de levure, un sel
d'halogénure, d'un métal alcalin ou alcalinoterreux, d'un antioxydant, de
glycérol, d'acétate de zinc, de chlorure de zinc, de lactate de zinc,
d'acide ascorbique, d'acide citrique, d'une huile végétale, de graisse de
lait, ou une combinaison de ceux-ci.
Dans un mode particulier de réalisation, la composition selon
l'invention est une composition symbiotique comprenant au moins un
prébiotique.
De préférence, ledit au moins un prébiotique est choisi, de
manière non limitative, dans le groupe constitué des oligosaccharides,
des fructo-oligosaccharides, des galacto-oligosaccharides, des xylo-
oligosaccharides, de l'inuline ou de ses dérivés, du lactulose ou de ses
dérivés, des mannane-oligosaccharides, ou une combinaison de ces
derniers.
De manière préférentielle, la composition selon l'invention
comprend un premier revêtement entérique recouvrant ledit
Bifidobacterium animalis ssp. lactis n LMG P-28149 et éventuellement
ledit au moins un probiotique additionnel. En particulier, le premier
revêtement entérique est choisi dans le groupe constitué de l'éthyle
cellulose, de l'hydroxypropyle cellulose, de la carboxyméthyle cellulose,
de polymères (comme par exemple l'Eudragit()), ou une combinaison de
ceux-ci.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
13
Alternativement, la composition comprend en outre un
deuxième revêtement externe choisi dans le groupe constitué de
l'alginate, du chitosan, de la pectine, du pullulan, de la gélatine, du
carraghénane, du gel agar, de la cellulose, de l'hémicellulose, de l'éthyle
cellulose, de la carboxyméthyle cellulose, ou une combinaison de ceux-
ci.
Dans un autre mode de réalisation éventuel, la composition
selon l'invention comprend un ou plusieurs excipients biocompatibles.
La composition selon l'invention peut être destinée au
traitement curatif ou préventif de la prise de poids corporel excessive
(c'est-à-dire dépassant largement la prise de poids accompagnant la
grossesse) chez la femme enceinte ou la femme qui a accouché ou chez
l'homme en couvade ou ayant été en couvade.
Selon l'invention, la composition peut se présenter sous la
forme d'une composition alimentaire, d'un aliment à base de la
composition ou encore d'un complément alimentaire comprenant du
Bifidobacterium animalis ssp. lactis n LMG P-28149, de préférence à l'état
vivant.
Par les termes composition alimentaire , il faut entendre
au sens de la présente invention une composition que l'on retrouve
communément sur le marché de l'alimentaire (par exemple, les en-cas, les
plats préparés, des boissons, etc.).
Par les termes complément alimentaire , il faut entendre
au sens de la présente invention une denrée alimentaire dont le but est
de fournir un complément de nutriments ou de substances ayant un effet
nutritionnel et/ou physiologique.
Selon l'invention, la composition peut être prévue pour une
utilisation et une prise par voie orale, ou sublinguale, mais également
respiratoire, de préférence nasale ou bronchique, ou encore rectale.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
14
La composition peut être aussi une composition liquide
injectable à base d'au moins un élément issu du probiotique et destinée à
être injectée par sous-cutanée.
De manière préférentielle, la composition selon l'invention
peut être conditionnée sous forme de comprimés, de globules, de gélules,
de granules, de poudres, de fluides, de liquides, de crèmes ou de sprays.
Selon l'invention, la composition peut être utilisée pour le
traitement curatif ou préventif de la prise de poids corporel excessive
(c'est-à-dire dépassant largement la prise de poids accompagnant la
grossesse) chez la femme enceinte ou qui a accouché ou chez l'homme
en couvade ou ayant été en couvade.
D'autres formes de réalisation et d'utilisation de la
composition thérapeutique suivant l'invention sont indiquées dans les
revendications annexées.
La présente invention porte également sur une utilisation
cosmétique non-thérapeutique d'une composition comprenant au moins
probiotique, chez l'être humain en surpoids ou ayant été en surpoids, ledit
probiotique étant Bifidobacterium animalis ssp. lactis n LMG P-28149.
De préférence, ladite composition pour une utilisation
cosmétique non-thérapeutique comprend au moins un probiotique
additionnel choisi dans le groupe constitué des probiotiques suivants
Archaea, Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria,
Verrucomicrobia, Fusobacteria, Metanobacteria,
Spirochae tes,
Fibrobacters, Deferribacteres, Deinococcus, Thermus, Cyanobacteria,
Methanobrevibacterium, Lactobacillus,
Peptostreptococcus,
Ruminococcus, Coprococcus, Subdolingranulum, Dorea, Bulleidia,
Anaerofustis, Gemella, Roseburia, Catenibacterium, Dialister,
Anaerotruncus, Staphylococcus, Micrococcus, Propionibacterium,
Enterobacteriaceae (non-pathogène), Faecalibacterium, Bacteroides,
Para bacteroides, Prevotella, Eubacterium, Akkermansia, Bacillus,
Butyrivibrio, et Clostridium, ou une combinaison de ceux-ci.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
Avantageusement, ladite composition pour une utilisation
cosmétique non-thérapeutique comprend une souche de champignon
et/ou de levure choisie dans le groupe constitué de Saccharomyces, de
Candida, de Pichia, de Debaryomyces, de Torulopsis, d'Aspergillus, de
5 Rhizopus, de Mucor, et de Penicillium.
Préférentiellement, dans ladite composition pour une
utilisation cosmétique non-thérapeutique, ledit Bifidobacterium animalis
ssp. lactis n LMG P-28149 et éventuellement ledit au moins un
probiotique additionnel sont encapsulés dans un véhicule
10 d'encapsulation.
Avantageusement, dans ladite composition pour une
utilisation cosmétique non-thérapeutique, ledit véhicule d'encapsulation
comprend au moins une substance choisie dans le groupe constitué de
l'alginate, du chitosan, de la pectine, du pullulan, de la gélatine, du
15 carraghénane, du gel agar ou une combinaison de ceux-ci.
Avantageusement, ladite composition pour une utilisation
cosmétique non-thérapeutique comprend au moins une source nutritive
choisie dans le groupe constitué d'un monosaccaride, d'un
polysaccharide, d'un aminoacide, d'un peptide, d'une protéine, d'une
vitamine, d'un extrait de levure, un sel d'halogénure d'un métal alcalin ou
alcalinoterreux, un antioxydant, de glycérol, d'acétate de zinc, de
chlorure de zinc, de lactate de zinc, d'acide ascorbique, d'acide citrique,
d'une huile végétale, de graisse de lait, ou une combinaison de ceux-ci.
De préférence, ladite composition pour une utilisation
cosmétique non-thérapeutique comprend en outre au moins un
prébiotique, formant ainsi une composition symbiotique.
De façon préférée, ladite composition pour une utilisation
cosmétique non-thérapeutique comprend un premier revêtement
entérique recouvrant ledit Bifidobacterium animalis ssp. lactis n LMG P-
28149 et éventuellement ledit au moins un probiotique additionnel.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
16
Avantageusement, dans ladite composition pour une
utilisation cosmétique non-thérapeutique, ledit premier revêtement
entérique est choisi dans le groupe constitué de l'éthyle cellulose, de
l'hydroxypropyle cellulose, de la carboxyméthyle cellulose, de
l'EudragitO, ou une combinaison de ceux-ci.
De façon préférée, ladite composition pour une utilisation
cosmétique non-thérapeutique comprend un deuxième revêtement
externe choisi dans le groupe constitué de l'alginate, du chitosan, de la
pectine, du pullulan, de la gélatine, du carraghénane, du gel agar, de la
cellulose, de l'hémicellulose, de l'éthyle cellulose, de la carboxyméthyle
cellulose, ou une combinaison de ceux-ci.
De façon avantageuse, ladite composition pour une
utilisation cosmétique non-thérapeutique comprend en outre un ou
plusieurs excipients biocompatibles.
D'autres formes d'utilisation cosmétique non-thérapeutique
de la composition selon l'invention sont indiquées dans les revendications
annexées.
La présente invention porte également sur un milieu de
culture du probiotique Bifidobacterium animalis ssp. lactis n LMG P-
28149 comprenant au moins une source protéique et au moins une source
de carbohydrates, ledit milieu de culture étant caractérisé en ce qu'il
comprend en outre du glutathion.
Le glutathion est un tripeptide intervenant dans le maintien
du potentiel redox du cytoplasme des cellules et dans un certain nombre
de réactions de détoxification et d'élimination d'espèces réactives de
l'oxygène.
De façon surprenante, il a été montré, dans le cadre de la
présente invention, qu'un tel milieu de culture comprenant du glutathion
optimise l'efficacité de la souche n LMG P-28149 du probiotique
Bifidobacterium animalis ssp. lactis, pour laquelle il a été observé une
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
17
action curative ou préventive sur la prise de poids corporel chez l'être
humain en surpoids ou ayant été en surpoids.
De préférence, le milieu de culture selon l'invention
comprend du glutathion en une concentration comprise entre 20 et 30 g/I
de milieu de culture.
Avantageusement, selon l'invention, ladite source protéique
dudit milieu de culture est choisie dans le groupe constitué d'une peptone
de lactosérum, d'une peptone de caséine, d'une peptone végétale ou
bactérienne, et d'une combinaison de celles-ci.
De préférence, selon l'invention, ladite source de
carbohydrates dudit milieu de culture comprend au moins un sucre ou un
mélange de sucres, lesquels sont choisis dans le groupe constitué par le
lactose, le glucose, le galactose, le fructose, la maltodextrine, l'amidon, le
tréhalose, le maltothose, et une combinaison de ceux-ci.
De préférence, selon l'invention, ledit milieu de culture
comprend en outre au moins un sucre aminé, par exemple la glucosamine
ou la galactosamine.
De préférence, selon l'invention, ledit milieu de culture
comprend en outre au moins un extrait de levure.
De préférence, selon l'invention, ledit milieu de culture
comprend en outre au moins un extrait d'ceuf.
D'autres formes du milieu de culture selon l'invention sont
indiquées dans les revendications annexées.
La présente invention porte également sur un procédé de
fabrication par fermentation du probiotique Bifidobactenum animalis ssp.
lactis n LMG P-28149, ledit procédé comprenant au moins une étape de
mise en culture dudit probiotique dans un milieu de culture selon
l'invention.
D'autres formes du procédé selon l'invention sont indiquées
dans les revendications annexées.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
18
D'autres caractéristiques et avantages de l'invention
ressortiront de la description donnée ci-après, à titre non-limitatif et en
faisant référence aux exemples décrits ci-dessous.
Ces exemples reprennent des résultats obtenus chez la
souris qui ont été complétés par des résultats obtenus in vitro à partir de
cellules immunes isolées de sang humain.
Bien que les résultats des tests repris dans les exemples 1 à
4 ci-dessous aient été obtenus chez la souris, il est entendu que des
résultats similaires attendus chez l'être humain.
En particulier, il a été démontré dans le cadre de la présente
invention, un effet spécifique à la souche sur la prise de poids corporel
chez le mammifère, en particulier chez le rongeur.
En effet, la prise de la souche LMG P-28149 du probiotique
Bifidobacterium animes ssp. Lactis, seule ou en combinaison avec au
moins un autre probiotique, induit une diminution du gain de poids corporel
conjointement à une amélioration des paramètres inflammatoires et
métaboliques chez le mammifère, en particulier le rongeur, en surpoids, y
compris la résistance à l'insuline.
En particulier, il a été démontré, dans le cadre de la présente
invention, les effets protecteurs métaboliques de la composition à base de
la souche de probiotique selon l'invention qui sont par ailleurs associés à
une restauration, au sein des tissus adipeux, de l'expression du PPARy et
du remodelage cellulaire, et d'un effet protecteur contre la stéatose
hépatique.
La composition à base de la souche selon l'invention permet
aussi une modulation de l'expression des récepteurs liés au transport des
acides gras, et en particulier une restauration des récepteurs couplés à la
protéine G (GPR41 et GPR43) impliqués dans le transport des acides
gras à chaines courtes (AGCC) qui sont les acteurs importants du
mécanisme de satiété induit par la prise de nutriments.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
19
En outre, il est démontré l'action positive de la souche selon
l'invention sur la taille des adipocytes et sur la production de cytokines et
chimiokines pro-inflammatoires (MCP-1, IL-6, TNF-alpha, etc.), certaines
d'entre elles étant directement à l'origine de la résistance à l'insuline.
Il a été observé que la souche selon l'invention permet par
ailleurs un rétablissement du profil lipidique et du métabolisme du glucose
chez le mammifère, prévenant le risque de développer des maladies
directement liées au syndrome métabolique comme la dyslipidémie (et
donc le diabète de type 2) et l'hyperglycémie.
Enfin, il a été démontré le lien entre la prise de la souche de
probiotique selon l'invention et la recolonisation du tractus intestinal par
l'Akkermansia, une bactérie réputée pour son rôle dans la prévention de
l'obésité chez l'être humain et fortement diminuée chez l'individu en
surpoids ou obèse.
La figure 1 illustre, chez la souris en cours de développement
de surpoids puis d'obésité, l'action du Ls33 sur (A) l'évolution du gain de
poids corporel (en %), (B) la tolérance au glucose (GT), (C) le poids
(masse) du tissu adipeux épididymaire (EWAT), et (D) le poids (masse) du
tissu adipeux sous-cutané (SCWAT). Les données sont exprimées en
moyenne (de 10 à 15 souris par groupe) + écart-type à la moyenne (SEM).
** p<0,01 ; *** p<0,001. * correspond à la comparaison entre le régime
enrichi en lipides (HFD) vs le régime contrôle (LFD) à traitement
interventionnel identique (mesure de l'effet du régime).
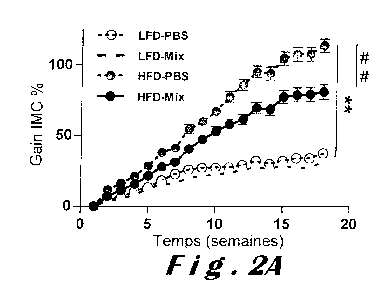
La figure 2 illustre chez la souris en cours de développement
de surpoids puis d'obésité, l'action du Mix sur (A) l'évolution du gain de
poids corporel (en %), (B) la prise cumulée de nourriture (en
gramme/jour/souris), (C) la tolérance à l'insuline (IT), et (D) la GT. Les
données sont exprimées en moyenne (de 5 à 14 souris par groupe) +
écart-type à la moyenne (SEM). **p<0,01 ; ***p<0,001 ; #p<005; e#
p>0,01 ; #44#p < 0 , 0 0 1 . * correspond à la comparaison entre le régime HFD
vs le régime LFD à traitement interventionnel identique (mesure de l'effet
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
du régime). # correspond à la comparaison entre le Mix vs le tampon
phosphate salin (PBS) à régime identique (mesure de l'effet du probiotique
ou mélange de probiotiques selon l'invention).
La figure 3 illustre chez la souris en cours de développement
5 de surpoids puis d'obésité, l'action du Mix sur (A) le poids (masse) du
EWAT, (B) le poids (masse) du SCWAT, (C) la quantité de leptine dans le
sang (ng/ml), (D) la quantité d'adiponectine dans le sang (4/m1), (E)
l'histologie du EWAT (coupes représentatives de chacun des groupes
expérimentaux), et (F) la distribution de la taille des adipocytes dans les
10 EWAT. Les données sont exprimées en moyenne (10 à 15 souris par
groupe) + écart-type à la moyenne (SEM). **p<0,01 ; ***p<0,001 ;
#p<005; "p<0,01 ; ###p<0,001. *correspond à la comparaison entre le
régime HFD vs le régime LFD à traitement interventionnel identique
(mesure de l'effet du régime). #correspond à la comparaison entre le Mix
15 vs le PBS à régime identique (mesure de l'effet du probiotique ou
mélange
de probiotiques selon l'invention).
La figure 4 illustre chez la souris en cours de développement
de surpoids puis d'obésité, l'action du Mix sur (A) la composition cellulaire
des EWAT (analyse d'expression de gènes spécifiques des
20 monocytes/macrophages (F4/80, CD68, CD1 lb, CD11c), des lymphocytes
T régulateurs (FoxP3) et de la chimiokine MCP-1), (B) la présence de
macrophages dans les EWAT (marquage immunofluorescent spécifique
de F4/80 et quantification en terme de densité intégrée [IntDen]), (C)
l'inflammation des EWAT (analyse d'expression de gènes des cytokines
pro-inflammatoires Tnfct, IL-la, IL-6 et IL-17), et (D) l'expression de PPAR
gamma (PPARy), au niveau de l'ARN messager (gauche, expression
génique) et de la protéine (centre et droit, westem-blot et quantification [en
unité arbitraire : A.U.]). Les données sont exprimées en moyenne (de 5 à
14 souris par groupe) + écart-type à la moyenne (SEM). **p<0,01 ;
***p<0,001 ; ep<0,01 ; emeeep<0,001. *correspond à la comparaison entre le
régime HFD vs le régime LFD à traitement interventionnel identique
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
21
(mesure de l'effet du régime). #correspond à la comparaison entre le Mix
vs le PBS à régime identique (mesure de l'effet du probiotique ou mélange
de probiotiques.
La figure 5 illustre chez la souris en cours de développement
de surpoids puis d'obésité, l'action du Mix sur (A) des facteurs impliqués
dans le métabolisme des lipides (analyse d'expression des gènes FABPI,
APO C//, et CD36), (B) des récepteurs aux acides gras à chaîne courte
(AGCC ou SCFA, en anglais), par analyse d'expression des gènes
GPR41 et GPR43). Les données sont exprimées en moyenne (de 5 à 14
souris par groupe) + écart-type à la moyenne (SEM). **p<0,01 ;
***p<0,001 ; ep<0,01 ; p<0,001. *correspond à la comparaison entre le
régime HFD vs le régime LFD à traitement interventionnel identique
(mesure de l'effet du régime). #correspond à la comparaison entre le Mix
vs le PBS à régime identique (mesure de l'effet du probiotique ou mélange
de probiotiques).
La figure 5(0) illustre le niveau de production des AGCC
(SCFA) totaux (gauche) et des niveaux proportionnels d'acétate, de
butyrate et de propionate (droite) après 24 et 48h d'incubation avec le
mélange probiotique Mix dans le modèle simulant l'écosystème intestinal
(SHIME), in vitro. ' comparé au temps 0.
La figure 6 illustre chez la souris en cours de développement
de surpoids puis d'obésité, l'effet du Mix sur (A) la composition du
microbiote intestinal et en particulier sur la population de Bifidobacteria et
d'Akkermansia muciniphila. (B) L'espèce de Bifidobacterium détectée chez
les souris HFD traitées ou non par le mix a été déterminée par analyse
TGGE pour 5 souris représentatives des groupes HFD-PBS et HFD-Mix.
Les marqueurs M1 ou M2 correspondent aux mélanges des souches
indiquées.*p<0,05 ; **p<0,01 ; #p<005; #tep< 0 , 0 1 . *correspond à la
comparaison entre le régime HFD vs le régime LFD à traitement
interventionnel identique (mesure de l'effet du régime). #correspond à la
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
22
comparaison entre le Mix vs le PBS à régime identique (mesure de l'effet
du probiotique ou du mélange de probiotiques selon l'invention).
La figure 7 illustre chez la souris en cours de développement
de surpoids puis d'obésité, l'action du Mix sur (A) le poids (masse) du
pancréas, du foie et de la rate, (B) l'accumulation des gouttelettes
lipidiques (stéatose, voir les coupes histologiques représentatives de
chacun des groupes expérimentaux), et (C) différents marqueurs de
l'inflammation ou impliqués dans le métabolisme lipidique ou la réponse à
l'insuline (analyse d'expression des gènes mcp-1, IL-6, TNFer, 1L-10, 1L-17,
srebp-1 c, APOCII Fabpl et 1RS2). Les données sont exprimées en
moyenne (de 5 à 14 souris par groupe) + écart-type à la moyenne (SEM).
**p<0,01 ; ***p<0,001 ; ep<0,01 ; ###p<0,001 ; e###p>0,0001. *correspond à
la comparaison entre le régime HFD vs le régime LFD à traitement
interventionnel identique (mesure de l'effet du régime). # correspond à la
comparaison entre le Mix vs le PBS à régime identique (mesure de l'effet
du probiotique ou du mélange de probiotiques selon l'invention).
Les figures 8a et 8b illustrent l'impact du probiotique
Bifidobacterium animalis ssp. lactis n LMG P-28149 suivant l'invention sur
le gain de poids au cours du temps selon que le probiotique a été cultivé
(figure 8a) ou non cultivé (figure 8b) dans un milieu de culture selon
l'invention. LFD = régime pauvre en graisse ; HFD= régime riche en
graisse ; HFD B. lactis = régime riche en graisse associé une prise de la
composition selon l'invention lorsque le probiotique est cultivé en présence
de glutathion (figure 8a) ou en absence de glutathion (figure 8b).
Le protocole suivant a été observé pour récolter les résultats
in vivo discutés dans les exemples 1 à 4 qui suivent.
Protocoles in vivo
Souris, souches de bactéries, et régimes
Les tests ont été réalisés sur des souris mâles C57BL/6J,
âgées de 5 semaines au début de l'expérimentation.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
23
La souche Ls33 de Lactobacillus L. salivarius a été fournie
par Danisco (Madison, WI, Etats-Unis).
Le mélange de probiotiques (référencé comme Mix dans les
exemples qui suivent) comprend deux souches différentes : une souche
de L. rhamnosus LMG S-28148 et une souche de Bifidobacterium animalis
ssp. lactis n LMG P-28149 dans un rapport en cfu (colony-forming units)
de 1 :1 (109 cfu total). Les régimes imposés aux souris se déclinent en un
premier régime à bas taux de graisses (LFD : D12450B ; 10% kcal
provenant de graisses) et en un second régime à haut taux de graisses
(HFD : D12492, 60% kcal provenant de graisses). Les régimes ont été
fournis par la Société Research Diet.
Protocole de traitement des animaux
5 jours consécutifs par semaine, chaque souris a reçu une
administration orale de 30 l.JL de Ls33 - 109 cfu (colony-forming units ou, le
nombre d'unités formatrices de colonie présentes dans la composition
orale) dans de l'eau stérilisée (H20) (groupe Ls33-H20), d'eau stérilisée
(groupe H20), ou du mélange de probiotiques (groupe Mix; 5 108 cfu pour
chaque souche) dans le tampon phosphate salin (PBS) (groupe Mix-PBS
ou groupe PBS).
Après une semaine de traitement, les souris traitées au
Ls33, à l'eau, au Mix, ou au PBS ont été assignées de façon aléatoire à un
régime LFD (n=5 par groupe) ou HFD (n=15 par groupe). Le poids
corporel et la prise de nourriture ont été enregistrés de manière
hebdomadaire.
Lors du sacrifice, le sang, les tissus adipeux blancs
épididymaires (EWAT) et sous-cutanés (SCWAT), le foie, la rate, l'intestin
grêle, et le pancréas ont été collectés.
Tests de tolérance à l'insuline et au glucose
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
24
Les tests de tolérance au glucose (GTT) et à l'insuline (ITT)
ont été réalisés après, respectivement 12 et 14 semaines de régime. Les
animaux ont été mis à jeun pendant une période de 6 heures avant de
recevoir une administration intra-péritonéale (IP) de glucose (D-glucose,
1g/kg de poids corporel) (GTT) ou d'insuline (0.75 Ili/kg de poids corporel)
(ITT). Les taux de glucose dans le sang ont été mesurés par un
glucomètre automatique disponible dans le commerce (par exemple, un
ACCU-CHEKO performa) sur un échantillon de sang prélevé au niveau de
la queue avant l'injection de glucose (GTT) ou d'insuline (ITT) et à
différents temps après injection de glucose (GTT) ou d'insuline (ITT).
Analyses sanguines
Les taux plasmatiques de leptine, adiponectine, MCP-1, et
insuline ont été mesurés en utilisant des trousses ELISA
commercialisées. Les taux en acide gras non-estérifiés (NEFA), en
triglycérides, en glycérol, en cholestérol HDL, et en cholestérol LDL ont été
déterminés en utilisant des trousses d'analyse disponibles sur le marché
(par exemple, le kit Abcam développé par Cambridge, GB).
Analyses histologiques et immuno-histochimigues
Les échantillons de foie et de tissus adipeux blancs (EWAT)
ont été fixés dans une solution de paraformaldéhyde à 4% , inclus ensuite
en paraffine et enfin coupés, déposés sur lame puis colorés à
l'hématoxyline éosine (H&E). L'analyse morphométrique des tissus
adipeux blancs (EWAT), au moins 10 champs (ce qui représente environs
100 adipocytes) par section a été réalisée en utilisant le programme
d'imagerie Image J (NIH image, National Center for Biotechnology
Information).
Analyses de l'expression des gènes
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
L'ARN total des fragments de tissus adipeux blancs, de foie
et d'intestin a été extrait (selon la méthode connue de l'homme de l'art)
pour être ensuite rétro-transcrit (une quantité de lpg a été retranscrite pour
chacune des catégories de tissus susmentionnées). La technique de PCR
5 (Polymerase Chain Reaction) quantitative en temps réel (RT-qPCR) a été
réalisée selon un protocole connu de l'homme de l'art.
Analyses statistiques
Les données sont exprimées en moyenne + écart-type à la
10 moyenne (SEM). Les analyses statistiques ont été réalisées en utilisant
le
test de Kruskal Wallis suivi du test de Mann-Whitney U. Les différences
entre les groupes expérimentaux sont considérées comme étant
statistiquement significatives lorsque la valeur p est inférieure à 0,05.
Le protocole suivant a été observé pour récolter les résultats
15 in vitro discutés dans les exemples 5 et 6.
Protocole in vitro
Simulateur de l'écosystème microbien humain ¨ modèle SHIME
20 Le réacteur SHIME qui simule le tractus gastro-intestinal
humain a été mis en place selon une procédure bien connue de l'homme
de l'art.
Le Mix a été ajouté dans le réacteur et les productions
d'acides gras à chaine courte (AGCC ou SOFA, en anglais) ont été
25 mesurés aux temps t=0, t=24 h, et t=48h d'incubation à 37 C sous
atmosphère anaérobie.
Eyaluation de l'effet anti-inflammatoire de la souche Bifidobacterium
animalis ssp. Iactis n LMG P-28149 sur des cellules sanguines humaines
Du sang humain frais, obtenu à partir de quatre donneurs
sains, a été dilué dans un rapport 1 :1 avec du PBS-Ca (GIBCO), déposé
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
26
sur une couche de Ficoll (GIBCO) et centrifugé à 400 xg pendant 30
minutes à 20 C.
Les cellules mononuclées du sang périphérique (PBMC) ont
été isolées du sang après centrifugation et suspendues dans un volume
final de 50 ml en utilisant du PBS-Ca, pour ensuite être lavées trois fois à
750 xg pendant 10 minutes à 20 C. Les PBMC ont ensuite été
resuspendues dans un milieu RPMI (GIBCO), complété par 10% (v/v) de
sérum de veau décomplémenté (sérum porté à 56 C pendant 30 minutes),
1% (p/v) de L-glutamine (GIBCO), et de la gentamycine (30pg/m1)
(GIBCO). Les PBMC ont été comptées et leur nombre ajusté à 2 x 106
cellules par ml. La préparation est distribuée (1mI) dans des plaques de
culture à 24 puits.
Exemple 1: Ls33 vs Mix
Cet exemple illustre l'impact du Ls33 sur le développement
du surpoids et de l'obésité chez la souris.
La figure 1 illustre, pour une cure de 15 semaines en Ls33
ou en eau et un régime en nourriture à bas taux de graisses (LFD) ou à
haut taux de graisses (HFD), les indicateurs suivants :
(A) l'évolution du gain de poids corporel, exprimé en
pourcentage par rapport au poids mesuré au jour j=0;
(B) le test de tolérance au glucose (GIT) réalisé
après 12 semaines de régime. Les taux de glucose (en mg/dl) ont été
mesurés chez les souris, directement après une période de mise à jeun de
6 heures, aux temps t (en min) indiqués sur le graphe, après injection intra-
péritonéale (IP) de glucose (qui correspond au temps t=0).
(C) le poids (masse) du tissu adipeux épididymaire
(EWAT) (en g) après 15 semaines de régime (pesé lors du sacrifice) ;
(D) le poids (masse) du tissu adipeux sous-cutané
(SCWAT) (en g) après 15 semaines de régime (pesé lors du sacrifice).
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
27
Comme le montrent les résultats présentés sur cette figure,
la souche Ls33, malgré son activité anti-inflammatoire démontrée in vitro
et dans d'autres modèles pathologiques (i.e. inflammations intestinales),
ne montre aucun effet (positif ou négatif) sur les différents indicateurs A à
D.
A l'inverse, l'administration du mélange Mix montre des effets
de protection significatifs. Ces résultats sont illustrés à la figure 2.
Cette figure illustre, après 17 semaines de traitement par le
mélange de probiotiques (Mix) ou le PBS et pour un régime à bas taux de
graisses (LFD) ou à haut taux de graisses (HFD), les résultats
correspondants :
(A) à l'évolution du gain de poids corporel (exprimé
en pourcentage par rapport au poids mesuré au jour j=0) ;
(B) à la prise cumulée de nourriture par souris et par
jour (g/jour/souris) ;
(C) au test de tolérance à l'insuline (ITT) réalisé 14
semaines après le démarrage du régime : les taux de glucose dans le
sang ont été mesurés après injection intrapéritonéale (IP) d'insuline. Les
résultats montrent les taux normalisés (en "Yo par rapport aux taux de
glucose mesurés avant injection) + SEM et les moyennes + SEM des
valeurs de l'aire sous la courbe (AUC) pour chaque courbe de glucose
normalisée après injection de l'insuline ;
(D) au test de tolérance au glucose (GTT) réalisé
après 12 semaines de régime. Les taux de glucose (en mg/dl) ont été
mesurés chez la souris après injection IP de glucose et les valeurs d'AUC
ont été calculées.
Pour le groupe de souris HFD-Mix, il a été observé un gain
de poids corporel moins important (gain de 80,97% + 4,96%) que celui
obtenu dans le groupe HFD-PBS (gain de 113,51% + 4,89%) (voir figure
2A).
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
28
Comme le montre la figure 2B, les souris du groupe HFD
traitées par le mélange de probiotiques Mix présentent une diminution de
la prise de nourriture cumulée (Food intake, FI). De manière intéressante,
les effets bénéfiques observés sur la prise de poids corporel et l'indice FI
sont apparus rapidement après le début du traitement (à partir de la
quatrième semaine).
L'administration du mélange Mix améliore l'homéostasie du
glucose pour le groupe HFD comme le montrent les taux moindres en
glucose et en insuline de la table 1 ci-dessous :
Table 1
Groupes / LFD-PBS LFD-Mix HFD-PBS HFD-Mix
Indicateurs
Glucose (mg/d1) 180,4 30,88
160,3 28,96 231,67 21,7* 198,43 15'
Insuline (ng/ml) 0,72 0,37 0,98 0,24
2,96 0,57* 1,57 0,23#
NEFA (mmo1/1) 0,85 0,06 1,07 0,07 1,06 0,03
0,9 0,08
Glycérol (mmo1/1) 0,13 0,06 0,24 0,05 0,38 0,1
0,34 0,05
Triglycéride (mmo1/1) 0,4 0,009 0,46 0,02 0,41 0,03
0,41 0,03
Cholestérol (mmo1/1) 1,35 0,05 1,33 0,05 1,94 0,04*** 1,72
HDL (mmo1/1) 1,09 0,04 1,07 0,04 1,5 0,01 *** 1,35
0,02"#
LDL (mmo1/1) 0,25 0,01 0,26 0,01 0,45
0,04*** 0,36 0,02""
Les données de cette table sont exprimées en moyenne + écart-type à la moyenne
(SEM)
(correspondant à 5 et 14 souris par groupe).* p<0,05 ; *** p<0,001 ; p<0,05;
p<0,01 ; eep , 001 .
* correspond à la comparaison entre le régime HFD vs le régime LFD à
traitement interventionnel
identique (mesure de l'effet du régime). ff correspond à la comparaison entre
le Mix vs le PBS à
régime identique (mesure de l'effet du probiotique ou du mélange de
probiotiques).
Par ailleurs, comme le montre la table 1, si les effets du Mix
restent limités aux taux de NEFA, de glycérol et de triglycérides, il
démontre une action hypocholestérolémiante puisqu'il est associé à une
diminution du taux de cholestérol total et de HDL cholestérol.
En outre, l'indice HOMA-IR ((taux d'insuline à jeun/ taux de
glucose à jeun)/22,5) est significativement réduit chez les souris du groupe
HDF-Mix, comparé au groupe contrôle (32,04 + 5,86 vs 81,57 + 19,63;
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
29
p<0,01), ce qui indique une sensibilité améliorée à l'insuline, confirmée par
les résultats du test de tolérance à l'insuline (voir figure 20).
De même, les souris traitées par le Mix sont moins
intolérantes aux injections de glucose (voir figure 2D).
Exemple 2: action du Mix sur l'inflammation des tissus adipeux
blancs
La figure 3 illustre les effets du Mix sur:
(A) le poids (masse) de l'EWAT (en g) ;
(B) le poids (masse) du SCWAT (en g) ;
(C) les quantités de leptine dans le sang (en ng/ml)
mesurés par la méthode ELISA (méthode de dosage immuno-
enzymatique) dans le sérum de souris préalablement mises à jeun
pendant 6 heures ;
(D) les quantités d'adiponectine dans le sang (en
pg/ml) mesurés par la méthode ELISA dans le sérum de souris
préalablement mises à jeun pendant 6 heures ;
(E) l'histologie des tissus adipeux épididymaires
(présentation de coupes colorées à l'hématoxyline et à l'éosine
représentatives de chacun des groupes expérimentaux). L'échelle est de
100 pm. Les flèches noires indique la présence d'infiltration cellulaire; et
(F) la distribution de la taille des adipocytes du EWAT.
Les résultats sont présentés en 'Vo d'adipocytes par classe de tailles (0-20
um, 20-40, etc.), tandis que la figure 7 illustre l'action du Mix sur:
(A) le poids (masse) du pancréas, du foie, et de la
rate (en g);
(B) l'accumulation de gouttelettes lipidiques (i.e.
stéatose) dans le foie (présentation de coupes, colorées par H&E,
représentatives de chacun des groupes expérimentaux). L'échelle est de
100 pm ; et
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
(C) l'expression de gènes codant des cytokines pro-
et anti-inflammatoires et des récepteurs impliqués dans le transport et le
métabolisme des lipides, dans le foie.
En comparaison avec les groupes contrôle HFD, le groupe
5 HFD-Mix présente une diminution marquée des masses adipeuses EWAT
et SCWAT (voir figures 3A et 3B).
Une diminution marquée des poids (masses) du pancréas,
du foie, et de la rate est également observée chez les individus du groupe
HFD-Mix (voir figure 7A).
10 En outre, alors que les souris du groupe de contrôle HFD ont
développé une stéatose hépatique, l'administration du mélange de
probiotiques Mix permet de limiter la présence de gouttelettes de lipides
dans les tissus (voir figure 7B).
En concordance avec la diminution de la masse de tissus
15 adipeux blancs, les taux
sanguins de leptine s'avèrent être
significativement plus bas dans le groupe HFD-Mix (voir figure 30), alors
que les taux d'adiponectine ont tendance à être plus élevés (voir figure
3D).
L'histologie des tissus adipeux épididymaires a montré une
20 densité plus élevée en petits adipocytes chez les souris du groupe
HFD-
Mix (voir figure 3E et 3F).
Il est à noter que, si chez les souris du groupe contrôle, les
tissus adipeux sont infiltrés de manière marquée par des cellules qui
entourent les adipocytes (marquées par une flèche sur la figure 3E), les
25 échantillons de tissus prélevés chez les souris du groupe ayant reçu
le Mix
de probiotiques sont moins marqués par cette infiltration.
Lors du développement de l'obésité, les macrophages sont
recrutés dans les tissus adipeux blancs alors que les cellules-T
régulatrices FoxP3+CD4+ quittent ces tissus.
30 La figure 4 illustre chez la souris en surpoids l'action du Mix
sur l'inflammation des tissus adipeux.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
31
Comme le montre la figure 4A, en comparaison avec les
tissus LFD contrôles, les niveaux d'expression de plusieurs marqueurs
spécifiques de monocytes/macrophages (F4/80; Cd68 ; Cd1lb ; et
Cd11c) sont augmentés chez les souris du groupe HFD alors que les taux
relatifs au marqueur Foxp3 sont diminués.
L'administration du mélange de probiotiques Mix diminue de
manière significative l'expression induite par le régime HFD des
marqueurs de monocytes/macrophages et augmente les niveaux
d'expression du marqueur Foxp3.
L'impact du mélange Mix, et donc de la souche de
probiotique selon l'invention, sur le recrutement des macrophages dans les
tissus adipeux est appuyé par les résultats illustrés à la figure 4B.
Conformément à la diminution du recrutement des
macrophages conjointement à une augmentation de l'accumulation en
lymphocytes Treg anti-inflammatoires, il est montré dans cet exemple que
les tissus adipeux épididymaires chez la souris traitée par le mélange Mix
présentent un niveau d'inflammation moindre que les tissus contrôles,
comme le démontrent les niveaux d'expression réduits pour les ARN
messagers spécifiques de I' 116, du Tnfa, de l'11-1a, et de l'11-17 (voir
figure
4C).
En outre, il est montré que le traitement à base du mélange
Mix limite la diminution en PPARy (à la fois au niveau de l'ARN messager
et de la protéine) induite par le régime HFD (voir figure 4D).
Exemple 3: action du Mix sur le métabolisme des lipides de l'intestin
grêle et la production d'acides gras à chaîne courte (AGCC/SCFA)
Il est démontré dans cet exemple que les niveaux
d'expression des gènes (GPR41 et GPR43) qui sont responsables du
transport des acides gras à chaîne courte (SCFAs, pour Short-Chain Fatty
Acids) sont diminués dans l'intestin grêle des souris soumises au régime
HFD, ce qui indique que dans le groupe HFD, les AGCC sont en moindrer
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
32
mesure d'agir positivement puisque ces derniers sont moins détectés,
tandis qu'ils sont significativement augmentés chez les animaux traités
avec le mélange Mix sous régime HFD (voir figure 5B).
Réciproquement, l'administration du Mix a pour effet de
limiter l'augmentation des gènes impliqués dans le métabolisme lipidique
induits par un régime alimentaire gras (voir figure 5A).
Exemple 4: action du Mix sur le microbiote et le niveau de
colonisation par Akkermansia muciniphila
Une analyse de certaines bactéries du microbiote a été
réalisée par PCR quantitative (qPCR) à partir du contenu caecal des souris
qui ont été soumises au régime HFD conjointement ou non à une prise du
Mix, et d'autre part, des souris soumises au régime LFD conjointement ou
non à une prise du Mix.
Les résultats illustrés à la figure 6 montrent un changement
de la composition du microbiote des souris HFD-Mix, avec en particulier
une restauration du niveau de colonisation par Akkermansia muciniphila
chez les souris soumises au régime HFD et traitées avec la souche de
probiotique ou le mélange de probiotiques selon l'invention.
Exemple 5: action du Mix sur la production d'AGCC ; utilisation du
modèle SHIME
Dans cet exemple, un modèle dynamique in vitro de
simulation de l'intestin, qui est destiné à reproduire l'écosystème microbien
de l'intestin humain, a été employé.
Comme le montrent les résultats issus de cette simulation (voir la figure
5C), l'utilisation de la souche n LMG P-28149 du probiotique
Bifidobacterium animalis ssp. Lactis permet une augmentation, dans un
délai de 48h après inoculation, de la production des AGCCs totaux (total
SCFAs), favorisant la production dans l'intestin de butyrate et de
propionate, deux métabolites qui favorisent la satiété induite par la prise
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
33
de nutriments chez l'être humain. Les taux en butyrate et propionate
produits dans le colon ascendant associé au réacteur SHIME avant (TO)
et après (T24h et T48h) incubation du mélange Mix selon l'invention sont
repris en table 2. Ces données sont exprimées en mmol/L + SED.
Table 2
Période / TO T24h T48h
Produits
Acétate 3,53 0,38 10,96 0,91 3,10 0,16
Propionate 1,10 0,03 3,87 0,51 7,07 0,16
Isobutyrate 0,00 0,00 0,24 0,05 1,30 0,05
Butyrate 0,69 0,07 3,25 0,27 12,27 0,22
Isovalérate 0,11 0,00 0,50 0,05 2,44 0,04
Isocaproate 0,00 0,00 0,00 0,00 0,00 0,00
Caproate 0,00 0,00 0,00 0,00 0,00 0,00
Total 5 ,44 0,33 18,84 1,46 26,19 0,36
Mise en évidence de l'importance du glutathion dans le milieu de
culture de la souche Bifidobacterium animalis ssp. lactis n LMG P-
28149
Les figures 8a et 8b illustrent l'impact du probiotique
Bifidobacterium animes ssp. lactis n LMG P-28149 suivant l'invention sur
le gain de poids au cours du temps selon que le probiotique a été cultivé
(figure 8a) ou non cultivé (figure 8b) dans un milieu de culture selon
l'invention.
Comme on peut le constater en comparant les figures 8a et
8b et plus particulièrement les courbes HFD B. lactis, lorsqu'un régime
alimentaire riche en graisse est associé à une prise de la composition
selon l'invention dans laquelle le probiotique Bifidobacterium animes ssp.
lactis n LMG P-28149 est obtenu par mise en culture dans un milieu de
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
34
culture comprenant du glutathion, une diminution significative du gain de
poids au cours du temps est observée (figure 8a), ce qui n'est pas le cas
lors de la prise d'une composition selon l'invention qui comprend le
probiotique obtenu par mise en culture dans un milieu de culture ne
comprenant pas de glutathion (figure 8b).
Il est bien entendu que la présente invention n'est en aucune
façon limitée aux formes de réalisations décrites ci-dessus et que bien des
modifications peuvent y être apportées sans sortir du cadre des
revendications annexées.
CA 02938790 2016-08-04
WO 2015/121458
PCT/EP2015/053166
Liste des abréviations
AGCC (SOFA) : Acide gras à chaîne courte
EVVAT : Tissus adipeux blancs épididymaires
GT(T) : (Test) de tolérance au glucose
5 HDL : Lipides à haute densité
H&E : Hématoxyline et éosine
HFD : Régime riche en graisses
IMC : Indice de Masse Corporelle
(HOMA)-IR : (Modèle homéostatique) pour apprécier la résistance à
10 l'insuline
IT(T) : (Test) de tolérance à l'insuline
(V)LDL : Lipide à (très) faible densité
LFD : Régime pauvre en graisses
NEFA : Acide gras non-estérifié
15 PBS : Tampon phosphate salin
PBMC : Cellules mononuclées du sang périphérique
SCWAT : Tissus adipeux blancs sous-cutanés
SEM : Ecart-type à la moyenne
SHIME : Simulator of the Human Intestinal Microbial Ecosystem
20 WAT : Tissus adipeux blancs