Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
1
NOUVEAUX COMPOSES DE TYPE 5-ACYLSULFANYL-HISTIDINE EN TANT
QUE PRECURSEURS DES 5-SULFANYLHISTIDINES CORRESPONDANTES ET
DE LEURS DISULFURES
La présente invention a pour objet :
- de nouveaux composés de type 5-acylsulfanyl-
histidine (et leurs dérivés) ;
- leurs procédés de préparation ;
- leur utilisation en tant que précurseurs des 5-
sulfanylhistidines correspondantes et de leurs
disulfures.
La présente invention concerne de nouveaux
composés de type 5-acylsulfanyl-histidine et leurs
dérivés, ainsi que leurs modes de préparation et leur
utilisation en tant que précurseurs des 5-
sulfanylhistidines correspondantes et de leurs
disulfures. Plus particulièrement, cette
invention
relate la synthèse de nouveaux composés de type 5-
acylsulfanyl-histidine et leurs dérivés, de leurs sels
en tant que précurseurs directs des 5-
sulfanylhistidines correspondantes et de leurs
disulfures. La nomenclature récente IUPAC sulfanyl
pour le groupement -SH est appliquée pour les
composés décrits dans l'invention au lieu des
différents termes utilisés auparavant dans la
littérature tels que
thiohistidine ,
thiolhistidine ou mercaptohistidine .
ETAT DE LA TECHNIQUE
Le groupement 5-sulfanyl-imidazole est rarement
retrouvé dans la Nature (Caroll A. et Avrey V.M. ; J.
Nat. Prod. ; 2009 ; 72 ; 696-699). Très peu de produits
naturels comportant un squelette 5-sulfanyl-histidine
(méthylé ou non en position 3 du noyau imidazole) ont
été mis en évidence à ce jour (Hand C.E. et Honek J.F.;
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
2
J. Nat. Prod.; 2005 ; 68 ; 293-308). Ils sont d'origine
bactérienne ou marine pour la plupart. Un premier
exemple est constitué par le groupe des adénochromines
A, B et C (Ito S. et Prota G. ; JCS Chem. Comm. ;
1977 ; 251-252 ; Rossi F., Nardi G., Palumbo A. et
Prota G. ; Comp. Biochem. Physiol. 1985, 80b, 843-845)
et des séco-adénochromines A, B et C (Ito S., Nardi G.
et Prota G. ; JCS Chem. Comm. ; 1976 ; 1042).
L'imbricatine, produite par Dermasterias imbricate,
constitue un second exemple (Pathirana C. et Andersen
R.J. ; J. Am. Chem. Soc. ; 1986 ; 108, 8288-8289). Les
ovothiols A, B et C (Turner E., Klevit R.E. et Shapiro
B.M. ; J. Biol. Chem. ; 1986 ; 261 ; 13056) constituent
un troisième exemple du groupe encore plus restreint de
produits naturels comportant un squelette 5-sulfanyl-
histidine méthylé en position 3 (A noter que la
position du groupement méthyle a été, initialement,
faussement localisée sur l'azote Ni de l'histidine,
comme ceci a été démontré dans Holler et al. JOC 1987,
4421-4423 vs. Palumba et al., TEL 1982, 3207-3208).
Très récemment un nouvel alcaloïde indolique, contenant
un squelette 5-sulfanyl-histidine, la leptoclinidamine
C a été mis en évidence (Caroll A. et Avrey V.M. ; J.
Nat. Prod. ; 2009 ; 72 ; 696-699).
La biosynthèse des ovothiols A, B et C a été
décrite (Vogt R.N., Spies H.S.C. et Steenkamp D.J. ;
Eur. J. Biochem. ; 2001, 268, 5229-5241).
L'introduction du soufre, en position 5 du noyau
imidazole de la L-histidine, est réalisée en présence
de l'enzyme sulfoxyde synthase (OvoA), ainsi que de fer
ferreux (Fe2) et d'oxygène 02. La L-cystéine est
utilisée comme donneur de soufre pour aboutir à un
intermédiaire sulfoxyde (Braunshausen A. et Seebeck
F. ; JACS ; 2011 ; 133, 1757). Ce dernier est ensuite
transformé en ovothiol A, B ou C en présence de
l'enzyme sulfoxyde lyase et de phosphate de pyridoxal,
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
3
son cofacteur (Mashabela G. et Seebeck F. ; JCS Chem.
Comm. ; 2013, 7714-7716).
La préparation de la 2-sulfanylhistidine et de
ses dérivés par synthèse chimique a déjà été documentée
par la Demanderesse (brevet US 13/121,891 et brevet US
13/500,887 Al).
La préparation de la 5-sulfanylhistidine et de
ses dérivés par synthèse chimique s'est avérée
W beaucoup
plus difficile que celle de leurs isomères 2-
sulfanylhistidines. Plusieurs stratégies de synthèse
ont été envisagées et testées sans succès. A ce jour,
seules 2 voies d'accès ont permis d'aboutir uniquement
à la série des 5-sulfany1-3-méthyl-histidines. La
première approche a consisté en la synthèse de novo du
noyau 5-sulfanyl-imidazole (Hopkins P. et al. ; JOC ;
1987, 52, 2977 et 4420) dans le cadre de la synthèse
des ovothiols A et C en 10 à 12 étapes. La seconde
approche a consisté en une substitution nucléophile
d'un noyau 5-bromo-imidazole activé par un groupement
électro-attracteur carboxaldéhyde CHO (Ohba M.,
Nishimura Y., Kato M. et Fujii T. ; Tetrahedron ;
1999, 55, 4999-5016) dans le cadre de la synthèse de
l'imbricatine. Actuellement il n'existe aucune méthode
chimique non-enzymatique connue d'introduction directe
d'un atome de soufre sur l'histidine ou l'un de ses
dérivés en position 5 du noyau imidazole.
L'article de SPALTENSTEIN dans the journal of
organic chemistry, vol 52, N 14, P 2977-2979,
divulgue un procédé de préparation d'un composé 8
(p.2978) obtenu par cyclisation du thionoamide
correspondant mais celui-ci ne peut correspondre à
aucun composé de l'invention au vu des éléments
techniques suivants.
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
4
De même, l'article de Heng Song dans Organic
Letters, Vol 15, N 18, 20 septembre 2013, P 4854-
4857, intitulé Regioselectivity of the oxidative C-
S Bond Formation in Ergothioneine and Ovothiol
Biosyntheses divulgue un composé Ovothiol (8)
(p.4855, schéma 1) mais qui ne correspond à aucun
composé de l'invention au vu des éléments techniques
suivants.
En effet, comme précédemment évoqué page 2 ligne
W 16-20, la
structure initiale des Ovothiols A, B et C a
été incorrectement définie dans ces deux articles de
SPALTENSTEIN et Song par rapport au positionnement du
groupement méthyle sur l'azote du cycle imidazole de
l'histidine. Initialement faussement localisée sur
l'azote Ni de l'histidine, ce groupement méthyle a été
repositionné sur l'azote N3 comme ceci a été
démontré dans Haller et al. JOC 1987,20 4421-4423 vs.
Palumba et al., THL 1982, 3207-3208).
Ainsi, la structure des Ovothiols A, B et C est bien
établie suite à la publication de Haller et al. (JOC
1987,20 4421-4423, déjà citée dans la demande et
acceptée par la communauté scientifique d'après les
exemples suivants :
Ovothiol C : voir Bailly et al., Bioorg. Med.
Chem., 2003, 11, 4623-4630 figure 1 p. 4624 ;
Ovothiols A, B et C : voir De Luna et al., J. Phys.
Chemistry, 2013, DOI: 10.1021/jp402514w ;
Ovothiol A : voir Mashabela et al., Chem. Comm.,
2013, 49, 7714- 7716.
Comme les documents SPALTENSTEIN et Song sont basés
sur la localisation erronée du méthyle en position
Ni, alors qu'il doit être correctement localisé en
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
position N3, ceci a pour conséquence que le composé 8
de SPALTENSTEIN ou de Song (avec la structure
rectifiée) correspond au proviso de la formule (II) de
l'invention décrite ci-après.
5 Les
composés de type 5-acylsulfanyl-histidine et
leurs dérivés constitueraient de très bons précurseurs
de 5-sulfanylhistidine et de ses dérivés. Ces composés
de type 5-acylsulfanyl-histidine et leurs dérivés
n'étant pas connus, il faudrait donc pouvoir disposer
W d'une
méthode de synthèse qui permette d'introduire
directement un groupement acylsulfanyle en position 5
d'une histidine. Une telle méthode, à notre
connaissance, n'a jamais été décrite jusqu'à ce jour.
Cette nouvelle méthode d'introduction directe d'un
groupement acylsulfanyle en position 5 de l'histidine
ou de l'un de ses dérivés serait d'autant plus
intéressante qu'elle pourrait être réalisée sans
groupement protecteur et dans l'eau comme solvant de
réaction.
BUTS DE L'INVENTION
L'un des buts de la présente invention est donc
de mettre à disposition de nouveaux composés de type 5-
acylsulfanyl-histidine et leurs dérivés susceptibles
d'être des précurseurs des 5-sulfanylhistidines
correspondantes et de leurs disulfures.
Un autre but de la présente invention est un
procédé de préparation de ces nouveaux composés de type
5-acylsulfanyl-histidine et leurs dérivés utilisant une
nouvelle méthode d'introduction directe d'un groupement
acylsulfanyle en position 5 d'une histidine ou de l'un
de ses dérivés sans groupement protecteur et dans l'eau
comme solvant.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
6
Un autre but de la présente invention est
l'utilisation de ces nouveaux composés de type 5-
acylsulfanyl-histidine et leurs dérivés en tant que
précurseurs des 5-sulfanylhistidines correspondantes et
de leurs disulfures.
Ces buts sont atteints grâce à la présente
invention qui repose sur la conception et la
préparation de nouveaux composés de type 5-
acylsulfanyl-histidine et de leurs dérivés qui
W s'avèrent
être d'excellents précurseurs des 5-
sulfanylhistidines correspondantes et de leurs
disulfures en utilisant une nouvelle méthode
d'introduction d'un groupement acylsulfanyle. Ceci a
été exemplifié par la Demanderesse.
DESCRIPTION DE L'INVENTION
La présente invention a donc pour but :
1) de
résoudre le problème technique consistant
en la fourniture de nouveaux composés de type 5-
acylsulfanyl-histidine et leurs
dérivés,
constituant ainsi des précurseurs des 5-
sulfanylhistidines correspondantes et de leurs
disulfures;
2) de résoudre ce
problème technique selon une
solution qui englobe un procédé de préparation de
ces nouveaux dérivés 5-acylsulfanyl-histidine en
utilisant une nouvelle méthode d'introduction
directe d'un groupement acylsulfanyle en position
5 du noyau imidazole d'une histidine sans
groupement protecteur et dans l'eau comme solvant
de réaction.
Les problèmes techniques énoncés ci-dessus sont
résolus pour la première fois d'une manière simultanée
par la présente invention, de façon très aisée et
économique, le procédé de préparation desdits nouveaux
dérivés 5-acylsulfanyl-histidine étant très simple à
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
7
mettre en uvre tout en fournissant de bons
rendements.
Selon son premier aspect, la présente invention a
pour objet de nouveaux composés de type 5-acylsulfanyl-
histidine et leurs dérivés répondant à la formule générale
(I) suivante :
R5
0
0
)_(--- -."-o -
1 0 S5 4 + 4
-- N¨R
N12)N
R1 Nr R2\ R3
(I)
Dans laquelle :
RI- = H, alkyle, en particulier CH3 ;
R2 = R3 = H, alkyle, en particulier CH3 ;
R4 = H, alkyle, en particulier CH3, alkyle(C=0),
alkyle substitué(C=0), aryle(C=0),p-alanyle (H2NCH2CH2 (C=0) ;
a-amino-acyle ;
R5 = alkyle, en particulier méthyle, phényle ;
L'invention englobe tous les stéréoisomères,
diastéréoisomères et énantiomères notamment au niveau de
l'atome de carbone portant le groupement COOH, pris
isolément ou en mélange.
Elle englobe également tous les sels d'acides
pharmaceutiquement acceptables desdits composés de formule
générale (I).
Parmi les composés de formule générale (I), l'invention a
notamment pour objet :
- ceux caractérisés en ce que R4 représente hydrogène,
ou le groupe méthyle, ou le groupe acétyle, ou le
groupe benzoyle, ou le groupe 43-
alanyle (H2NCH2CH2 (C=O);
- ceux préparés dans la partie expérimentale,
notamment
1. la L-5-acétylsulfanyl-histidine (Composé 1) ;
CA lu 949n4 2016-11-16
WO 2015/181507
PCT/FR2015/051416
8
2. la L-5 -
acétylsul f anyl -cx , N, N (diméthyl) -histidine
(Composé 2) ;
3. la L-5-
acétylsulfanyl-a,N,N,N(triméthyl)-histidine
(Composé 3) ;
4. la L-5-
acetylsulfanyl-a,N(glyciny1)-histidine
(Composé 4)
5. la L-5-
acetylsulfanyl-a,N,N(diméthyl)-1-méthyl-
histidine (Composé 5)
6. la L-5-
acétylsulfanyl-a,N,N,N(triméthyl)-1-méthyl-
histidine (Composé 6)
7. la L-5-
acetylsulfanyl-a,N(L-alany1)-histidine
(Composé 7)
8. la L-5-
acétylsulfanyl-a,N(pentanoy1)-histidine
(Composé 8)
9. la L-5-
acétylsulfanyl-a,N(méthyl)-histidine
(Composé 9) ;
10. la L-5-
acétylsulfanyl-a,N(acéty1)-histidine
(Composé 10) ;
11. la L-5-acétylsulfanyl-a,N(benzoy1)-histidine
(Composé 11) ;
12. la L-5-acétylsulfanyl-a,N(p-alany1)-histidine
(Composé 12) ;
13. la L-1-méthy1-5-acétylsulfanyl-histidine (Composé
13) ;
14. la L-5-benzoylsulfanyl-histidine (Composé 14) ;
15. la L-5-benzoylsulfanyl-a,N,N(diméthyl)-histidine
(Composé 15) ;
16. la L-5-benzoylsulfanyl-a,N,N,N(triméthyl)-histi-
dine (Composé 16)
17. la L-5-
acétylsulfanyl-a,N(L-phénylalany1)-
histidine (Composé 17).
Parmi les acides pharmaceutiquement acceptables, on
peut citer, à titre non limitatif, les acides minéraux tels
que chlorhydrique, bromhydrique, iodhydrique, sulfurique,
tartrique, phosphorique ou avec les acides organiques tels
que les acides formique, acétique, trifluoro-acétique,
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
9
propionique, benzoïque, maléique, fumarique, succinique,
citrique, oxalique, glyoxylique, aspartique, alcane-
sulfoniques tels que les acides méthane-sulfonique,
trifluorométhane-sulfonique, éthane-sulfonique, aryl-
sulfoniques tels que les acides benzène- et paratoluène-
sulfonique.
Dans la formule (I) ci-dessus :
- par radical alkyle, il est entendu un groupement
W comportant 1 à 6 atomes de carbone linéaire ou cyclique,
éventuellement ramifié,
- par radical alkyle substitué, il est entendu un
groupement alkyle substitué par un ou plusieurs atomes de
fluor, ou substitué par un groupement alkényle comportant
une ou plusieurs doubles liaisons carbone-carbone, ou
substitué par une ou plusieurs fonctions OH ou SH ou NH2 ou
COOH, ainsi que leurs énantiomères, et leurs
diastéréoisomères.
- par radical aryle, il est entendu un groupement
phényle éventuellement fluoré ou polyfluoré, et comportant
éventuellement une ou plusieurs fonctions OH ou SH ou NH2
ou COOH
- par radical a-amino-acyle, il est entendu le radical
acyle de tout amino-acide protéogénique, c'est à dire tout
amino-acide entrant dans la composition des protéines
retrouvées dans le monde végétal, animal, y compris
l'homme.
Selon un second aspect, l'invention a également pour
objet un procédé A de préparation des nouveaux composés de
type 5-acylsulfanyl-histidine et leurs dérivés de formule
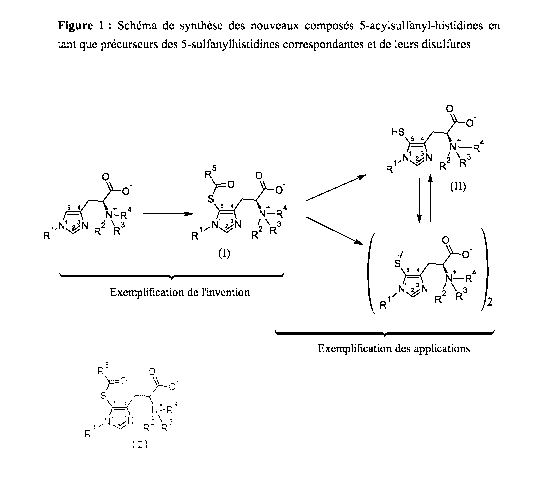
générale (I), explicité sur la Figure 1 jointe, et
caractérisé en ce qu'il comprend les étapes suivantes :
1) La réaction de l'histidine, racémique (DL) ou l'un
de ses énantiomères (D ou L) , ou
- l'un de ses dérivés alkylé sur l'azote en
position 1 du noyau imidazole,
racémique (DL) ou
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
l'un de ses énantiomères (D ou
L) ,
ou
- l'un de ses dérivés alkylé ou acylé sur l'azote
de la fonction a-amine, racémique (DL) ou
l'un
5 de ses énantiomères (D ou
L),
ou
- l'un de ses dérivés alkylé sur l'azote en
position 1 du noyau imidazole et alkylé ou acylé sur
l'azote de la fonction a-amine, racémique (DL) ou
W l'un de ses énantiomères (D ou L),
en présence de 1 à 2 équivalents d'acide minéral ou
organique, avec
a) un agent générateur d'ion halogénium X dans un
solvant protique polaire, à température comprise
entre 0-25 , puis avec
b) un réactif soufré de type acide carbothioïque de
formule alkyle C(=0)SH ou l'un de ses sels dans un
solvant protique polaire,
2) puis éventuellement la purification
par
chromatographie liquide sur colonne ou toute autre
méthode de purification bien connue de l'Homme de
l'Art.
Selon un mode de réalisation particulier du procédé A selon
l'invention : l'agent générateur d'ion halogénium X' peut
être :
a) du brome Br2 (en tant que réactif commercial ou
préparé in situ); ou
b) du NBS ou tout dérivé N-bromo-imide et N-bromo-
amide
Selon un autre mode de réalisation particulier de ce
procédé A selon l'invention, le solvant protique polaire
peut être de l'eau ou une solution aqueuse.
Selon encore un mode de réalisation particulier du procédé
A selon l'invention, le réactif soufré
de type acide
carbothioïque peut être par exemple l'acide thioacétique;
ou l'acide thiobenzoïque, ou leurs mélanges.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
H
Selon un autre mode de réalisation particulier du procédé A
selon l'invention, le réactif soufré de type sel d'acide
carbothioïque peut être par exemple le thioacétate de
potassium, éventuellement en mélange avec un acide
carbothioïque précité.
Selon encore un autre mode de réalisation particulier de ce
procédé A selon l'invention, la température sera comprise
entre 0-5 C.
Le caractère innovant de ce procédé A repose sur une
nouvelle réaction d'introduction directe d'un groupement
acylsulfanyle RC(=0)S en position 5 du noyau imidazole de
l'histidine ou de l'un de ses dérivés sans utilisation de
groupement protecteur et dans l'eau comme solvant de
réaction. Ceci est d'autant plus surprenant que, dans les
mêmes conditions opératoires, l'utilisation de la cystéine
en lieu et place de l'acide carbothioïque conduit à une
introduction du soufre en position 2 du noyau imidazole
comme montré dans le brevet US 13/121,891 et le brevet US
13/500,887 Al.
Selon un troisième aspect, la présente invention a pour
objet l'utilisation des composés 5-acylsulfanyles précités
de formule (I) ou de ses dérivés, pour la préparation de
composés 5-sulfanyle-histidines correspondants et leurs
disulfures décrits ci-après.
Selon un quatrième aspect, l'invention couvre de
nouveaux composés de type 5-sulfanylhistidine et leurs
dérivés répondant à la formule générale (II) suivante :
0
_
0
HS
5 4 + 4
¨ N¨R
N1 3N 2 \ 3
Ri Nr R R
(Il)
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
12
Dans laquelle :
R1 à R4
sont tels que définis pour les radicaux
Rl à R4 de la formule (I), en particulier : Rl = H, alkyle,
en particulier CH3 ; R2 = R3 = H, alkyle, en particulier
CH3 ;
R4 = H, alkyle, en particulier CH3, alkyle(C=0),
alkyle substitué(C=0), aryle(C=0), 43-
alanyle (H2NCH2CH2 (C=O); a-amino-acyle ;
étant entendu que lorsque Rl = H alors R2, R3 et
R4 ne peuvent pas être simultanément H.
L'invention englobe tous les stéréoisomères,
diastéréoisomères et énantiomères notamment au niveau de
l'atome de carbone portant le groupement COOH, ainsi que
tous les disulfures correspondants, pris isolément ou en
mélange.
Elle englobe également tous les sels d'acides
pharmaceutiquement acceptables desdits composés de formule
générale (II).
Parmi les composés de formule générale (Il),
l'invention a notamment pour objet :
- ceux caractérisés en ce que R4 représente hydrogène,
ou le groupe méthyle, ou le groupe acétyle, ou le
groupe benzoyle, ou le groupe 43-
alanyle (H2NCH2CH2 (C=0) ;
- ceux préparés dans la partie expérimentale,
notamment :
1. le disulfure de la L-5-
sulfanyl-a,N(méthyl)-
histidine (Composé 22) ;
2. la L-5-sulfanyl-a,N(méthyl)-histidine (Composé 23) ;
3. le disulfure de la L-5-sulfanyl-N,N(diméthyl)-
histidine (Composé 24) ;
4. la L-5-sulfanyl-a,N,N(diméthyl)-histidine
(Composé
25) ;
5. la L-5-sulfanyl-
a,N,N,N(triméthyl)-histidine
(Composé 26) ;
CA lu 949n4 2016-11-16
WO 2015/181507
PCT/FR2015/051416
13
6. le disulfure de la L-5-sulfanyl-cx,N,N,N(triméthyl)-
histidine (Composé 27) ;
7. le disulfure de
la L-5-sulfanyl-a,N(acéty1)-
histidine (Composé 28) ;
8. la L-5-sulfanyl-a,N(acéty1)-histidine (Composé 29) ;
9. la L-5-sulfanylcarnosine (Composé 30) ;
10. le disulfure de l'iso-ovothiol A (Composé 31) ;
11. l'iso-ovothiol A (Composé 32) ;
12. le disulfure de la L-5-sulfanyl-a,N,N(diméthyl)-
1-méthyl-histidine (Composé 33) ;
13. la L-5-sulfanyl-a,N,N,N(triméthyl)-1-méthyl-
histidine (Composé 34) ;
14. la L-5-sulfanyl-a,N(L-alany1)-histidine (Composé
35) ;
15. le disulfure de la 5-sulfanyl-a,N(pentanoy1)-
histidine (Composé 36).
Parmi les acides pharmaceutiquement acceptables, on
peut citer, à titre non limitatif, les acides minéraux tels
que chlorhydrique, bromhydrique, iodhydrique, sulfurique,
tartrique, phosphorique ou avec les acides organiques tels
que les acides formique, acétique, trifluoro-acétique,
propionique, benzoïque, maléique, fumarique, succinique,
citrique, oxalique, glyoxylique, aspartique, alcane-
sulfoniques tels que les acides méthane-sulfonique,
trifluorométhane-sulfonique, éthane-sulfonique, aryl-
sulfoniques tels que les acides benzène- et paratoluène-
sulfonique.
Dans la formule (II) ci-dessus :
- par radical alkyle, il est entendu un groupement
comportant 1 à 6 atomes de carbone linéaire ou cyclique,
éventuellement ramifié,
- par radical alkyle substitué, il est entendu un
groupement alkyle substitué par un ou plusieurs atomes de
fluor, ou substitué par un groupement alkényle comportant
une ou plusieurs doubles liaisons carbone-carbone, ou
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
14
substitué par une ou plusieurs fonctions OH ou SH ou NH2 ou
COOH, ainsi que leurs énantiomères, et leurs
diastéréoisomères.
- par radical aryle, il est entendu un groupement
phényle éventuellement fluoré ou polyfluoré, et comportant
éventuellement une ou plusieurs fonctions OH ou SH ou NH2
ou COOH
- par radical a-amino-acyle, il est entendu le radical
acyle de tout aminoacide protéogénique, c'est à dire tout
aminoacide entrant dans la composition des protéines
retrouvées dans le monde végétal, animal, y compris
l'homme.
- par disulfure, il est entendu tout composé obtenu par
oxydation entre deux molécules identiques de dérivés de
type 5-sulfanylhistidine décrits dans l'invention.
Les nouveaux composés de type 5-sulfanylhistidine et
leurs dérivés répondant à la formule générale (II), ainsi
que leurs disulfures, pourraient s'avérer être des
principes actifs nutritionnels, cosmétiques ou
médicamenteux.
Selon un cinquième aspect, l'invention a encore pour
objet un procédé B de préparation des composés de type 5-
sulfanylhistidine et de leurs dérivés de formule générale
(II) obtenus à partir des composés de type 5-acylsulfanyl-
histidine et de leurs dérivés de formule générale (I)
décrit dans le procédé A ci-dessus, et caractérisé en ce
qu'il comprend les étapes suivantes :
1) Soit directement (procédé B1) :
a) par hydrolyse des dérivés 5-acylsulfanyl-
histidine obtenus selon l'invention dans un
solvant protique polaire par agitation à
température supérieure à 20 C en présence d'un
thiol,
b) puis éventuellement purification par
chromatographie liquide sur colonne ou tout autre
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
méthode de purification bien connue de l'Homme de
1' Art.
2) Soit indirectement (procédé B2) :
5 a) par hydrolyse des dérivés 5-
acylsulfanyl-
histidine obtenus selon l'invention dans un
solvant protique polaire par agitation à une
température supérieure à 20 C pour obtenir le
disulfure correspondant,
W b) puis réduction du disulfure par réaction avec un
thiol,
c) puis éventuellement purification par
chromatographie liquide sur colonne ou tout
autre méthode de purification bien connue de
15 l'Homme de l'Art.
Selon une mise en uvre particulière de ce procédé B selon
l'invention, le solvant protique polaire peut être de l'eau
ou une solution aqueuse.
Selon une autre mise en uvre particulière du procédé B
selon l'invention, le thiol peut être par exemple l'acide
mercaptopropionique ou le dithiotréitol, ou leurs mélanges.
Selon encore une autre mise en uvre particulière de ce
procédé B selon l'invention, la température pourra être
comprise entre 20 et 130 C.
Par cet aspect, la Demanderesse démontre la capacité des
composés de formule générale (I) à être des précurseurs de
composés de type 5-sulfanylhistidine et de leurs dérivés de
formule générale (II) après hydrolyse.
Selon un sixième aspect, l'invention a également pour
objet un procédé C de préparation de disulfures des 5-
sulfanylhistidines et de leurs dérivés :
1) soit directement à partir des composés de type 5-
acylsulfanyl-histidine et de leurs dérivés de formule
générale (I) caractérisé en ce qu'il comprend les étapes
suivantes :
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
16
a) hydrolyse des dérivés 5-acylsulfanyl-histidines de
formule générale (I) obtenus selon
l'invention dans un solvant protique polaire par
agitation à l'air et à une température supérieure à
20 C pour obtenir le disulfure correspondant,
b) puis éventuellement
purification par
chromatographie liquide sur colonne ou tout autre
méthode de purification bien connue de l'Homme de
l'Art ;
2) soit à partir de 5-sulfanylhistidines et de leurs
dérivés de formule générale (II) caractérisé en ce qu'il
comprend les étapes suivantes :
a) oxydation par l'oxygène ou le diméthylsulfoxyde ou
toute autre méthode d'oxydation bien connue de
l'Homme de l'Art,
b) puis éventuellement
purification par
chromatographie liquide sur colonne ou tout autre
méthode de purification bien connue de l'Homme de
l'Art.
Par cet aspect, la Demanderesse démontre la capacité des
composés de type 5-acylsulfanyl-histidines de formule
générale (I) à être des précurseurs de disulfures de 5-
sulfanylhistidines et de ses dérivés après hydrolyse et
oxydation.
Selon un septième aspect, l'invention a également pour
objet un procédé D en one-pot de préparation des
dérivés 5-sulfanylhistidines et leurs disulfures
correspondants à partir des dérivés histidines
correspondants, en combinant les procédés A avec B ou avec
C, et caractérisé en ce qu'il comprend les étapes
suivantes :
en présence de 1 à 2 équivalents d'acide minéral ou
organique, la réaction avec :
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
17
a) un agent générateur d'ion halogénium X+ dans un
solvant protique polaire, à température comprise
entre 0-25 , puis avec
b) un réactif soufré de type acide carbothioïque de
formule alkyle C(=0)SH ou l'un de ses sels dans un
solvant protique polaire,
suivie de
1) Soit :
c) l'hydrolyse des dérivés 5-acylsulfanyl-histidine
obtenus dans un solvant protique polaire par
agitation à température comprise entre 70 et
130 C en présence d'un thiol,
d) puis éventuellement la purification par
chromatographie liquide sur colonne ou tout autre
méthode de purification bien connue de l'Homme de
l'Art.
2) Soit :
d) par hydrolyse des dérivés 5-
acylsulfanyl-
histidine obtenus dans un solvant protique
polaire par agitation à une température comprise
entre 70 et 130 C pour obtenir le disulfure
correspondant,
e) puis éventuellement
purification par
chromatographie liquide sur colonne ou tout
autre méthode de purification bien connue de
l'Homme de l'Art.
DESCRIPTION DES FIGURES
L'invention comprend 4 Figures.
Figure 1 : Schéma du procédé de synthèse des composés selon
la formule générale (I)
Figure 2 : Spectre représentatif (RMN-H1 , 400MHz) du
mélange réactionnel obtenu dans l'exemple 1, préparation de
la L-5-acétylsulfanyl-histidine (Composé 1)
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
18
Figure 3 : Spectre représentatif (RMN-HI, 400MHz) du
mélange réactionnel obtenu dans l'exemple 3, préparation de
la L-5-acétylsulfanyl-N,N(diméthyl)-histidine (Composé 2)
Figure 4 : Spectre représentatif (RMN-HI, 400MHz) du
mélange réactionnel obtenu dans l'exemple 5, préparation de
la L-5-acétylsulfanyl-N,N,N(triméthyl)-histidine (Composé
3)
W DESCRIPTION DES EXEMPLES :
Les exemples ci-après de même que le schéma du procédé
de l'invention (voir Figure 1) sont fournis simplement à
titre d'illustration et ne sauraient en aucune façon
limiter la portée de l'invention.
Dans les exemples, décrits ci-après, la température est
soit la température ambiante soit une température donnée en
degré Celsius, et la pression est la pression
atmosphérique, sauf indication contraire.
Les réactifs utilisés sont disponibles commercialement
chez des fournisseurs internationaux tel que SAF (France),
Alfa Aesar, Fisher Scientific, TCI Europe, Bachem (Suisse,
AKOS (Allemagne) sauf les composés suivants : N-méthyl-
histidine hydrochloride, N,N-
diméthyl-histidine
hydrochloride hydrate et L-hercynine qui ont été préparé
selon les protocoles cités.
Toutes les expériences sont réalisées sous atmosphère
ambiante sauf indication contraire.
Les analyses RMN-H1 ont été enregistrées à 400 MHz ou
à 300 MHz dans le D20 ou un mélange D20/DC1, en utilisant
le signal de HOD (4.79 ppm) comme référence interne. Les
déplacements chimiques sont notés en ppm, et la
multiplicité des signaux indiqués par des symboles
suivants : s (singlet), d (doublet), t (triplet), q
(quartet), et m (multiplet). Les constantes de couplages
sont notées en hertz (Hz). Les analyses RMN-C13 sont
enregistrées à 75 MHz dans le D20 ou D20/DC1. Les analyses
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
19
de masse sont obtenues par ionisation chimique à pression
atmosphérique (APCI-MS). Les points de fusion ont été
mesurés avec un appareil de la société Stuart Scientific.
Les analyses HPLC ont été effectuées sur un appareil
Acquity (Waters), en utilisant deux types des colonnes : A.
colonne Kromasil Diol 250x4,6 (5pm). La phase mobile
utilisée est un mélange du solvant A (10/90
H20/Acétonitrile + 0,05% TFA) et du solvant B (50/50
H20/Acétonitrile + 0,05% TFA), avec un gradient variant en
W 10 minutes de 90% A à 100% B et un débit de 1,2 ml/min. B.
Colonne du type Thermo Hypercarb 100x4,6 (5pm). La phase
mobile utilisée est un mélange du solvant A (100% H20 +
0,2% HCOOH) et du solvant B (100% Acétonitrile + 0,2%
HCOOH), avec un gradient variant en 8 minutes de 100% A à
40% A et un débit de 1 ml/min. La détection s'effectue avec
un détecteur universel ELSD (Sedere).
I- Préparation des dérivés 5-acylsulfanyl-histidines en
tant que précurseurs des 5-sulfanylhistidines et de leurs
disulfures
Dans le premier paragraphe sont donnés des exemples de
préparation des dérivés 5-acylsulfanyl-histidines par
activation avec le dibrome ou le N-bromosuccinimide (NBS)
et réaction de l'intermédiaire formé avec l'acide
thioacétique.
Dans le deuxième paragraphe sont donnés des exemples
d'utilisation de ces dérivés 5-acylsulfanyl, préparés
généralement in situ, en tant que précurseur de 5-
sulfanylhistidines et ses dérivés.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
I-1. Préparation des dérivés 5-acylsulfanyl-histidines par
activation avec le dibrome ou avec le N-bromosuccinimide
(NBS) et réaction avec l'acide thioacétique
Exemple 1 : Préparation de la L-5-acétylsulfanyl-histidine
5 (Composé 1) par activation avec le dibrome et réaction avec
l'acide thioacétique
0 1. HCI 0
F)_ \--OH
2. Br2
--------11.
,OH
= --?-11-12 -- NH
NN NH 3.CH300SH NN NH
Composé 1
Le chlorhydrate de la L-histidine monohydratée (52,93 g ;
10 250 mmoles; 1 éq.) est dissout dans 1,5 1 d'eau
déminéralisée, puis la solution est refroidie à 0 C en 30
minutes. Sous une forte agitation, le dibrome (16,7 ml ;
51,93 g; 325 mmoles; 1,3 éq.) est ajouté goutte à goutte
très rapidement. La solution vire au rouge. L'acide thio-
15 acétique (73,3 ml ; 78,46 g; 1 mole; 4 éq.) est additionné
très rapidement : la solution se décolore immédiatement et
passe du rouge au jaune clair. L'agitation est maintenue
vigoureuse à 0 C pendant lh.
Le composé 1 est obtenu avec un rendement réactionnel de
20 72% molaire tel que calculé à partir du spectrogramme RMN-
Hl.
RMN-H1 (D20 pH -1, 400 MHz) d'un échantillon du mélange: ô
(ppm) = 2,57 (s, 3H); 3,38 (dd, J= 15,6 Hz et J=6,8 Hz,
1H); 3,47 (dd, J=15,6 Hz, J=7,8 Hz, 1H); 4,34 (dd, J=7,8 Hz
et J=6,8 Hz, 1H); 8,94 (s, 1H).
Un singulet correspondant à l'excès d'acide thio-acétique
est détecté à 2,48 ppm, ainsi que des signaux de faible
intensité correspondants aux produits secondaires, tel que
l'acide acétique détecté à 2,Oppm. Un spectre représentatif
est inclus dans la Figure 2.
LCMS (APCI): 228,0 [M-HF
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
21
Exemple 2 : Préparation de la L-5-acétylsulfanyl-histidine
(Composé 1) par activation avec le N-bromosuccinimide et
réaction avec l'acide thioacétique
0 0
OH
1.HCIs)_:1H¨OH
¨("-- NH2 2. NBS ¨ NH2
F¨¨
N, NH N, NH
3. CH,COSH
Composé 1
Le chlorhydrate de la L-histidine monohydratée (10,48 g ;
50 mmoles; 1 éq.) est dissout dans 300 ml d'eau
déminéralisée contenant une solution d'acide chlorhydrique
concentré à 37% (4,17 ml ; 4,92 g; 50 mmoles; 1 éq.) puis
la solution est refroidie à 0 C. L'agitation est maintenue
très forte. Le N-bromosuccinimide (11,56 g ; 65 mmoles; 1,3
éq.) est ajouté en une seule portion: le mélange devient
orange limpide après 30 secondes. La température monte à
1 C. Après 2 minutes 30 secondes, l'acide thio-acétique
(14,7 ml ; 15,69 g; 200 =oies; 4 éq.) est ajouté d'un seul
coup: la décoloration intervient très rapidement. La
température monte à 4 C. Après refroidissement à 0 C,
l'agitation est maintenue vigoureuse pendant lh.
Le composé 1 est obtenu avec un rendement réactionnel de
75% molaire tel que calculé à partir du spectrogramme RMN-
111 (dans le mélange réactionnel).
Les spectres RMN-111 et de masse sont identiques à ceux
obtenus dans l'exemple 1.
Exemple 3 : Préparation de la L-5-
acétylsulfanyl-
cx,N,N(diméthyl)-histidine (Composé 2) par activation avec
le N-bromosuccinimide et réaction avec l'acide thio-
acé tique
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
22
0 1.HCI \70 \___O
OH OH
2.NBS
3'CH3COSH N--
NkvNH NN NH/
Composé 2
Le chlorhydrate de la a-
N,N(diméthyl)-histidine
monohydratée (6,06 g ; 25 mmoles; 1 éq.) (voir V. N.
Reinhold et al., J. Med. Chem. 1968, 11, 258-260) est
dissout dans 135 ml d'eau déminéralisée. Puis une solution
d'acide chlorhydrique concentrée à 37%, (2,1 ml ; 2,46 g;
25 mmoles; 1 éq.) est additionnée, et la solution
résultante est refroidie à 1 C. L'agitation est maintenue
très forte. Le N-bromosuccinimide (2,31 g ; 13 mmoles; 1,3
éq.) est ajouté rapidement. Après 1 minute, l'acide
thioacétique (2,94 ml, 3,14 g; 40 mmoles; 4 éq.) est ajouté
très rapidement. L'agitation est maintenue vigoureuse à 0 C
pendant 30 minutes.
Le composé 2 est obtenu avec un rendement réactionnel de
70% molaire tel que calculé à partir du spectrogramme RMN-
Hl.
RMN-H1 (D20 pH ---, 1, 400 MHz) d'un échantillon du mélange: ô
(ppm) = 2,57 (s, 3H) ; 2,79 (s, 6H) ; 3,42 (dd, J=14,9 Hz
et J=10,6 Hz, 1H) ; 3,49 (dd, J=14,9 Hz et J=4,4 Hz, 1H) ;
4,20 (dd, J=10,6 Hz et J=4,4 Hz, 1H) ; 8,92 (s, 1H).
Un singulet correspondant à l'excès d'acide thioacétique
est détecté à 2,47 ppm, ainsi que des signaux de faible
intensité correspondants aux produits secondaires, tel que
l'acide acétique détecté à 2,Oppm. Un spectre représentatif
est inclus dans la Figure 3.
Le composé 2 est purifié sur une colonne de silice
utilisant un gradient acétate d'éthyle/éthanol suivi par
l'élution avec de l'eau.
RMN-H1 (D20 pH 2-3, 300 MHz): ô (ppm) = 2,54 (s, 3H) ; 2,96
(s, 6H) ; 3,28 (dd, J=14,7 Hz et J=10,4 Hz, 1H) ; 3,39 (dd,
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
23
J=14,7 Hz, J=4,4 Hz, 1H) ; 3,87 (dd, J=10,4 Hz et J=4,4 Hz,
1H) ; 8,81 (s, 1H).
Un singulet de faible intensité correspondant au produit
hydrolysé (composé 18b) est détecté à 8,33 ppm.
RMN-C1-3 (D20, 75 MHz): $5(ppm) = 22,4; 30,0; 41,7; 68,4;
117,2; 134,3; 136,8; 170,9; 195,9.
LCMS (APCI): 258,9 [M+H]
Exemple 4 : Préparation de la L-5-acétylsulfanyl-
cx,N,N(diméthyl)-histidine (Composé 2) par activation avec
le dibrome et réaction avec l'acide thioacétique
OH 0 1. HCI 0
2Br2
N--
NvNH 1 3.CH3COSH NN NH
Composé 2
Le chlorhydrate de la cx,N,N(diméthyl)histidine monohydratée
(1,66 g ; 6,98 mmoles; 1 éq.) (voir V. N. Reinhold et al.,
J. Med. Chem. 1968, 11, 258-260) est dissout dans 57 ml
d'eau déminéralisée, puis la solution est refroidit à 0 C.
Sous forte agitation, le dibrome (470 pl ; 1,45 g; 9,08
mmoles; 1,3 éq.) est ajouté goutte à goutte en 3 minutes.
La solution devient rouge. Après 1 minute, l'acide
thioacétique (2,56 ml ; 2,74 g; 34,91 mmoles; 5 éq.) est
additionné très rapidement : la solution se décolore
immédiatement et passe du rouge au jaune clair. L'agitation
est maintenue vigoureuse à 0 C pendant lh.
Le composé 2 est obtenu avec un rendement réactionnel de
69% molaire tel que calculé à partir du spectrogramme RMN-
1-11.
Les spectres RMN-1-11 et masse sont identiques à ceux obtenus
dans l'exemple 3.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
24
Exemple 5 : Préparation du la L-5-
acétylsulfanyl-
cx,N,N,N(triméthyl)-histidine (Composé 3) par activation
avec le N-bromosuccinimide et réaction avec l'acide
thioacétique
1.HCI
0 0
2. NBS
N N 3'CH300SH 1\11-11V
/\
Composé 3
La L-hercynine (2,0 g ; 9,96 mmoles; 1 éq.) (voir
V. N.
Reinhold et al., J. Med. Chem. 1968, 11, 258-260) est
dissoute dans 55 ml d'eau déminéralisée. Puis une solution
d'acide chlorhydrique concentrée à 37% (1,66 ml ; 1,96 g;
19,91 mmoles; 2 éq.) est ajoutée, et refroidie à 0 C. Sous
forte agitation, le N-bromosuccinimide (2,48 g (13,94
mmoles; 1,4 éq.) est ajouté : la solution devient rouge.
Après 5 minutes, l'acide thioacétique (4,4 ml (4,69 g;
59,74 mmoles; 6 éq.) est additionné très rapidement.
L'agitation est maintenue pendant 40 minutes.
Le composé 3 est obtenu avec un rendement réactionnel de
65% molaire tel que calculé à partir du spectrogramme RMN-
Hl.
RMN-H1 (D20 pH ---, 1, 400 MHz) d'un échantillon du mélange: ô
(ppm) : 2,53 (s, 3H) ; 3,33 (s, 9H) ; 3,50 (m, 2H) ; 4,13
(m, 1H) ; 8,91 (s, 1H).
Deux singulets correspondant à l'excès de l'acide thio-
acétique et au succinimide sont détectés à 2,44 ppm et 2,76
ppm, ainsi que des signaux de faible intensité
correspondants aux produits secondaires tel que l'acide
acétique détectée à 2,Oppm. Un spectre représentatif est
inclus dans la Figure 4.
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
Le produit est purifié sur une colonne de silice (gradient
acétate d'éthyle/éthanol/eau) .
RMN-H1 (D20, pH 2-3, 400 MHz): ô (ppm) = 2,53 (s, 3H); 3,30
(s, 9H); 3,37 (m, 1H); 3,44 (dd, J=14,0 Hz et J= 3,8 Hz,
5 1H); 3,88 (dd, J=11,7 Hz et J=3,8 Hz, 1H); 8,72 (s, 1H).
RMN-C13 (D20, 75 MHz): ô (ppm) = 22,9; 30,0; 52,5; 76,5;
117,9; 133,1; 137,2; 169,7; 196,0.
LCMS (APCI): 272,1 [M+H]
W Exemple 6 : Préparation du la L-5-
acétylsulfanyl-
cx,N,N,N(triméthyl)-histidine (Composé 3) par activation
avec le brome et réaction avec l'acide thio-acétique
0 1.HCI
-0- 2. Br,
N N 3'CH300SH NH /\
Composé 3
15 La L-hercynine (1,0 g (5 mmoles; 1 éq.) est dissoute dans
ml d'eau déminéralisée. Puis une solution d'acide
chlorhydrique concentrée à 37% (417 pl ; 5 mmoles; 1 éq.)
est ajoutée et la solution est refroidie à 1 C. Sous forte
agitation, le dibrome (0,33 ml ; 1,03 g, 6,5 mmoles; 1,3
20 éq.) est ajouté : une gomme rouge se forme dans un premier
temps qui se solubilise après 3 minutes. Après 4 minutes,
l'acide thioacétique (2,20 ml ; 2,68 g; 25 mmoles; 10 éq.)
est additionné très rapidement. L'agitation est maintenue
pendant 30 minutes.
25 Le composé 3 est obtenu avec un rendement réactionnel de
68% molaire tel que calculé à partir du spectrogramme RMN-
Hl.
Les spectres RMN-H1 et masse sont identiques à ceux
obtenus dans l'exemple 5.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
26
Exemple 7 : Préparation de la L-5-
acétylsulfanyl-
cx,N(glyciny1)-histidine (Composé 4) par activation avec le
N-bromosuccinimide et réaction avec l'acide thioacétique
tHa
Ndr-\rjî So
2. NBS
OH Nnri?
H HNo 3. CH,COSH
H HNroOH
NH2
NH2
Composé 4
La cx,N(glyciny1)-histidine (212 mg, 1 mmole; 1 éq.) est
dissoute dans 7 ml d'eau déminéralisé et 1 ml
d'acétonitrile. Puis une solution d'acide chlorhydrique
concentrée à 37% (170 pl, 2 mmoles; 2 éq.) est ajoutée et
la solution est refroidie à 0 C. Sous forte agitation, le
N-bromosuccinimide (230 mg, 1,3 mmoles; 1,3 éq.) est
ajouté. Après 3 minutes, l'acide thioacétique (370 pl, 5,0
mmoles; 5 éq.) est additionné très rapidement. L'agitation
est maintenue à 0 C pendant 30 minutes.
Le composé 4 est obtenu avec un rendement réactionnel de
62% molaire tel que calculé à partir du spectrogramme RMN-
Hl.
RMN-H1 (D20 pH-1, 400 MHz)d'un échantillon du mélange: ô
(ppm) = 2,53 (s, 3H), 3,20 (dd, J=15,3 Hz et J=8,5 Hz, 1H),
3,36 (dd, J=15,3 Hz et J=5,7 Hz, 1H), 3,79 (dd, J=16,4 Hz
et J=10,7 Hz, 2H) ; 3,84 (m, 1H), 8,86 (s, 1H).
Un singulet correspondant à l'excès de l'acide thioacétique
est détecté à 2,48 ppm, un singulet à 2,78 ppm
correspondant au succinimide ainsi que des signaux de
faible intensité correspondants aux produits secondaires,
tel que l'acide acétique détecté à 2,Oppm.
LCMS (APCI): 287,3 [M+H]+
Exemple 8 : Préparation du dérivé L-5-acétylsulfanyl-
oc,N,N(diméthyl)-1-méthylhistidine (Composé 5) par
CA 02949334 2016-11-16
W02015/181507 PCT/FR2015/051416
27
activation avec le N-bromosuccinimide et réaction avec
l'acide thioacétique.
Préparation de la cx,N,N(diméthyl)-1-méthyl-L-histidine
La cx,N,N(diméthyl)-1-méthyl-L-histidine est préparé en
analogie avec le protocole décrit pour la cx,N,N(diméthyl)-
L-histidine (V. N. Reinhold et al., J. Med. Chem. 1968, 11,
258-260) à partir de la 1-méthyl-L-histidine et du
formaldéhyde par amination réductrice en présence de
palladium sur charbon actif (88%).
RMN-1-11 (D20, 400 MHz): ô (ppm) = 2,91 (s, 6H) ; 3,18 (d,
J=6,4 Hz, 2H) ; 3,66 (s, 3H) ; 3,85 (t, J=6,4 Hz, 1H) ;
6,96 (s, 1H) ; 7,57 (s, 1H).
Préparation du dérivé L-5-acétylsulfanyl-
\ 1.HCI 0 0
\==1\1 OH 2. NBSOH
3. CH,COSH --N
Composé 5
La cx,N,N(diméthyl)-1-méthyl-histidine (604 mg, 3 mmoles; 1
éq.) est dissoute dans 22 ml d'eau déminéralisée. L'acide
chlorhydrique concentrée à 37% (250 pl, 3 mmoles; 1 éq.)
est ajoutée, puis la solution est refroidie à 0 C.
L'agitation est maintenue très forte. Le N-bromosuccinimide
(700 mg, 3,9 mmoles; 1,3 éq.) est ajouté rapidement. Après
3 minutes, l'acide thioacétique (1,1 ml, 15 mmoles; 5 éq.)
est ajouté très rapidement. L'agitation est maintenue
vigoureuse à 0 C pendant 30 minutes.
Le composé 5 est obtenu avec un rendement réactionnel de
65% molaire tel que calculé à partir du spectrogramme RMN-
Hl.
RMN-1-11 (D20 pH-1, 400 MHz) d'un échantillon du mélange:
$5(ppm) = 2,58 (s, 3H), 3,00 (s, 6H), 3,38 (dd, J=14,9 Hz et
J=10,7 Hz, 1H), 3,46 (dd, J=14,9 Hz et J=4,3 Hz, 1H), 3,77
(s, 3H), 4,12 (dd, J=10,7 Hz et J=4,3 Hz, 1H), 8.97 (s, 1H)
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
28
Un singulet correspondant à l'excès de l'acide thioacétique
est détecté à 2,48 ppm, un singulet à 2,78 ppm
correspondant au succinimide ainsi que des signaux de
faible intensité correspondants aux produits secondaires,
tel que l'acide acétique détecté à 2,Oppm.
Le produit est purifié sur une colonne de silice utilisant
un gradient acétate d'éthyle/éthanol/eau 2/2/1 suivi par
l'élution avec un mélange d'éthanol/eau 1/1. On obtient le
composé 5 (48%) sous forme d'une huile transparente.
RMN-H1 (D20, 400 MHz): ô (ppm) = 2,56 (s, 3H) ; 2,95 (s,
6H) ; 3,25 (dd, J=15,0 Hz et J=9,0 Hz, 1H) ; 3,31 (dd,
J=15,0 Hz et J=5,4 Hz, 1H) ; 3,69 (s, 3H) ; 3,86 (dd, J=9,0
Hz et J=5,4 Hz, 1H) ; 8.53 (s, 1H).
Les signaux de l'éthanol sont détectés à 1,18ppm et
3,65ppm.
LCMS (APCI): 272,3 [M+H]+
Exemple 9 : Préparation de la L-5-
acétylsulfanyl-
cx,N,N,N(triméthyl)-1-méthyl-histidine (Composé 6) par
activation avec le N-bromosuccinimide et réaction avec
l'acide thioacétique
Préparation de la 1-méthyl-hercynine
La 1-méthyl-hercynine est préparé en analogie avec le
protocole décrit pour l'hercynine (V. N. Reinhold et al.,
J. Med. Chem. 1968, 11, 258-260) à partir de la 1-méthyl-
diméthyl-L-histidine et d'iodométhane par quaternisation
dans le méthanol (89%).
RMN-H1 (D20, 400 MHz): ô (ppm) = 3,19 (m, 2H) ; 3,28 (s,
9H) ; 3,67 (s, 3H) ; 3,89 (dd, J=10,6 Hz et 4,5 Hz, 1H) ;
6,94 (s, 1H) ; 7,57 (s, 1H).
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
29
Préparation de la L-5-acétylsulfanyl-a,N,N,N(triméthyl) -
1-méthyl-histidine (Composé 6)
0 0
1------N n- 2. NBS 0-
....-N
/ \ 3.CH300SH ¨N N N
\..:õ..--. /,.1
Compose '6
La 1-méthyl-hercynine (430 mg, 2 mmoles; 1 éq.) est
dissoute dans 15 ml d'eau déminéralisée. L'acide
chlorhydrique concentrée à 37% (170 pl, 2 mmoles; 1 éq.)
est ajouté puis la solution est refroidie à 0 C. Sous forte
agitation, le N-bromosuccinimide (465 mg, 2,6 mmoles; 1,3
éq.) est ajouté. Après 3 minutes, l'acide thioacétique (740
pl, 10 mmoles; 5 éq.) est additionné très rapidement.
L'agitation est maintenue à 0 C pendant 30 minutes.
Le composé 6 est obtenu avec un rendement réactionnel de
67% molaire tel que calculé à partir du spectrogramme RMN-
1-11.
RMN-1-11 (D20 pH-1, 400 MHz) d'un échantillon du mélange:
$5(ppm) = 2,57 (s, 3H), 3,32 (s, 9H), 3,53 (m, 2H), 3,75 (s,
3H), 4,08 (dd, J=11,9 Hz et J=3,7 Hz, 1H), 8.98 (s, 1H).
Un singulet correspondant à l'excès de l'acide thioacétique
est détecté à 2,48 ppm, un singulet à 2,78 ppm
correspondant au succinimide ainsi que des signaux de
faible intensité correspondants aux produits secondaires,
tel que l'acide acétique détecté à 2,Oppm.
LCMS (APCI): 286,0 [M+H]+
Exemple 10 : Préparation de la L-5-acétylsulfanyl-sa-N(L-
alany1)-histidine (Composé 7) par activation avec le N-
bromosuccinimide et réaction avec l'acide thioacétique
0
A
\L
N--HN
N OH
H y_i
3. CH300SH '--N
H HN 0
NH2
NH2
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
Composé 7
L'a,N(L-alany1)-histidine (500 mg, 2,2 mmoles; 1 éq.) est
dissoute dans 15 ml d'eau déminéralisée contenant une
5 solution d'acide chlorhydrique concentrée à 37% (370 pl,
4,4 mmoles; 2 éq.) puis la solution est refroidie à 0 C. Le
N-bromosuccinimide (510 mg, 2,9 mmoles; 1,3 éq.) est ajouté
en une portion: le mélange devient orange limpide après 30
secondes. Après 3 minutes, l'acide thioacétique (820 pl,
10 11,0 mmoles; 5 éq.) est ajouté très rapidement. L'agitation
est maintenue vigoureuse à 0 C pendant 30 minutes.
Le composé 7 est obtenu avec un rendement réactionnel de
65% molaire tel que calculé à partir du spectrogramme RMN-
H1 d'un échantillon.
15 Le mélange réactionnel est lavé avec 2x25 ml d'acétate
d'éthyle, puis le composé est purifié sur une colonne de
silice (acétate d'éthyle/éthanol/eau 2/2/1. On obtient le
composé 7 (410 mg, 54%, pureté 88%) sous forme d'une huile
transparente.
20 RMN-H1 (D20 pH acide, 400 MHz): ô (ppm) = 1,49 (d, J=7,2
Hz, 3H) ; 2,53 (s, 3H); 3,20 (dd, J=15,3 Hz et J=8,9 Hz,
1H) ; 3.36 (dd, J = 15,3 Hz et J=5,8 Hz, 1H), 4,01 (q,
J=7,2 Hz, 1H) ; 4,77 (m superposé avec signal HOD) ; 8,86
(s, 1H).
25 Un singulet correspondant au succinimide est détecté à 2,68
ppm.
LCMS (APCI): 301,1 [M+H]+
Exemple 11 : Préparation du dérivé 5-acétylsulfanyl-
30 cx,N(pentanoy1)-histidine (Composé 8) par activation avec le
N-bromosuccinimide et réaction avec l'acide thioacétique
0
c.NH
.(/.,t0H 1.HCI :----0 0
0 S)......r2-...OH
2. NBS
0
3. CH3COSH %mil NEI
1
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
31
Composé 8
L'a,N(pentanoy1)-histidine (450 mg, 1,43 mmoles; 1 éq.) est
dissoute dans 10 ml d'eau déminéralisée contenant une
solution d'acide chlorhydrique concentrée à 37% (120 pl,
1,43 mmoles; 1 éq.), puis la solution est refroidie à 0 C.
L'agitation est maintenue très forte. Le N-bromosuccinimide
(330 mg, 1,86 mmoles; 1,3 éq.) est ajouté. Après 3 minutes,
l'acide thioacétique (530 pl, 7,15 mmoles; 5 éq.) est
ajouté très rapidement. L'agitation est maintenue
vigoureusement à 0 C pendant 30 minutes.
Le composé 8 est obtenu avec un rendement réactionnel de
67% molaire tel que calculé à partir du spectrogramme RMN-
H1 d'un échantillon.
Le produit est purifié sur une colonne de silice (mélange
90% d'acétate d'éthyle/éthanol 3/1 et 10% d'eau). La 5-
acétylsulfanyl-a,N(pentanoy1)-histidine (composé 8) est
obtenu sous forme d'une huile transparente (320 mg, 64%,
pureté 90%).
RMN-H1 (D20 -1, 400 MHz): ô (ppm) = 0,85 (t, J=7,3 Hz,
3H) ; 1,17 (h, J=7,4 Hz, 2H) ; 1,47 (p, J=7,4 Hz, 2H) ;
2,22 (t, J=7,4 Hz, 2H) ; 2,55 (s, 3H) ; 3,17 (dd, J=15,2 Hz
et J=9,6 Hz, 1H) ; 3,37 (dd, J=15,2 Hz et J=5,2 Hz, 1H) ;
4,79 (m superposé au signal de HOD) ; 8,88 (s, 1H).
LCMS (APCI): 314,1 [M+H]+
Pour illustrer l'invention, les composés 9-17 sont préparés
(Exemples 12-21) en analogie avec les exemples précédents.
Les résultats ainsi que les caractéristiques spectrales
sont résumés dans le Tableau 1 ci-dessous.
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
32
Tableau 1 : Exemples 12-21 décrivant la préparation des
Composés 9-17 selon l'invention.
%
RMN-111: Signaux
En conv. LC-
Produit caractéristiques
N Ex. analogie Réactif en MS
formé
avec produit 5 ô [m+H] +
ô
-H
désiré H-2 AcS
o 0
s\,../......,)LOH 4,13(dd,
Ex.12 NU Ex. 2 NBS 78%
8,91 J=7,7Hz, 2,55 244,1
-Nil ;NH
J=5,6Hz)
Composé 9
o
Ex. 2
Ex.13 Cl'N Ny (1 éq NBS 65% 8,83 4,73
(m) 2,51 272,1
...,..r \I
HC1)
Composé 10
0
0H
0 Ex. 2 4,93(dd,
NH-__>
Ex.14 F\J NH (1 éq NBS 58% 8,85
J=9,3Hz, 2,56 334,1
HC1) J=4,7Hz)
Composé 11
o 0
rs,
S)--r-?-- H
"-- 0
Ex.15 "%---NH NH ,......\ Ex. 2 NBS 63%
8,84 4,66 (m) 2,51 301,0
NI-12
Composé 12
Ex.16
7_o__OH Ex. 2 NBS 63%
4,31(dd,
¨
NH 2 9.00 J=7,6Hz, 2,58 244,6
.....-N....4.eN
Ex.17 Ex. 1 Br2 55% J=6,9Hz)
Composé 13
0
OH Ex. 2
qrs
Ex.18 0 Wqq\--F-12 (eau/ NBS 31% 8,98 4,37
292,1
NNH
CH3CN)
Composé 14
0
Ex. 2
Ex.19
9r-s>=(-11--7
(eau/ NBS 12% 8,95 4,28 320,9
H1,1N /
CH3CN)
Composé 15
0
'q 1-
Ex. 2
/
Ex.20 0 (eau/ NBS 12% 9,06 4,32
334,1
NINH A..... CH3CN)
Composé 16
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
33
\SçO(-?\-101
377,
Ex.21 Ex.2 NBS 40% 8,89 4,36 2,58
N NH NH
H2N 2
Composé 17
Il. Exemples d'application :
11.1 Transformation des dérivés 5-acylsulfanyl
préparés in situ en dérivés 5-sulfanylhistidines
correspondants par hydrolyse
Pour illustrer l'application des dérivés 5-
acylsulfanyl-histidines selon l'invention, d'une manière
non-limitative, sont donnés, dans ce paragraphe, des
exemples d'application des nouveaux dérivés 5-acylsulfanyl-
histidines, préparés généralement in situ, en tant que
précurseur de 5-sulfanylhistidines et de leurs dérivés.
Ces exemples illustrent l'utilité des nouveaux dérivés
5-acylsulfanyles décrits dans l'invention pour préparer
d'une manière aisée des composés 5-sulfanylhistidines et
leurs dérivés tels que les disulfures, qui sont par
ailleurs très difficile d'accès et nécessitent des
synthèses multi-étapes.
Afin d'obtenir de meilleurs rendements en dérivés 5-
sulfanylhistidines, les composés 5-acylsulfanyl sont
préparés in situ puis hydrolysés ensuite directement, en
agitant le milieu réactionnel, de préférence en chauffant
le milieu réactionnel. La présence d'un thiol, tel que
l'acide mercaptopropionique ou la dithiothréitol, s'avère
bénéfique pour l'isolation aisée des dérivés de 5-
sulfanylhistidines, mais elle n'est aucunement nécessaire
pour l'hydrolyse même, comme démontré dans les exemples de
suivi 18d, 19b et 19c.
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
34
Exemple 22 : Préparation one pot de la L-5-
sulfanylhistidine via préparation in-situ de la 5-
acétylsulfanylhistidine suivi par hydrolyse (Composé 18)
0 tHa
NNr=cZ-12 CH COS
0H [71:-/---] 1-1S 0
2. NBS HSCH2CH2CO2H OH
3. ____________________________________________________ H ¨ NH2 le
NH 3 NN NH
NN NH
Composé 18
Le chlorhydrate de la L-histidine monohydratée (10,48 g ;
50 mmoles; 1 éq.) est dissout dans 300 ml d'eau
déminéralisée et l'acide chlorhydrique concentré à 37%
(4,17 ml ; 4,92 g; 50 mmoles; 1 éq.), puis la solution est
refroidie à 0 C. L'agitation est maintenue très forte. Le
N-bromosuccinimide (11,56 g ; 65 mmoles; 1,3 éq.) est
ajouté en une seule portion: le mélange devient orange
limpide. L'acide thio-acétique (14,7 ml ; 15,69 g; 200
mmoles; 4 éq.) est ajouté d'un seul coup. L'agitation est
maintenue vigoureuse à 0 C pendant lh. L'acide 3-
mercaptopropionique (26 ml ; 32,2 g; 300 mmoles; 6 éq.) est
ajouté puis la solution légèrement jaune est chauffée à
90 C pendant 18h. La solution est extraite par trois fois
300 ml d'acétate d'éthyle. Après neutralisation et
cristallisation en présence de dithiothréitol (231 mg ; 1,5
mmoles; 0,03 éq.), le composé désiré 18 cristallise. Le
solide est filtré et séché sous vide pour donner 2,97 g
(31% ; 41% par rapport à la quantité de l'intermédiaire
SAc) de L-5-sulfanylhistidine (Composé 18) sous forme d'un
solide blanc cassé.
RMN-1-11 (D20, 400 MHz): ô (ppm) = 3,18 (dd, J= 15,8 Hz,
J=7,3 Hz, 1H) ; 3,26 (dd, J=15,8 Hz et J=5,1 Hz, 1H) ; 4,33
(dd, J=7,3 Hz, J=5,1 Hz, 1H) ; 8,25 (s, 1H).
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
RMN-H1 (D20+DC1, 400 MHz): ô (ppm) = 3,11 (dd, J= 15,1 Hz,
J=6,5 Hz, 1H) ; 3,19 (dd, J=15,1 Hz et J=6,6 Hz, 1H); 4,12
(t, J=7,0 Hz, 1H) ; 8,37 (s, 1H).
RMN-C13 (D20+DC1, 75 MHz): ô (ppm) = 26,3; 55,2, 122,1;
5 130,1; 135,5; 173,6.
LC-MS (AP-): 186,0 [M-HF
[]r) : + 7,4 (c = 0,1 ; 1N HC1)
Analyse élémentaire : C6H9N302S ; Théorique : C 38,49 % ; H
4,84 % N 22,44 ; Mesuré : C 38,0 % ; H 4,96 % ; N 22,06.
Exemple 23 : Préparation one pot de la D-5-
sulfanylhistidine via préparation in-situ de la 5-
acétylsulfanyl-histidine suivi par hydrolyse (Composé 19)
0 1. HCI
r-01-11 HSCH2CH2CO2H 0
2. NBS
:
INI12 3. CH3COSH - 1\1112 .
ill 1-1S OH
NN NH NN NH
NN NH
Composé 19
La D-histidine (3,92 g ; 25 mmoles; 1 éq.) est dissoute
dans 150 ml d'eau déminéralisée et une solution d'acide
chlorhydrique concentrée à 37% (4,17 ml ; 4,92 g; 50
mmoles; 2 éq.), puis la solution est refroidie à 0 C.
L'agitation est maintenue très forte. Le N-bromosuccinimide
(5,78 g (32,5 mmoles; 1,3 éq.) est ajouté d'un coup: la
solution devient orange limpide. L'acide thioacétique (7,33
ml ; 7,85 g; 200 mmoles; 4 éq.) est ajouté d'un seul coup.
L'agitation est maintenue vigoureuse à 0 C pendant lh.
L'acide 3-mercaptopropionique (13 ml (16,1 g; 150 mmoles; 6
éq.) est ajouté puis la solution est chauffée à 100 C
pendant 18h. Après refroidissement, la solution est
extraite par trois fois 150 ml d'acétate d'éthyle. Le
dithiothréitol (13 ml ; 16,1 g; 150 mmoles; 6 éq.) est
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
36
ajouté à la phase aqueuse. Après recristallisation en
présence de charbon actif on
obtient 1,25 g de D-5-
sulfanylhistidine (Composé 19) (26 % ; 35 % par rapport à
la quantité de l'intermédiaire SAc) sous forme d'un solide
beige.
Les spectres RMN-HI, RMN-C13 et masse sont identiques à
ceux obtenus dans l'exemple 13 pour le composé 9.
[o]p : - 7,1 (c = 0,1 ; 1N HC1)
Exemple 24 : Préparation one pot de la D,L-5-
sulfanylhistidine via préparation in-situ de la 5-
acylsulfanylhistidine suivi par hydrolyse (Composé 20)
0 1. HCI
OH 0
2. NBS
NN NHH2 HSCH2CH2CO21-1 .. ils)=(_?\ --1H2OH
-- N 3.CH3COSH
NH - NN
NN NH
Composé 20
Le chlorhydrate de la DL-histidine monohydratée (3,21 g ;
15 mmoles; 1 éq.) est dissout dans 100 ml d'eau
déminéralisée et une solution d'acide chlorhydrique
concentrée à 37% (1,25 ml ; 1,48 g; 15 mmoles; 1 éq.), puis
la solution est refroidie à 0 C. Sous agitation très forte,
le N-bromosuccinimide (3,47 g ; 19,5 mmoles; 1,3 éq.) est
ajouté d'un coup. Après 2 minutes, l'acide thioacétique
(4,4 ml ; 4,71 g; 60 mmoles; 4 éq.) est ajouté d'un seul
coup. On laisse agiter à 0 C pendant lh. L'acide 3-
mercaptopropionique (8,0 ml ; 9,65 g; 90 mmoles; 6 éq.) est
ajouté puis la solution est chauffée à 100 C pendant 18h.
Un précipité correspondant au disulfure de l'acide thio-
acétique et de l'acide mercaptopropionique est éliminé par
filtration. Le filtrat est lavé par deux fois 100 ml
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
37
d'acétate d'éthyle. Après neutralisation et cristallisation
en présence de dithiothréitol (233 mg ; 1,5 mmoles; 0,1
éq.), 650 mg de D,L-5-sulfanylhistidine (Composé 20) (23 96,
29 96 par rapport à la quantité de l'intermédiaire SAc) sont
obtenus sous forme d'un solide blanc.
Les spectres RMN-111, RMN-C13 et masse sont identiques à ceux
obtenus dans l'exemple 22 pour le composé 18.
W
11.2 Transformation des dérivés 5-acylsulfanyles
préparés in situ en dérivés 5,5'-disulfane-diyl-bis-
histidines (disulfures)correspondants par hydrolyse
Exemple 25 : Préparation one pot du disulfure de la L-
5-sulfanylhistidine via préparation in-situ de la 5-
acylsulfanylhistidine suivi par hydrolyse et oxydation
(Composé 21)
o tHa 0
OH
OH
2.6r2
¨ NH2 -11.-
j-CR\--
\rd\-1 __________________________________________
S
- N 4. HSCH2CH2CO2H
e . NI-12 S
KI,..,*,./NH 3. CH3COSH N NH H2 5. H202
Nzz....../NH
HO-Z-
0 4 HCI
2 H20
Composé 21x4HC1x2H20
Le chlorhydrate de la L-histidine monohydratée (14,82 g ;
70 mmoles; 1 éq.) est dissout dans 126 ml d'eau
déminéralisée, puis la solution est refroidie à 0 C. Sous
forte agitation, le dibrome (4,32 ml ; 13,42 g; 84 mmoles;
1,2 éq.) est ajouté goutte à goutte très rapidement. La
solution devient rouge. L'acide thioacétique (18,0 ml ;
19,2 g; 245 mmoles; 3,5 éq.) est additionné très
rapidement. L'agitation est maintenue vigoureuse à 0 C
pendant 20 minutes. L'acide 3-mercaptopropionique (25 ml ;
29,71 g; 280 mmoles; 4 éq.) est ajouté et la solution est
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
38
chauffée à 80 C pendant la nuit. La solution est refroidie
puis extraite par 3 fois 150m1 d'acétate d'éthyle. Après
oxydation avec une solution d'eau oxygénée à 30% (3,5 ml
(3,97 g; 35 mmoles; 0,5 éq.), suivie d'une purification sur
la résine Dowex WX2, le disulfure de la L-5-
sulfanylhistidine (Composé 21) (4,66 g ; 24 % ; 37 % par
rapport à la quantité de l'intermédiaire SAc) chlorhydrate
hydraté est obtenu sous forme d'une poudre gris clair.
RMN-1-11 (D20, 400 MHz): 5 (ppm) = 3,27 (m, 2x1H) ; 3,32 (m,
2x1H) ; 4,17 (dd, J=8,0 Hz, J=6,6 Hz, 2x1H) ; 8,87 (s,
2x1H).
LCMS (APCI): 373,0 [M+H] +
[c]p : + 23,6 (c = 0,1 ; 1N HC1)
Exemple 26 :
Préparation one pot du disulfure de la L-5-sulfanyl-
cx,N(méthyl)-histidine (Composé 22) via préparation in-
situ de la 5-acylsulfanylhistidine suivi par hydrolyse
et oxydation (Composé 22)
0 1. HCI
ZH-OH oH1
2. NBS S 4.
HSCH2CH2CO2H / HN __ s,2-0H
¨ NH le' HN
3. CH3COSH
si
NN NH / N.ri\IH / 5. Oxydation NH
.-- NH /
HO
0 N-ezz/
Composé 22
Le chlorhydrate de la cx,N(méthyl)-L-histidine (1,05 g ; 5
mmoles; 1 éq.) (V. N. Reinhold et al., J. Med. Chem. 1968,
11, 258-260) est dissout dans 35 ml d'eau déminéralisée
contenant une solution d'acide chlorhydrique concentrée à
37% ; 420 pl (5 mmoles; 1 éq.), puis la solution est
refroidie à 1 C. L'agitation est maintenue très forte. Le
N-bromosuccinimide (1,17 g ; 6,5 mmoles; 1,3 éq.) est
ajouté rapidement. Puis l'acide thioacétique (2,57 ml (2,74
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
39
g; 35 mmoles; 7 éq.) est ajouté très rapidement.
L'agitation est maintenue vigoureuse à 0 C pendant 30
minutes. La solution est extraite avec 40 ml d'acétate
d'éthyle puis l'acide 3-mercaptopropionique (2,2 ml ; 2,65
g; 25 mmoles; 5 éq.) est ajouté à la phase aqueuse.
L'hydrolyse est effectuée par chauffage à 100 C pendant
20h. Après refroidissement de la solution, le milieu
réactionnel est extrait par 4 fois 35 ml d'acétate
d'éthyle. Après oxydation et purification sur la résine
DOWEX 50WX2-400, le disulfure de la L-5-sulfanyl-
a,N(méthyl)-histidine (Composé 22) est obtenu (620 mg, 61%,
75% par rapport à la quantité de l'intermédiaire SAc) est
obtenu sous forme d'une poudre marron.
RMN-H1 (Me0D/D20 20/1, 400 MHz): 5 (ppm) = 2,69 (s, 2x3H) ;
2,94 (dd, J=14,0 Hz, J=7,0 Hz, 2x1H) ; 2,99 (dd, J=14,0 Hz,
J=5,0 Hz, 2x1H) ; 3,92 (dd, J=7,0 Hz, J=5,0 Hz, 2x1H) ;
7,79 (s, 2x1H).
LCMS (APCI): 401,0 [M+H] +
Préparation de la L-5-sulfanyl-cx,N(méthyl)-histidine par
réduction du disulfure (Composé 23)
Pez--N 0
H)"___r réduction 0
____________________________________________ a- HS)===ct OH
1
S NH
-- /
HO
Nõ......../NH NN NH/
0
Composé 23
Le disulfure de la L-5-sulfanyl-a,N(méthyl)- histidine (620
mg ; 1,52 mmoles, 1 éq.) (Composé 22) est mis en solution
dans 50 ml d'eau. Le dithiothréitol (473 mg ; 3,03 mmoles;
2 éq.) et le charbon actif (300 mg) sont ajoutés. Le
mélange est agité 4h à température ambiante. Après
filtration et cristallisation dans l'éthanol absolu la L-5-
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
sulfanyl-cx,N(méthyl) -histidine (Composé 23) (351 mg, 56%)
est obtenue sous forme d'une poudre beige.
RMN-H1 (D20, 400 MHz): 5 (ppm) = 2,80 (s, 3H) ; 3,21 (dd,
5 J=15,9 Hz, J=6,4 Hz, 1H) ; 3,28 (dd, J=15,9 Hz, J=5,2 Hz,
1H) ; 3,92 (m, 1H) ; 8,25 (s, 1H).
LCMS (APCI): 202,1 [M+H]
Exemple 27 :
10 Préparation one pot du disulfure de la L-5-sulfanyl-
c,N(diméthyl)-histidine via préparation in-situ de la
5-acylsulfanylhistidine suivi par hydrolyse et
oxydation (Composé 24)
NBS
Ha 0
nrR\N-OH OH
2 \r(--t-S 4 HSCH,CH2CO2H HN
3 CH,COSH
NN NH N¨NH 5 Oxydation S"S
Nzz-z/NH
H20
HO
0 H HCI H20
a
15 HCI HCI
Composé 24x4HC1xH20
Le chlorhydrate de la N,N(diméthyl)-histidine monohydratée
(2,43 g ; 10 mmoles; 1 éq.) est dissout dans 54 ml d'eau
20 déminéralisée contenant une solution d'acide chlorhydrique
concentrée à 37% (835 pl ; 985 mg; 10 mmoles; 1 éq.), puis
la solution est refroidie à 1 C. L'agitation est maintenue
très forte. Le N-bromosuccinimide (2,31 g ; 13 mmoles; 1,3
éq.) est ajouté rapidement. Après 2 minutes, l'acide thio-
25 acétique (3,0 ml ; 3,14 g; 40 mmoles; 4 éq.) est ajouté
très rapidement. L'agitation est maintenue vigoureuse à 0 C
pendant 30 minutes. La solution légèrement jaune obtenue
est extraite par 2 fois 120 ml d'acétate d'éthyle. Après
hydrolyse à chaud, oxydation et purification sur la résine
30 DOWEX 50WX2-400 le chlorhydrate hydrate du disulfure de la
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
41
L-5-suifanyl-cxN,N(diméthyl) -histidine (Composé 2 4x4HC1xH2 0 ,
1,2 g, 41 %) est obtenu sous forme d'une poudre beige.
RMN-111 (D20, 400 MHz): 5 (ppm) = 3,01 (s, 2x6H) ; 3,37 (dd,
J=14,6 Hz, J=11,2 Hz, 2x1H) ; 3,51 (dd, J=14,6 Hz, J=4,0
Hz, 2x1H) ; 4,09 (dd, J=11,2 Hz, J=4,0 Hz, 2x1H) ;
8,86
(s, 2x1H).
LCMS (APCI): 429,2 [M+H]
Préparation du Composé 24 base libre
OH OH
Az-1\1
Neutralisation HN
_s *". --N /IN
N7H
H2O
HO HO
0 HCI HCI H20 0
HCI HCI
Composé 24
Le chlorhydrate hydrate du disulfure de la L-5-sulfanyl-
cx,N,N(diméthyl)-histidine (3,6 g ; 5,89 mmoles; 1 éq.) est
mis en solution dans 53 ml d'eau déminéralisée. La résine
Amberlite(DIRA-410 (8g) sous forme hydrogénocarbonate (selon
K. A. Piez et al., J. Biol. Chem. 194, 669-672 (1952)) est
ajoutée. La suspension est agitée sous vide pendant 30
minutes puis filtrée. Le filtrat est évaporé pour conduire
au disulfure de la L-5-sulfanyl-,N,N(diméthyl)-histidine
base libre (Composé 24) (2,47 g, 84%) sous forme d'un
solide jaune.
RMN-111 (D20, 400 MHz): 5 (ppm) = 2,88 (s, 2x6H) ; 2,92 (m,
2x2H); 3,70 (m, 2x1H) ; 8,17 (s, 2x1H).
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
42
Obtention du composé 25 par réduction du Composé
18x4HC1xH20)
0
OH
r"--r---N 0
1. Neutralisation
HS)..._{.....?õOH
HO ___________________________________________ 1.-
N./
.-._--..NH 2. Réduction
H20 N.......NH /N,
0 HCI Ha H20
HCI HCI
Composé 25
Le chlorhydrate hydraté du disulfure de la L-5-sulfanyl-
a,N,N(diméthyl)-histidine (1,2 g ; 2,07 mmoles; 0,5 éq.)
est mis en solution dans 40 ml d'eau déminéralisée. La
résine Amberlite(DIRA-410 (2 g)
sous forme
hydrogénocarbonate est ajoutée. La suspension est agitée
sous vide pendant 30 minutes puis filtrée. Après réduction
avec du dithiothréitol (967 mg ; 6,20 mmoles; 1,5 éq.) et
cristallisation avec l'éthanol absolu, sous azote, la L-5-
sulfanyl-a,N,N(diméthyl)-histidine (Composé 25) (450 mg, 58
96) est obtenue sous forme d'un solide blanc.
RMN-H1 (D20, 400 MHz): 5 (ppm) = 3,00 (s, 6H) ; 3,23 (dd,
J=15,5 Hz et J=7,5 Hz, 1H) ; 3,31 (dd, J=15,5 Hz et J=5,8
Hz, 1H) ; 4,00 (dd, J=7,5 Hz et J=5,8 Hz, 1H) ; 8,28 (s,
1H).
RMN-C13 (D20, 75 MHz): ô (ppm) = 22,7; 41,8, 67,3; 124,5;
129,6; 131,7; 171,0.
LCMS (APCI): 216,1 [M+H]+
Suivi analytique de l'hydrolyse du composé 5-
acylsulfanyl (composé 2) en composé 5-
sulfanylhistidine 25
0
0 0 lk-r-?--OH
SNik_r,OH H20
).-
N.....NH /N-...._
N......NH /N--._ 40 C
Composé 25
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
43
Le composé 2 est préparé et purifié par colonne comme
décrit dans l'exemple 3, utilisant un gradient acétate
d'éthyle/éthanol suivi par l'élution avec de l'eau. La
fraction aqueuse contenant le composé 2 pur est placée dans
un bain d'eau à 40 C, et chauffé sous agitation pendant 8h.
Des échantillons sont prélevés toutes les 60 minutes, et le
mélange analysé par HPLC.
L'hydrolyse du composé 2 est quasi-complète après 8h, et le
composé 19 est obtenu avec un rendement de 70%.
Tableau 2 : Suivi de la formation du composé 25 par
hydrolyse du composé 2 :
t (h) 0 1 2 3 5 8
% composé
25 0% 14% 23% 34% 49% 70%
Exemple 28 :
Préparation one pot de la L-5-sulfanyl-
cx,N,N,N(triméthyl)-histidine via préparation in-situ
de la 5-acylsulfanylhistidine suivi par hydrolyse
(Composé 26)
0
C LHU CO i\JH0
NBS S):--- - 4. HSCH2CH2002,H
N¨ ¨ N
3. H,SH
NH \ f\lr \
N
Composé 26
La L-hercynine (5,02 g ; 25 mmoles; 1 éq.) est dissoute
dans 135 ml d'eau déminéralisée et une solution d'acide
chlorhydrique concentrée à 37%, (4,17 ml ; 4,93 g; 50
mmoles; 2 éq.) est additionnée ; puis la solution est
refroidie à 0 C. Sous forte agitation, le N-
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
44
bromosuccinimide (5,78 g ; 32,5 mmoles; 1,3 éq.) est
ajouté. Après 5 minutes, l'acide thio- acétique (18,33 ml ;
19,61 g; 250 mmoles; 10 éq.) est additionné très
rapidement. L'agitation est maintenue pendant 40 minutes.
La solution est extraite par 2 fois 135 ml d'acétate
d'éthyle. L'acide 3-mercaptopropionique (11,07 ml ; 13,4 g;
125 mmoles; 5 éq.) est ajouté à la phase aqueuse puis la
solution est chauffée à 130 C pendant 3h. Après extraction,
neutralisation et cristallisation en présence de
dithiothréitol (1,95 g (12,5 mmoles; 0,5 éq.) la L-5-
sulfanyl-a,N,N,N(triméthyl)-histidine (Composé 26) (2,22
g ; 38 96 ; 58 96
par rapport à la quantité de
l'intermédiaire SAc) est obtenu sous forme d'une poudre
blanche (à conserver sous atmosphère inerte).
RMN-H1 (D20, 400 MHz): 5 (ppm) = 3,29 (s, 9H) ; 3,19 (m,
1H) ; 3,35 (m, 1H) ; 4,00 (dd, J=10,6 Hz, J=3,9 Hz, 1H) ;
8,22 (s, 1H).
LCMS (APCI): 230,0 [M+H]+
Suivi analytique par RMN-111 de l'hydrolyse du composé 5-
acylsulfanyl 3 en composé L-5-sulfanyl-
Wq,N,N(triméthyl)-histidine (Composé 26) en présence
d'un thiol
0
0 0
)_(-----t- - H20/HSCH2CH2CO2H 1-1S--0-
--
NN NH h
.......NH / \
Composé 26
Le composé 3 est préparé et purifié par colonne comme
décrit dans l'exemple 5. 100 mg (0,33 mmoles, 1 éq) du
composé 3 sont solubilisés dans 2,4 mL de D20. 172 mg de
l'acide 3-mercaptopropionique (142 pl, 5 équivalents) sont
ajoutés, et la solution est chauffée à 40 C. La conversion
CA 02949334 2016-11-16
W02015/181507 PCT/FR2015/051416
est suivie par RMN-H1 et par HPLC-ELSD. Le rendement
d'hydrolyse du composé 3 est de 90% après 3h (suivi par
RMN-111). Le composé 26 est formé après 3h30 avec un
rendement de 97% (HPLC-ELSD).
5
Préparation du composé L-5-sulfanyl-cx,N,N,N(triméthyl)-
histidine (composé 26) par hydrolyse du composé 5-
acylsulfanyl 3
0 _
0
fizz .-N
10 0
H2 \\ s
RSH 0
¨N -- I \ \ N 0 N H
NH \ àr N
Composé 3 Composé 26
Le composé 3 est préparé et purifié par colonne comme
15 décrit dans l'exemple 5. 170 mg (0,6 mmoles) du composé 3
sont solubilisé dans 10 mL d'eau, et la solution est
chauffée à 90 C à l'air pendant 7h. La conversion est
suivie par HPLC. L'hydrolyse du composé 3 est complète
après 7h. La solution est évaporée à sec. Le résidu est
20 repris dans un mélange de 5 mL de méthanol et 93 mg (0,6
mmol) de dithiothréitol. Après agitation pendant 4h sous
atmosphère inerte, 2mL d'éthanol sont ajoutés. Un précipité
se forme immédiatement, qui est filtré et lavé avec de
l'éthanol (2x2mL) puis de l'éther éthylique (2x2mL). Après
25 séchage, 104mg (72%) de la L-5-sulfanyl-N,N,N(triméthyl)-
histidine sont obtenus sous forme d'une poudre beige.
Les spectres RMN-H1 et de masse sont identiques à ceux
obtenus dans l'exemple 28a.
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
46
préparation du disulfure de la L-5-sulfanyl-
cx,N,N,N(triméthyl)-histidine (Composé 27)
0 o_
HSo- air
Y\¨
N
NH / \ 1\1...õ N.-z-z/NH
,... _
0
0
Composé 27
La L-5-sulfanyl-a,N,N,N(triméthyl)-histidine (Composé 26,
300 mg, 1,29 mmoles, 1 éq) est mis en solution dans 50 ml
d'eau déminéralisée. La solution incolore est agitée à
température ambiante pendant 4 jours. Après filtration et
lyophilisation du filtrat, le disulfure de la L-5-sulfanyl-
a,N,N,N(triméthyl)-histidine (Composé 27) (263 mg ; 89%)
est obtenu sous forme d'une poudre jaune.
RMN-1-11 (D20, 400 MHz): 5 (ppm) = 2,68 (dd, J=13,5 Hz,
J=11,0 Hz, 2x1H) ; 2,75 (dd, J=13,5 Hz, J=4,3 Hz,
2x1H) ; 3,19 (s, 2x9H) ; 3,68 (dd, J=11,0 Hz, J=4,3 Hz,
2x1H) ; 7,97 (s, 2x1H).
LCMS (APCI) : 457,1 [M+H]+.
Suivi analytique par HPLC de l'hydrolyse du composé 5-
acylsulfanyl 3 et oxydation in situ en composé 27
0 _
0
H20 Fis).__{..1)._ _
air
0
1 HNfie:--N
+
0
-- N N Nõ
N,......z/NH
NN NH /
0
0
Composé 27
Le composé 3 est préparé et purifié par colonne comme
décrit dans l'exemple 5, utilisant un gradient acétate
d'éthyle/éthanol suivi par l'élution avec de l'eau. La
fraction aqueuse contenant le composé 3 pur est placée dans
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
47
un bain d'eau à 40 C, et chauffé sous agitation pendant
deux jours. Des échantillons sont prélevés chaque heure, et
le mélange analysé par HPLC.
L'hydrolyse du composé 3 est quasi-complète après 2 jours,
et le composé 27 est obtenu avec un rendement de 80%.
Tableau 3 : Suivi de l'hydrolyse du composé 3:
t Oh 2h 4h 6h 8h 18h 2 j
% hydrolyse 0% 7% 21% 38% 60% 85% 95%
W Suivi analytique de l'hydrolyse par RMN-1.11 du composé 5-
acylsulfanyl 3 et oxydation in situ en composé 27
0 _
0
0 0
H20 HS
\_ - air
-- Ni-
)---(----
-N S ij
0
0
Composé 3 Composé 27
Le composé 3 est préparé et purifié par colonne comme
décrit dans l'exemple 5. 30 mg du composé 3 sont solubilisé
dans 600pL de D20, la solution transféré dans un tube RMN,
qui est gardé à température ambiante. La conversion est
suivie par RMN-111. L'hydrolyse du composé 3 est quasi-
complète après 2 jours, et on obtient un mélange contenant
le disulfure 27 et le thiol 26 (- 3 :1).
Tableau 4 : Suivi de l'hydrolyse du composé 3:
t Oh 2h 10h 2j
% hydrolyse 0% 19% 26% 86%
Exemple 29 :
Préparation one-pot du disulfure de la L-5-sulfanyl-
o 1 o
o- 0
2 Br Ha
r=r¨?\:-.1H 0 2 - NH
NN NH y 3 CH3COSH NNNH r 5 4 oxydation (air) 0
OH
HCI Nõ,...NH
HCI
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
48
cx,N(acéty1)-histidine (Composé 28 chlorhydrate) via
préparation in-situ de la 5-acylsulfanylhistidine
suivi par hydrolyse et oxydation
Composé 28x2HC1
La cx,N(acéty1)-L-histidine monohydratée (2,15 g, 10 mmoles;
1 éq.) est dissoute dans 63 ml d'eau déminéralisée
contenant l'acide chlorhydrique concentré à 37% (1,67 ml,
1,97 g; 20 mmoles; 2 éq.) ; puis la solution est refroidie
à 0 C. Le dibrome (668 pl, 2,07 g; 13 mmoles; 1,3 éq.) est
W additionné. L'acide thioacétique (3,67 ml ; 3,92 g; 50
mmoles; 5 éq.) est ajouté d'un seul coup. L'agitation est
maintenue à 0 C pendant 45 minutes. La solution est
réchauffée à température ambiante. L'acide 3-
mercaptopropionique (5,26 ml, 6,36 g; 60 mmoles; 6 éq.) est
ajouté puis la solution est chauffée à 80 C pendant la
nuit. La solution est refroidie à température ambiante puis
extraite par 4 fois 50 ml d'acétate d'éthyle. La phase
aqueuse est purifiée sur silice pour conduire au
chlorhydrate du disulfure de la L-5-sulfanyl-aN(acéty1)-
histidine (composé 28) sous forme d'une huile orange (520
mg, 17% ; 36% par rapport à la quantité de l'intermédiaire
SAc).
RMN-H1 (D20, 400 MHz): 5 (ppm) = 1,86 (s, 2x3H) ; 2,92 (dd,
J=15,0 Hz, J=8,0 Hz, 2x1H) ; 3,03 (dd, J=15,0 Hz, J=5,5 Hz,
2x1H) ; 4,47 (dd, J=8,0 Hz, J=5,5 Hz, 2x1H) ; 8,73 (s,
2x1H).
LCMS (APCI): 457,4 [M+H]+
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
49
Préparation de la L-5-sulfanyl-a,N(acétyl) -histidine
(Composé 29)
....... r" 0
ol?....H HI\} ....._<N
HS>r...?LOH
0
HO 1. Neutralisation
S¨S ..?..,_OH _________ . N \ NH Ny
0
HCI µ,NH NH. 2. Réduction
HCI
Composé 29
Le chlorhydrate du disulfure de la L-5-sulfanyl-
cx,N(acéty1)-histidine (Composé 28) (520 mg ; 834 pmoles, 1
éq.) est mis en solution dans 50m1 d'eau puis le pH de la
solution de couleur marron est ajusté à 4,5 par ajout de
W NH4OH. L'acide 3-mercaptopropionique (4,38 ml ; 5,31 g; 50
mmoles; 5 éq.) est ajouté. La solution est chauffée à 70 C
pendant 2h. La solution est extraite par 4 fois 50 ml
d'acétate d'éthyle. La phase aqueuse est évaporée à sec
pour donner la L-5-sulfanyl-a,N(acéty1)-histidine (Composé
29) (390 mg ; 86 96) sous forme d'un solide beige.
RMN-H1 (D20, 400 MHz): 5 (ppm) = 1,97 (s, 3H) ; 3,01 (dd,
J=15,2 Hz, J=8,6 Hz, 1H) ; 3,16 (dd, J=15,2 Hz, J=4,8 Hz,
1H) ; 4,50 (dd, J=8,6 Hz, J=4,8 Hz, 1H) ; 8,22 (s, 1H).
LCMS (APCI): 230,0 [M+H] +
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
Exemple 30 :
Préparation one pot de la L-5-
sulfanylcarnosine via préparation in-situ de la 5-
acylsulfanylhistidine suivi par hydrolyse (Composé 30)
0
0 1. HCI
)----- 0 0
HSOH
4. HSCH2CH2CO2H
i a 0
%r
,Nii_i N7 3. CH,C OSH NHµ)1
N --- NH
,õ.
NI-12 NH2
NH2
5 Composé
30
La L-carnosine (425 mg ; 1,88 mmoles; 1 éq.) est dissoute
dans 12 ml d'eau déminéralisée contenant une solution
d'acide chlorhydrique concentrée à 37% (370 mg ; 3,75
mmoles; 2 éq.), puis la solution est refroidie à 0 C. Le N-
10 bromosuccinimide (440 mg ; 2,44 mmoles; 1,3 éq.) est ajouté
en une portion: la solution devient orange limpide. L'acide
thioacétique (960 pl ; 1,03 g, 13,14 mmoles; 7 éq.) est
ajouté. Le mélange est agité à 0 C pendant lh. La solution
est extraite par 4 fois 12 ml d'acétate d'éthyle. Après
15 neutralisation et purification sur silice en présence de
dithiothréitol (290 mg ; 1,88 mmoles; 1 éq.), la L-5-
sulfanylcarnosine (Composé 30) (70 mg ; 14 % ; 22 % par
rapport à la quantité de l'intermédiaire SAc) est obtenue
sous forme d'une laque incolore.
RMN-1-11 (D20, 400 MHz): 5 (ppm) = 2,69 (t, J=6,7 Hz, 2H) ;
3,00 (m, 1H) ; 3,12 (m, 1H) ; 3,23 (t, J=6,7 Hz, 2H) ; 4,43
(dd, J=8,5 Hz, J=4,2 Hz, 1H) ; 8,20 (s, 1H).
LCMS (APCI): 259,1 [M+H]+
CA 02949334 2016-11-16
W02015/181507
PCT/FR2015/051416
51
Exemple 31 : Préparation des composés 31 et 32
Préparation one pot du disulfure de l'iso-ovothiol A
via préparation in-situ de la 5-acetylsulfany1-1-
méthyl-histidine suivi par hydrolyse et oxydation
(Composé 31)
- o
o tHa
y 0
T.-C-(1-0H 2. NBS
Nr--- HSC
N 4. Oxyd
H2CH2CO2H
HO
5. ation Ne-;\
...--"
S¨s)........LOH
NH2
0
Composé 31
La 1-méthyl-L-histidine (0,84 g ; 5 mmoles; 1 éq.) est
dissoute dans 35 ml d'eau déminéralisée et une solution
d'acide chlorhydrique concentrée à 37% (835 pl (10 mmoles;
2 éq.) est ajoutée ; puis la solution est refroidie à 1 C.
L'agitation est maintenue très forte. Le N-bromosuccinimide
(1,17 g ; 6,5 mmoles; 1,3 éq.) est ajouté rapidement. Après
3 minutes, l'acide thioacétique (2,57 ml ; 2,74 g; 35
mmoles; 7 éq.) est ajouté très rapidement. L'agitation est
maintenue vigoureuse à 0 C pendant 30 minutes. La solution
est extraite avec 40 ml d'acétate d'éthyle puis l'acide 3-
mercaptopropionique (2,2 ml ; 2,65 g; 25 mmoles; 5 éq.) est
ajouté à la phase aqueuse. L'hydrolyse est effectuée par
chauffage à 100 C pendant 20h. Après refroidissement de la
solution, le milieu réactionnel est extrait par 4 fois 35
ml d'acétate d'éthyle. Après oxydation et purification avec
la résine DOWEX 50WX2-400, le disulfure de la L-1-méthyl-L-
5-sulfanylhistidine (Composé 31) (740 mg, 65%, 90 % par
rapport à la quantité de l'intermédiaire SAc) est obtenu
sous forme d'une poudre marron.
RMN-H1 (D20+DC1, 400 MHz): 5 (ppm) = 3,14 (m, 2x2H); 3,85
(s, 2x3H) ; 4,17 (m, 2x1H) ; 8,89 (s, 2x1H).
LCMS (APCI): 401,1 [M+H]+
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
52
Préparation de l'iso-ovothiol A (Composé 32)
N-%\
0
0
HO Réduction HS>rOH
0 OH
¨4\1N NH2
Composé 32
Le disulfure de la L-5-sulfany1-1-méthyl-histidine (Composé
25) (427 mg ; 0,52 mmoles, 1 éq.) est mis en suspension
dans 25 ml de méthanol. Le milieu est chauffé à 50 C puis
le dithiothréitol (299 mg ; 1,92 mmoles; 2 éq.) est ajouté.
Après agitation pendant lh à température ambiante et
précipitation avec de l'éther éthylique, la L-5-sulfany1-1-
méthyl-histidine (Iso-ovothiol A, Composé 32) (295 mg ;
69%) est obtenue sous forme d'une poudre légèrement
grisâtre.
RMN-H1 (D20, 400 MHz): 5 (ppm) = 3,19 (dd, J=15,7 Hz, J=7,2
Hz, 1H) ; 3,29 (dd, J=15,7 Hz, J=5,2 Hz, 1H) ; 3,66 (s,
3H) ; 4,09 (dd, J=7,1 Hz, J=5,2 Hz, 1H) ; 8,33 (s, 1H).
LCMS (APCI): 202,1 [M+H]+
Exemple 32 : Préparation du disulfure de la L-5-sulfanyl-
cx,N,N(diméthyl)-1-méthyl-histidine via hydrolyse du dérivé
5-acetylsulfanyl-cx,N,N(diméthyl)-1-méthyl-histidine suivi
par oxydation à l'air (Composé 33)
o
Nee\N¨
o 0 H20 ¨N OH oxydation (air) HO
0
OH ---a
¨N N,
/
¨N N,
/
Composé 33
Le composé 5 est préparé et purifié par colonne comme
décrit dans l'exemple 8. 180 mg (0,63 mmoles, 1 éq.) du
composé 5 sont solubilisés dans 20 ml d'eau. La solution
limpide est agitée en présence de l'oxygène pendant 20h à
température ambiante. Après lyophilisation, le disulfure de
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
53
la L-5-sulfanyl-a,N,N(diméthyl) -1-méthyl-histidine (Composé
33, 98%) est obtenu sous forme d'un solide amorphe
verdâtre.
RMN-H1 (D20, 400 MHz): ô (ppm) = 2,97 (s, 2x6H) ; 3,17 (m,
2x1H) ; 3,28 (dd, J=15,8 Hz et J=4,3 Hz, 2x1H) ; 3,69 (s,
2x3H) ; 4,00 (m, 2x1H) ; 8,44 (s, 2x1H).
LCMS (APCI): 457,2 [M+H]+.
Exemple 33 : Préparation one pot du disulfure de la L-
5-sulfanyl-cx,N,N,N(triméthyl)-1-méthyl-histidine (Composé
34 dichlorhydrate) via préparation in-situ de la L-5-
acétylsulfanyl-c,N,N(triméthyl)-1-méthyl-histidine suivi
par hydrolyse et oxydation
Ha
Ha
O tHa 0 i.,N, 0 _
r..{.....,1)L0 2. NBS S)...õ.r.?..-o- 4. Hydrolyse
N S
¨N 3. CH3COSH N 5. Oxydation le. /
S /N
0 0 N-2
Composé 34x2HC1
La 1-méthyl-hercynine (510 mg, 2 mmoles; 1 éq.) est
dissoute dans 15 ml d'eau déminéralisée contenant une
solution d'acide chlorhydrique concentrée à 37% (170 pl, 2
mmoles; 1 éq.), puis la solution est refroidie à 0 C.
L'agitation est maintenue très forte. Le N-bromosuccinimide
(465 mg, 2,6 mmoles; 1,3 éq.) est ajouté rapidement. Après
3 minutes, l'acide thioacétique (740 pl, 10 mmoles; 5 éq.)
est ajouté très rapidement. L'agitation est maintenue
vigoureuse à 0 C pendant 30 minutes. Le mélange est extrait
avec 2x20 ml d'acétate d'éthyle puis diluée dans 160 ml
d'un mélange acétate d'éthyle/éthanol (3/1) pour
purification sur une colonne de silice (acétate
d'éthyle/éthanol/eau 2/2/1). L'huile légèrement rose obtenu
est oxydé avec le diméthyle sulfoxyde (140 pl, 2 mmoles, 1
éq.) dans une solution d'acide acétique glacial. La
solution est chauffée pendant une heure à 80 C. Le
dichlorhydrate du disulfure de la L-5-sulfanyl-
,N,N,N(triméthyl)-1-méthyl-histidine (composé 34) est
obtenu après purification sur colonne de silice (acétate
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
54
d' éthyle/éthanol/eau 2/2/1 puis élution par l'acide
chlorhydrique 0,5M) sous forme d'une huile légèrement
jaune(110 mg, 10%).
RMN-H1 (D20, 400 MHz): ô (ppm) = 3,30 (s, 2x9H) ; 3,61 (dd,
J=14,1 Hz et 3,4 Hz, 2x1H) ; 3,72 (m, 2x1H) ; 3,73 (s,
2x3H) ; 4,09 (dd, J=12,2 Hz et 3,4 Hz, 2x1H) ; 8,98 (s,
2x1H).
LCMS (APCI): 485,1 [M+H]+
Exemple 34 : Préparation du dérivé L-5-sulfanyl-cx,N(L-
alany1)-histidine (Composé 35) par hydrolyse du composé 5-
acylsulfanyl
0
SH
)LS
N \ H20
0 H HN
H HN
NH2 NH2
Composé 35
Le composé 7 est préparé et purifié par colonne comme
décrit dans l'exemple 10. 340 mg (1 mmoles, 1 éq.) du
composé 7 sont solubilisés dans 20 ml d'eau. La solution
limpide est agitée à l'abri de l'oxygène pendant 6 jours à
température ambiante. Après évaporation à sec, la L-5-
sulfanyl-a,N(L-alany1)-histidine (Composé 35, 92%) est
obtenu sous forme d'un solide amorphe beige.
RMN-H1 (D20, 400 MHz): ô (ppm) = 1,42 (d, J=7,2 Hz, 3H) ;
3,12 (dd, J=15,2 et J=8,0 Hz, 1H) ; 3,22 (dd, J=15,2 Hz et
J=6,2 Hz, 1H) ; 4,05 (q, J=7,2 Hz, 1H) ; 4,65 (m, 1H) ;
8,71 (s, 1H).
LCMS (APCI): 258,9 [M+H]+
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
Exemple 35 : Préparation du disulfure de la 5-sulfanyl-
oc,N(pentanoy1)-histidine
(Composé 36) par hydrolyse et
oxydation du composé 5-acétylsulfanyl-cx,N(pentanoy1)-
5 histidine
o 0 o
o NH HN \N
HSCH2CH2CO2H H20
0
Nõ-NFI 7 ________________ [No ______________ - HO
H20 \ NH NH oxydation (air)
0
_
Composé 36
Le dérivé 5-
acetylsulfanyl-a,N(pentanoy1)-histidine
(composé 8) est préparé et purifié comme décrit dans
10 l'exemple 11. 320mg (0,9 mmoles; 1 éq.) du composé 8 sont
solubilisés dans 8,0 ml d'eau déminéralisée. L'acide 3-
mercaptopropionique (400 pl, 4,60 mmoles; 5 éq.) est
ajouté. La solution est chauffée à 90 C pendant 3h. Le
mélange réactionnel est extrait avec 4x10 ml d'acétate
15 d'éthyle, puis la phase aqueuse est évaporée à sec. Le
résidu est mis en solution dans 10m1 d'eau. La solution est
chauffée à 90 C sous agitation pendant 2 heures puis à
température ambiante pendant 18 heures. Après évaporation à
sec, le disulfure de la L-5-sulfanyl-a,N(pentanoy1)-
20 histidine
(Composé 36) est obtenu sous la forme d'une
laque orange (44%).
LCMS (APCI): 541,2 [M+H]+
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
56
Tableau 5 : Récapitulatif des exemples :
Composé
Exemple Structure
préparé
0
1 1
¨ NH2
2 1 N, ,NH
0
3 2
¨ N--
4 2 Nx NH /
3 0 0
6 3 N N
..,..NH /
S---40
N.----?
7 4 LN OH
H HN
0
NH2
0 0
8 5 )\---S>_LOH
¨N
....:N /
0 0
9 6
CA 02949334 2016-11-16
WO 2015/181507
PCT/FR2015/051416
57
0
S
___
7 __Z)H
N \
µ\---N 0
H HN
0
NH2
0
11 8
1%7
.,NH
,0 0
12 9 S>{,?L'OH
µ,NH /NH
OH
13 10
NFI Nhyo
0
\r0 tOH
14 11 S_____
NH
N./NH =
0
12 0
NH2
16 13 0
¨ NH2
17 13 N rN
----
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
58
II 0
18 14 OH
S
0 )=( ---?-1-H2
Nx NH
0
OH
19 15 =S
0 )---F1?-1 ---
HNN /
* 0
20 16
N
NNH /
OH
21 17
__ NH
NkvNI-1
I-12N
0
OH
22 18 HS)=(----?:H2
NN NH
0
23 19 HS
\H 1-1
NN NH
0
24 20 HS{.....OH
%.,....NH NH2
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
59
0
...._
OH
Fezy
fizz--N
NH2
21 x NH
25 S". _-
2 5
Nzz--õ,/NH
4HC1x2H2 0
HO
0 4 HCI
2 H20
r"--z--N 0
:z11:5_,...(syrrOH
N
2 6a 22 H
NH
.-- /
HO
N-zz..--./NH
0
0
__)_{. .?-1H-OH
2 6b 2 3 HS
NN NH /
0
OH
/ 1-11\_z_:)_,...;_L_ s_____,------N__
4HC1x2H2 0 _
2 4 x
..--N S- --- /
2 7a
Nzz-z/NH
H20
HO
0 HCI HCI H20
HCI HCI
0
OH
/---:----1\1
:
27b 24 S
NH
HO -0
I-11\ sy-t_
--N -
N..... .."
0
27c 25 OH
HS
C-?::¨
27d 25 NNH /
o
28a 26 HS).
N\ Al 1-4 ,NL.
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
28b 26
28c 26
28d 27 0 o_
\ +1-IN
28e 27 ¨N S's
NH
N,..õõ/
0
0
28f 27
0
HO 0
29a 28x2HC1OH
0
HCI NH.C/
HCI
0
29b 29 HS OH
NH
0
HS OH
30 30 NHNH
NH2
N
0
31a 31 HOOH
0
¨N NH2
0
31b 32 HSLOH
¨N NH2
CA 02949334 2016-11-16
WO 2015/181507 PCT/FR2015/051416
61
/ N¨
32
______(N
S 0
3 3 HO
¨N N,
\.....N /
HCI
HCI
33 3 4 x2HC1
--- i \
0 ,N
r
SH
3 4 3 5 N 0
H HN
NH2
NH FINN
/
0
35 36
Ho0-..s_s)___...?õOH
0
µ...{..m_i NH o
1