Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 03039276 2019-04-03
WO 2018/078276 1 PCT/FR2017/052932
COMPOSITION DE PEPTIDES DE COLLAGENE DE PEAU DE POISSON
ET SON UTILISATION A TITRE DE MÉDICAMENT
L'invention concerne une composition de peptides
de collagène de peau(x) de poisson(s). L'invention concerne en particulier une
telle composition de peptides obtenue par hydrolyse enzymatique de collagène
de
peau(x) de poisson(s). L'invention concerne également une telle composition
pour son utilisation à titre de médicament. L'invention concerne donc
l'utilisation d'une telle composition pour le traitement curatif ou préventif
d'une
pathologie affectant le corps humain ou animal. L'invention concerne en
particulier une telle composition pour son utilisation à titre de médicament
dans
le traitement d'une candidose digestive chez l'homme ou l'animal et/ou dans le
traitement d'une inflammation intestinale chez l'homme ou l'animal.
L'invention
concerne également une telle composition pour son utilisation à titre de
médicament dans un traitement stimulant du microbiote.
On connait de FR 2 720 067 une poudre de peptides
obtenue par hydrolyse par la papaïne d'une matière première riche en
collagène,
provenant de la peau ou du squelette de poissons, de mollusques ou de
crustacés.
Dans la poudre de peptides obtenue, 38 % des peptides présentent un poids
moléculaire compris entre 10 000 Da et 50 000 Da. La composition de peptides
de FR 2 720 067 présente une large gamme de poids moléculaires, en particulier
une proportion supérieure à 10 % de peptides dont le poids moléculaire est
supérieur à 10 000 Da. La composition de peptides de FR 2 720 067 est
hétérogène par la taille des peptides et présente une fraction de peptides
hydrosolubles seulement comprise entre 80% et 90%. De telles poudres de
peptides de haut poids moléculaire supérieur à 10 000 Da ne sont pas
parfaitement hydrosolubles. Elles ne sont également pas totalement absorbables
par le tube digestif et posent donc le problème de leur biodisponibilité.
FR 2 720 067 décrit aussi l'utilisation d'une telle poudre de
peptides obtenue à partir de poissons vivants dans les grandes profondeurs
dans
le traitement curatif d'une inflammation des tendons des articulations des
membres inférieurs (genoux, boulets et sabots) de chevaux de course.
CA 03039276 2019-04-03
WO 2018/078276 2 PCT/FR2017/052932
L'obtention d'une telle composition pose problème. Elle nécessite en effet le
prélèvement de poissons abyssaux. En outre, une telle poudre est limitée dans
son utilisation au traitement d'une inflammation articulaire.
L'invention vise donc à pallier ces inconvénients.
L'invention vise à proposer une nouvelle composition de
peptides issue d'une hydrolyse enzymatique de collagène de peau(x) de
poisson(s) d'eaux tempérées, lesdits peptides étant hydrosolubles -c'est à
dire
hydrosolubles à 100%- et totalement absorbables par le tube digestif.
L'invention vise également à proposer une nouvelle
composition de peptides formée par hydrolyse enzymatique de collagène de
peau(x) de poisson(s) d'eaux tempérées.
L'invention vise aussi à proposer une telle composition de
peptides susceptible de pouvoir être utilisée comme médicament.
L'invention vise en particulier à proposer une telle
composition de peptides issue d'une hydrolyse enzymatique de collagène de
peau(x) de poisson(s) d'eaux tempérées et susceptible de pouvoir être utilisée
comme médicament.
L'invention vise à proposer une telle composition de
peptides présentant en même temps une distribution de leurs poids moléculaires
apparents s'étendant sur un intervalle étroit compris entre une centaine et
quelques milliers de daltons, c'est-à-dire excluant des peptides de haut poids
moléculaires apparents, et présentant également une proportion faible de
peptides
de bas poids moléculaires apparents.
L'invention vise à proposer une telle composition de
peptides susceptible de pouvoir être utilisée comme médicament dans le
traitement de la candidose intestinale.
L'invention vise également à proposer une telle
composition de peptides susceptible de pouvoir être utilisée comme médicament
dans le traitement de maladies inflammatoires digestives, notamment de
maladies
inflammatoires chroniques de l'intestin (MICI).
L'invention vise également à proposer une telle
CA 03039276 2019-04-03
WO 2018/078276 3 PCT/FR2017/052932
composition de peptides susceptible de pouvoir être utilisée pour favoriser
l'équilibre et le maintien de la flore (ou microbiote) intestinale.
L'invention vise également à proposer l'utilisation d'une
telle composition de peptides issue d'une hydrolyse enzymatique de collagène
de
peau(x) de poisson(s) d'eaux tempérées à titre de complément alimentaire.
Pour ce faire, l'invention concerne une composition de
peptides présentant un aminogramme dans lequel :
- la glycine est en quantité molaire telle que le rapport de cette quantité
sur
la somme des quantités molaires des acides aminés dans la composition est
compris entre 20,0 % et 24,5 % ;
- l'hydroxyproline est en quantité molaire telle que le rapport de cette
quantité sur la somme des quantités molaires des acides aminés dans la
composition est compris entre 6,0 % et 12,0 %, notamment compris entre 7,0 %
et 11,0% ;
- la proline est en quantité molaire telle que le rapport de cette quantité
sur
la somme des quantités molaires des acides aminés dans la composition est
compris entre 10,6 % et 14,6 %, notamment compris entre 11,6 % et 13,6 %, en
particulier compris entre 12,1 % et 13,1 %, de préférence de l'ordre de 12,6 %
;
la composition de peptides présentant, lors d'une analyse par chromatographie
d'exclusion lors de laquelle chaque peptide de la composition de peptides est
élué avec un temps de rétention représentatif du poids moléculaire apparent de
ce
peptide, une courbe d'élution (c'est-à-dire une courbe d'élution d'un
chromatogramme) des peptides présentant une valeur d'aire sous la courbe
(c'est-à-dire une valeur d'aire représentative de la quantité massique de
peptides)
correspondant aux peptides de poids moléculaire apparent inférieur à 1400 Da
telle que le rapport de cette valeur d'aire sur l'aire totale sous la courbe
(correspondant à l'ensemble des peptides de la composition) est inférieur à 40
%,
notamment inférieur à 38 %, de préférence compris entre 30% et 38%, en
particulier compris entre 30 % et 35 % ;
ladite analyse étant réalisée comme décrit ci-après ;
o sur
une colonne de filtration de dimensions 300 x 7,8 mm comprenant
CA 03039276 2019-04-03
WO 2018/078276 4 PCT/FR2017/052932
une phase stationnaire formée d'un gel de silice d'une porosité de 5 Mm;
o la colonne étant maintenue à la température de 40 C;
o avec, à titre de phase mobile, une solution formée (A) d'eau ultra pure
comprenant 0,1% en volume d'acide trifluoroacétique et (B) d' acétonitrile,
dans laquelle le rapport volumique A/B est de 75/25 ;
o en introduisant en tête de la colonne de filtration sur gel un volume
d'une solution comprenant de la composition de peptides ;
o le débit de la phase mobile dans la colonne étant de 0,6 mL/min, et;
o les peptides de la composition étant détectés par absorbance à la
longueur d'onde de 214 nm.
Dans tout le texte, on entend par aminogramme , la liste
des acides aminés libres formant par enchainement (ou liaison) peptidique la
séquence d'un peptide ou les séquences des peptides d'un mélange de peptides.
Un tel aminogramme est obtenu par analyse -notamment par analyse globale ou
par analyse séquentielle- des acides aminés constitutifs d'un peptide ou d'un
mélange de peptides.
En particulier, on détermine la nature et la quantité des
acides aminés constitutifs des peptides de la composition selon l'invention
par
toute méthode d'analyse globale connue en elle-même de l'homme du métier. En
particulier, on réalise cette analyse conformément à la norme ISO 13903:2005
par dosage des acides aminés libres et totaux au moyen d'un analyseur d'acides
aminés ou au moyen d'un équipement de chromatographie liquide à haute
performance (CLHP). L'hydroxyproline est dosée par analyse en flux continu et
détection colorimétrique.
L'aminogramme obtenu par analyse globale de la
composition selon l'invention est représentatif de la composition en acides
aminés de collagène de peaux de poissons d'eaux tempérées. L'invention
concerne donc une telle composition de peptides issue d'une hydrolyse
enzymatique de collagène de peaux de poissons d'eaux tempérées par une
protéase à cystéine d'origine végétale -notamment une protéase de la classe
EC 3.4.22.2-. Les inventeurs ont découvert que l'utilisation d'une telle
protéase à
CA 03039276 2019-04-03
WO 2018/078276 5 PCT/FR2017/052932
cystéine permet d'obtenir une composition de peptides qui sont hydrosolubles
-c'est à dire hydrosolubles à 100%- et qui sont totalement absorbables par le
tube
digestif et qui présentent une répartition de poids moléculaires apparents qui
s'étend sur un intervalle étroit compris entre une centaine et quelques
milliers de
daltons, c'est-à-dire excluant des peptides de haut poids moléculaires
apparents,
et présentant également une proportion faible de peptides de bas poids
moléculaires apparents.
En outre, on réalise une séparation des peptides de la
composition de peptides selon l'invention en fonction de leur poids
moléculaire
apparent en soumettant la composition de peptides à une étape de séparation
analytique par chromatographie liquide sur une colonne de filtration sur gel
de
silice (BioSep-SEC-S2000, Phenomenex, Le Peck, France) poreuse et de haute
densité surfacique en groupements silanols.
On utilise à titre de phase mobile une solution comprenant
(A) de l'eau ultra pure additionnée d'acide trifluoroacétique (0,1% en volume)
et
(B) de l'acétonitrile (A/B ; 75/25 ; v/v). La colonne de filtration sur gel
est
maintenue à la température de 40 C pendant l'analyse. Le débit de la phase
mobile dans la phase stationnaire est de 0,6 mL/min. Le volume de composition
de peptides à analyser introduite en tête de colonne de gel filtration est de
25 lut
et la détection et réalisée en continu par absorbance à la longueur d'onde de
214 nm. On obtient un chromatogramme sur lequel chaque pic est caractérisé par
une valeur de durée ou de temps de rétention (exprimée en minutes suivant
l'introduction du mélange à analyser en tête de colonne) déterminée à la
valeur
maximale d'absorbance du pic. On détermine le poids moléculaire apparent de
chaque peptide correspondant à cette valeur de temps de rétention à la valeur
maximale d'absorbance de chaque pic au moyen d'une courbe d'étalonnage
prédéterminée obtenue par analyse -dans les mêmes conditions
chromatographiques que décrite ci-dessus- de peptides de poids moléculaires
apparents déterminés. On réalise par exemple une telle courbe d'étalonnage en
analysant dans ces mêmes conditions chromatographiques un mélange de
CA 03039276 2019-04-03
WO 2018/078276 6 PCT/FR2017/052932
peptides/protéines de référence et de poids moléculaires apparents connus et
compris entre 100 Da et 30 kDa.
Le chromatogramme représentant la variation d' absorbance
à 214 nm au cours de l'analyse chromatographique de la composition de peptides
selon l'invention, on détermine la proportion de peptides de poids moléculaire
apparent inférieur à 1400 Da en évaluant le rapport de la valeur de l'aire
s'étendant sous la courbe -c'est-à-dire la valeur de la somme des aires
s'étendant
sous les pics de la courbe- correspondant aux peptides de poids moléculaire
apparent inférieur à 1400 Da sur la valeur de l'aire totale s'étendant sous la
totalité de la courbe -c'est-à-dire la valeur de la somme des aires s'étendant
sous
chaque pic de la courbe- et correspondant à l'ensemble des peptides de la
composition de peptides.
L'invention concerne donc une composition de peptides
issus d'une hydrolyse enzymatique de collagène de peaux de poissons d'eaux
tempérées par une protéase à cystéine d'origine végétale, chaque peptide de la
composition présentant un nombre d'acides aminés compris entre 2 et quelques
dizaines, de préférence compris entre 2 acides aminés et 100 acides aminés.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la glycine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 20,0 % et 22,4 %,
notamment compris entre 20,0 % et 21,9 %, en particulier compris entre 20,4 %
et 21,4 %.
Dans certains autres modes de réalisation, la composition
selon l'invention présente un aminogramme dans lequel la glycine est en
quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 22,4 % et 24,9 %,
notamment compris entre 22,9 % et 24,4 %, en particulier compris entre 23,0 %
et 24,0 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'hydroxyproline est en
CA 03039276 2019-04-03
WO 2018/078276 7 PCT/FR2017/052932
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 7,0 % et 9,0
%,
en particulier compris entre 7,5 % et 8,5 %, de préférence compris entre 7,7 %
et
8,5 %.
Dans certains autres modes de réalisation, la composition
selon l'invention présente un aminogramme dans lequel l'hydroxyproline est en
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 9,5 % et
11,5 %, en particulier compris entre 10,0 % et 11,0 %, de préférence de
l'ordre
de 10,5 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'acide glutamique est en
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 8,0 % et
13,0 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'acide glutamique est en
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 8,0 % et
10,0 %, en particulier compris entre 8,5 % et 9,5 %, de préférence compris
entre
9,0 % et 9,5 %.
Dans certains autres modes de réalisation, la composition
selon l'invention présente un aminogramme dans lequel l'acide glutamique est
en
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 10,5 % et
12,5 %, en particulier compris entre 11,0 % et 12,0 %, de préférence de
l'ordre
de 11,6 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'arginine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 6,9 % et 10,9 %,
CA 03039276 2019-04-03
WO 2018/078276 8 PCT/FR2017/052932
notamment compris entre 7,9 % et 9,9 %, en particulier compris entre 8,0 % et
9,0 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'alanine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 7,3 % et 11,5 %,
notamment compris entre 8,0 % et 10,0 %, en particulier compris entre 8,1 % et
9,6 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'acide aspartique est en
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 3,1 % et 7,1
%,
notamment compris entre 4,1 % et 6,1 %, en particulier compris entre 4,6 % et
5,6 %, de préférence compris entre 5,0 % et 5,5 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la lysine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 1,5 % et 5,5 %,
notamment compris entre 2,5 % et 4,5 %, en particulier compris entre 3,0 % et
4,0 %, de préférence compris entre 3,1 % et 3,6 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la sérine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 1,5 % et 5,5 %,
notamment compris entre 2,5 % et 4,5 %, en particulier compris entre 3,0 % et
4,0 %, de préférence compris entre 3,2 % et 3,6 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la thréonine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0,7 % et 4,7 %,
notamment compris entre 1,7 % et 3,7 %, en particulier compris entre 2,2 % et
CA 03039276 2019-04-03
WO 2018/078276 9 PCT/FR2017/052932
3,2 %, de préférence compris entre 2,4 % et 2,8 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la leucine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0,6 % et 4,6 %,
notamment compris entre 1,6 % et 3,6 %, en particulier compris entre 2,1 % et
3,1 %, de préférence compris entre 2,4 % et 2,9 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la phénylalanine est en
quantité molaire telle que le rapport de cette quantité sur la somme des
quantités
molaires des acides aminés dans la composition est compris entre 0,3 % et 4,3
%,
notamment compris entre 1,3 % et 3,3 %, en particulier compris entre 1,8 % et
2,8 %, de préférence compris entre 1,8 % et 2,4 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la valine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0 % et 4,0 %,
notamment compris entre 1,0 % et 3,0 %, en particulier compris entre 1,5 % et
2,5 %, de préférence compris entre 1,8 % et 2,5 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'isoleucine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0 % et 3,5 %,
notamment compris entre 0,5 % et 2,5 %, en particulier compris entre 0,9 % et
2,0 %, de préférence compris entre 0,9 % et 1,6 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'hydroxylysine est en
quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0 % et 3,5 %,
notamment entre 0,5 % et 2,5 %, en particulier entre 1,0 % et 2,0 %, de
préférence de l'ordre de 1,5 %.
CA 03039276 2019-04-03
WO 2018/078276 10 PCT/FR2017/052932
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel l'histidine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0 % et 3,3%, notamment
compris entre 0 % et 2,3 %, en particulier compris entre 0,5 % et 1,5 .
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la méthionine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0 % et 2,5 %,
notamment compris entre 0 % et 2,0 %, en particulier compris entre 0,5 % et
1,8 %, de préférence compris entre 0,7 % et 1,6 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la tyrosine est en quantité
molaire telle que le rapport de cette quantité sur la somme des quantités
molaires
des acides aminés dans la composition est compris entre 0 % et 1,5 %,
notamment compris entre 0 % et 1,0 %, en particulier compris entre 0 % et
0,9 %, de préférence compris entre 0,2 % et 0,8 %.
Dans certains modes de réalisation, la composition selon
l'invention présente un aminogramme dans lequel la cystéine et la cystine sont
ensembles en quantité molaire telle que le rapport de cette quantité sur la
somme
des quantités molaires des acides aminés dans la composition est compris entre
0 % et 2 %, notamment entre 0 % et 1,0 %, en particulier entre 0 % et 0,5 %,
de
préférence de l'ordre de 0,03 %.
La composition selon l'invention présente un
aminogramme dans lequel les acides aminés essentiels (la lysine, la
méthionine,
la phénylalanine, la thréonine, la valine, la leucine et l'isoleucine et
l'histidine)
sont ensembles compris entre 15 % et 20 %.
Avantageusement, dans certains modes de réalisation selon
l'invention, au moins 90% -notamment au moins 95%- des peptides de la
composition de peptides présentent un poids moléculaire apparent inférieur à
15 000 Da (Dalton), notamment compris entre 200 Da et 15 000 Da, de
CA 03039276 2019-04-03
WO 2018/078276 11 PCT/FR2017/052932
préférence compris entre 200 Da et 14 000 Da, en particulier compris entre 200
Da et 13 000 Da. Avantageusement, dans certains modes de réalisation selon
l'invention, au moins 90% des peptides de la composition présentent un poids
moléculaire apparent compris entre 200 Da et 12 000 Da.
Les peptides de la composition selon l'invention présentent
une répartition de poids moléculaires apparents resserrée s'étendant sur un
intervalle étroit compris entre une centaine et quelques milliers de daltons,
c'est-
à-dire excluant des peptides de haut poids moléculaires apparents présentant
plus
de 100 acides aminés, et présentant également une proportion faible de
peptides
de bas poids moléculaires apparents.
Avantageusement, dans certains modes de réalisation selon
l'invention, les peptides de la composition présentent une valeur de poids
moléculaire apparent moyen comprise entre 2 500 Da et 3 600 Da, notamment
comprise entre 2700 Da et 3600 Da. Chaque peptide de la composition de
peptides selon l'invention présentant une contribution massique dans la
composition, la valeur du poids moléculaire apparent moyen de peptides de la
composition correspond à la moyenne de chaque valeur, dite valeur pondérée, du
poids moléculaire apparent de chaque peptide pondérée par une valeur
représentative de la contribution massique de chaque peptide dans la
composition. La valeur représentative de la contribution massique de chaque
peptide ou groupe de peptides dans la composition est exprimée en pourcentage
de la valeur de l'aire sous la courbe correspondant audit peptide ou audit
groupe
de peptides sur la valeur de l'aire totale sous la courbe correspondant à
l'ensemble des peptides de la composition.
En pratique, la valeur du poids moléculaire apparent
pondéré d'un groupe de peptides correspondant à un même pic d'un
chromatogramme correspond à la valeur du poids moléculaire apparent relevée
au sommet (maximum) de ce pic du chromatogramme, multipliée par le rapport
de la valeur de l'aire s'étendant sous la courbe de ce pic sur l'aire (totale)
s'étendant sous la courbe du chromatogramme. On entend par aire s'étendant
sous la courbe ou aire sous la courbe ou aire s'étendant sous le pic
ou
CA 03039276 2019-04-03
WO 2018/078276 12 PCT/FR2017/052932
aire sous le pic , l'aire de la surface s'étendant entre la courbe décrivant
le pic
du chromatogramme et la ligne de base du chromatogramme. En particulier,
l'aire sous l'un des pics du chromatogramme s'étend entre deux minima de la
courbe du chromatogramme encadrant un sommet (ou maximum) de la courbe du
chromatogramme.
Selon certains modes de réalisation, la composition de
peptides selon l'invention présente lors de son analyse par chromatographie
d'exclusion lors de laquelle chaque peptide de la composition de peptides est
élué
avec un temps de rétention représentatif du poids moléculaire apparent de ce
peptide, une courbe représentative de l'élution (c'est-à-dire un
chromatogramme) des
peptides présentant une valeur d'aire sous cette courbe (c'est-à-dire une
valeur d'aire
représentative de la quantité massique de peptides) correspondant aux peptides
de
poids moléculaire apparent supérieur à 10 000 Da -notamment compris entre 10
000 Da
et 50 000 Da telle que le rapport de cette valeur d'aire sur l'aire totale
sous la courbe
(correspondant à l'ensemble des peptides de la composition) est inférieur à 15
%,
notamment inférieur à 10 %. Selon certains modes particuliers de réalisation,
ce
rapport est compris entre 2.5 % et 8,5 %.
Selon d'autres modes particuliers de réalisation, la
composition de peptides selon l'invention peut être exempte de tout peptide de
haut poids moléculaire. Selon ces autres modes particuliers de réalisation, la
composition de peptides selon l'invention est formée de peptides
hydrosolubles.
Selon certains modes de réalisation, la composition de
peptides selon l'invention présente lors de son analyse par chromatographie
d'exclusion lors de laquelle chaque peptide de la composition de peptides est
élué
avec un temps de rétention représentatif du poids moléculaire apparent de ce
peptide, une courbe représentative de l'élution (c'est-à-dire un
chromatogramme) des
peptides présentant une valeur d'aire sous cette courbe (c'est-à-dire une
valeur d'aire
représentative de la quantité massique de peptides) correspondant aux peptides
de
poids moléculaire apparent compris entre 1 800 Da et à 10 000 Da telle que le
rapport
de cette valeur d'aire sur l'aire totale sous la courbe (correspondant à
l'ensemble des
peptides de la composition) est supérieur à 35% -notamment compris entre 35%
et 70%,
CA 03039276 2019-04-03
WO 2018/078276 13 PCT/FR2017/052932
en particulier compris entre 45% et 65%. Selon certains modes particuliers de
réalisation, ce rapport est compris entre 49 % et 55 %.
Selon certains modes de réalisation, la composition de
peptides selon l'invention présente lors de son analyse par chromatographie
d'exclusion lors de laquelle chaque peptide de la composition de peptides est
élué
avec un temps de rétention représentatif du poids moléculaire apparent de ce
peptide, une courbe représentative de l'élution (c'est-à-dire un
chromatogramme) des
peptides présentant une valeur d'aire sous cette courbe (c'est-à-dire une
valeur d'aire
représentative de la quantité massique de peptides) correspondant aux peptides
de
.. poids moléculaire apparent compris entre 600 Da et 1 800 Da telle que le
rapport de
cette valeur d'aire sur l'aire totale sous la courbe (correspondant à
l'ensemble des
peptides de la composition) est compris entre 15% et 45% -notamment compris
entre
20% et 40%, en particulier compris entre 25% et 35%. Selon certains modes
particuliers de réalisation, ce rapport est compris entre 27 % et 32 %.
Selon certains modes de réalisation, la composition de
peptides selon l'invention présente lors de son analyse par chromatographie
d'exclusion lors de laquelle chaque peptide de la composition de peptides est
élué
avec un temps de rétention représentatif du poids moléculaire apparent de ce
peptide, une courbe représentative de l'élution (c'est-à-dire un
chromatogramme) des
peptides présentant une valeur d'aire sous cette courbe (c'est-à-dire une
valeur d'aire
représentative de la quantité massique de peptides) correspondant aux peptides
de
poids moléculaire apparent inférieur à 600 Da telle que le rapport de cette
valeur d'aire
sur l'aire totale sous la courbe (correspondant à l'ensemble des peptides de
la
composition) est inférieur à 10%. Selon certains modes particuliers de
réalisation,
ce rapport est compris entre 8,5 % et 14,5 %.
Avantageusement, la composition selon l'invention,
présente par analyse chromatographique sur une colonne échangeuse d'anions
lors de laquelle chaque peptide de la composition de peptides est élué de la
colonne avec un temps de rétention représentatif de sa charge :
- une valeur d'aire sous un pic correspondant aux peptides anioniques ;
- une valeur d'aire sous un pic correspondant aux peptides neutres, et;
CA 03039276 2019-04-03
WO 2018/078276 14 PCT/FR2017/052932
- une valeur d'aire sous un pic correspondant aux peptides cationiques ;
telle que le rapport de cette valeur d'aire sous le pic correspondant aux
peptides
anioniques sur la somme des valeurs des aires sous les pics correspondants aux
peptides anioniques, aux peptides neutres et aux peptides cationiques de la
composition est compris entre 27,0 % et 45 %, notamment compris entre 30 % et
45 %, en particulier compris entre 35 % et 43 %, de préférence compris entre
35 % et 40 %;
la valeur de l'aire sous le pic correspondant aux peptides anioniques, la
valeur de
l'aire sous le pic correspondant aux peptides cationiques et la valeur de
l'aire
sous le pic correspondant aux peptides neutres étant déterminées par l'analyse
chromatographique dans des conditions décrites ci-après :
o en utilisant une colonne chromatographique de dimensions 100 x
7,8 mm comprenant à titre de phase stationnaire une résine hydrophile
échangeuse d'anions fonctionnalisée par des groupements ammonium
quaternaires, et de granulométrie de 10 Mm;
o en utilisant à titre de première phase mobile d'élution des peptides
cationiques et des peptides neutres, un tampon (C) aqueux Tris 5 mM à pH
8,35 pendant une durée de 7 minutes à compter de l'introduction en tête de
colonne de la composition à analyser, puis une deuxième phase mobile
d'élution des peptides anioniques dans laquelle le rapport du volume d'un
tampon (D) formé de Tris 5mM, NaCt 5 M à pH 8,35 sur le volume de
tampon (C ) augmente linéairement de 0 % à 100 % en 30 minutes ;
o avec un débit de la phase mobile de 1 mL/min dans la colonne ;
o l'analyse étant réalisée à une température de 25 C, et;
o avec une détection par absorbance à la longueur d'onde de 214 nm en
sortie de colonne.
Avantageusement selon l'invention, les peptides de la
composition selon l'invention présentent lors d'une analyse d'hydrophobie par
chromatographie liquide en phase inverse, un temps de rétention compris entre
16 min et 36 min ;
ladite analyse d'hydrophobie étant réalisée dans les conditions ci-après :
CA 03039276 2019-04-03
WO 2018/078276 15 PCT/FR2017/052932
O en utilisant une colonne de chromatographie de dimensions 250 x 4,6
mm présentant une phase stationnaire formée de silice greffée par des
groupements butyle, d'une valeur de granulométrie de 5 um et d'une valeur de
porosité de 300 A;
o en utilisant à titre de première phase mobile d'élution des peptides
hydrophiles, une solution (E) d'acide trifluoroacétique à 0,1% dans l'eau
ultrapure pendant une durée de 7 minutes à compter de l'introduction en tête
de colonne de la composition à analyser, puis une deuxième phase mobile
d'élution des peptides hydrophobes dans laquelle le rapport du volume d'une
solution (F) d'acide trifluoroacétique à 0,1% (en volume) dans l'eau
comprenant 40% d' acétonitrile sur le volume de la solution (E) augmente
linéairement de 0 % à 40 % en 30 minutes ;
o avec un débit de la phase mobile de 0,6 mL/min dans la colonne ;
o l'analyse étant réalisée à une température de 40 C, et;
o avec une détection par absorbance à la longueur d'onde de 214 nm en
sortie de colonne.
Dans certains modes de réalisation, une composition selon
l'invention comprend des peptides hydrophobes par nature qui sont élués de la
colonne ci-dessus mentionnées et dans les conditions ci-dessus précisées avec
un
temps de rétention correspondant à un pourcentage d' acétonitrile compris
entre
12 % et 38 %. Le temps de rétention médian des peptides de la composition
selon
l'invention est de 26 min correspondant à un pourcentage d' acétonitrile de 25
%
dans l'éluant.
Avantageusement selon l'invention, la composition de
peptides est à l'état liquide. Il peut s'agir d'une solution de la composition
de
peptides selon l'invention dans un solvant liquide, notamment dans un solvant
aqueux.
Avantageusement selon l'invention, la composition de
peptides est à l'état solide. La composition de peptides peut être sous la
forme
d'un solide à l'état divisé. Il peut s'agir en particulier d'un solide à
l'état au
moins partiellement déshydraté. La composition de peptides selon l'invention
CA 03039276 2019-04-03
WO 2018/078276 16 PCT/FR2017/052932
peut être sous forme d'une poudre.
Avantageusement selon l'invention, la composition de
peptides est exempte d'hydrate de carbone.
Avantageusement selon l'invention, la composition de
peptides est exempte de matière grasse.
Avantageusement selon l'invention, la matière sèche de la
composition de peptides comprend une proportion massique de peptides de
collagène supérieure à 95%, notamment supérieure à 99%. Ainsi, la composition
de peptides présente une quantité de peptides de collagène telle que le
rapport de
la masse des peptides de collagène de la matière sèche de la composition de
peptides sur la masse de matière sèche de la composition de peptides est
supérieur à 95%, notamment supérieur à 99%.
Avantageusement selon l'invention, les peptides de la
composition sont hydrosolubles. Avantageusement, les peptides de la
composition de peptides sont solubles à 100% dans l'eau. Avantageusement, la
composition de peptides est hydro-compatible.
Avantageusement selon l'invention, les peptides de la
composition de peptides sont issus d'une hydrolyse enzymatique contrôlée de
collagène de peau d'au moins un poisson choisi dans le groupe formé des
poissons de la famille des Pan gasiidae -notamment de Pan gasius hypophtalmus
(ou Pan gasianodon hypophtalmus), de Pagasius pan gasius, de Pan gasius
bocourti- et de la famille des Cichlidae -notamment du genre Oreochromis, en
particulier d'Oreochromis niloticus ou du genre Tilapia -. Avantageusement,
les
peptides de la composition de peptides sont issus d'une hydrolyse enzymatique
contrôlée de collagène de peau d'au moins un poisson péché dans une eau
tempérée d'une région tempérée.
L'invention s'étend également à l'utilisation d'une telle
composition de peptides dans un traitement thérapeutique du corps humain ou
animal. L'invention s'étend donc également à une telle composition de peptides
pour son utilisation à titre de médicament. L'invention s'étend donc à une
telle
composition de peptides pour son utilisation à titre de médicament dans le
CA 03039276 2019-04-03
WO 2018/078276 17 PCT/FR2017/052932
traitement préventif ou curatif d'au moins une pathologie du corps humain ou
animal.
L'invention s'étend également en particulier à une
composition de peptides pour son utilisation comme médicament dans au moins
l'un des traitements suivants :
- traitement d'une pathologie digestive ;
- traitement d'une candidose intestinale ;
- traitement d'une inflammation digestive, et;
- maintien du microbiote intestinal.
L'invention s'étend également à toute utilisation d'une
composition de peptides selon l'invention en alimentation humaine. Selon
certains modes de réalisation, l'invention s'étend également à toute
utilisation
d'une composition de peptides selon l'invention en alimentation humaine à
l'exclusion de toute utilisation à titre de médicament. En particulier,
avantageusement la composition selon l'invention est utilisée à titre de
complément alimentaire.
L'invention s'étend également à une composition de
peptide obtenue par un procédé dans lequel :
- on sélectionne des peaux de poissons d'eaux
tempérées -notamment de la famille des Pan gasiidae et/ou de la famille des
Cichlidae-, puis ;
- on réalise successivement :
. au moins une étape de lavage des peaux, puis ;
. au moins une étape de traitement acide ou alcalin des peaux adapté
pour permettre une extraction d'au moins une partie du collagène des peaux,
puis ;
. au moins une étape d'hydrolyse du collagène par au moins une
protéase à cystéine d'origine végétale -en particulier au moins une protéase
de
Carica papaia- à une température inférieure à 75 C, puis ;
. une interruption de l'hydrolyse enzymatique par chauffage de
l'hydrolysat de collagène à une température supérieure à la température de
CA 03039276 2019-04-03
WO 2018/078276 18 PCT/FR2017/052932
dénaturation de chaque protéase à cystéine de façon à former la composition de
peptides.
Avantageusement, dans un procédé selon l'invention, après
l'étape de traitement acide ou alcalin des peaux, on réalise au moins une
extraction liquide/solide du collagène dans de l'eau portée à une température
comprise entre 60 C et 98 C. Avantageusement, dans un procédé selon
l'invention, on réalise ensuite une étape de séparation -notamment une étape
de
séparation par décantation- d'une fraction comprenant des matières solides (et
des matières grasses) et d'une solution comprenant le collagène extrait, puis
on
soumet la solution comprenant le collagène extrait à une étape de
purification,
par exemple par filtration sur terres et/ou déminéralisation sur une résine
échangeuse d'ions, adaptée pour former une solution purifiée comprenant du
collagène, la matière sèche de la solution purifiée comprenant une proportion
massique de collagène d'au moins 99%, notamment d'au moins 99,5%, en
particulier d'au moins 99,8%. On forme une solution purifiée de collagène
comprenant du collagène sensiblement pur. En particulier, on forme une telle
solution purifiée de collagène sensiblement incolore. En particulier, on forme
une
telle solution purifiée de collagène sensiblement -notamment totalement-
exempt
d'élastine. On concentre la solution purifiée de façon à former un gel de
collagène purifié et on soumet ensuite le gel de collagène purifié à l'étape
d'hydrolyse du collagène.
Un tel procédé permet l'obtention d'une composition de
peptides selon l'invention sensiblement incolore. Un tel procédé permet
l'obtention d'une composition de peptides selon l'invention sensiblement
exempte d'élastine. En particulier il permet l'obtention d'une telle
composition
de peptides selon l'invention sans aucune étape chromatographique de
purification de la composition de peptides.
Dans un tel procédé, avantageusement et selon l'invention,
on réalise une étape ultérieure de filtration de la composition de peptides.
Avantageusement, on réalise également une étape de pasteurisation de la
composition de peptides pendant une durée d'au moins 2 minutes à une
CA 03039276 2019-04-03
WO 2018/078276 19 PCT/FR2017/052932
température de pasteurisation comprise entre 85 C et 90 C minimum.
Dans un tel procédé, avantageusement et selon l'invention,
on réalise une étape de séchage de la composition de peptides. On réalise
cette
étape de séchage par atomisation de façon à former une composition selon
l'invention sensiblement déshydratée et sous la forme d'une poudre.
L'invention s'étend donc à une composition de peptides
obtenue par un procédé dans lequel :
- on sélectionne des peaux de poissons d'eaux
tempérées -notamment de la famille des Pan gasiidae et/ou de la famille des
Cichlidae-, puis ;
- on réalise successivement :
. au moins une étape de lavage des peaux, puis ;
. au moins une étape de traitement acide des peaux adapté pour
permettre une extraction d'au moins une partie du collagène des peaux, puis ;
. au moins une étape d'hydrolyse du collagène par au moins une
protéase à cystéine d'origine végétale -en particulier au moins une protéase
de
Carica papaia- à une température inférieure à 75 C, puis ;
. une interruption de l'hydrolyse enzymatique par chauffage de
l'hydrolysat de collagène à une température supérieure à la température de
dénaturation de chaque protéase à cystéine de façon à former la composition de
peptides ;
ladite composition de peptides présentant une analyse globale des acides
aminés
dans laquelle :
- la glycine est en quantité molaire telle que le rapport de cette quantité
sur
la somme des quantités molaires des acides aminés dans la composition est
compris entre 20,0 % et 24,5 % ;
- l'hydroxyproline est en quantité molaire telle que le rapport de cette
quantité sur la somme des quantités molaires des acides aminés dans la
composition est compris entre 6,0 % et 12,0 % ;
- la proline est en quantité molaire telle que le rapport de cette quantité
sur
la somme des quantités molaires des acides aminés dans la composition est
CA 03039276 2019-04-03
WO 2018/078276 20 PCT/FR2017/052932
compris entre 10,6 % et 14,6 %;
la composition de peptides présentant, lors d'une analyse par chromatographie
d'exclusion lors de laquelle chaque peptide de la composition de peptides est
élué avec un temps de rétention représentatif du poids moléculaire apparent de
ce
peptide, une courbe d'élution (c'est-à-dire une courbe ou un profil d'élution
d'un
chromatogramme) des peptides présentant une valeur d'aire sous la courbe
(c'est-à-dire une valeur d'aire représentative de la quantité massique de
peptides)
correspondant aux peptides de poids moléculaire apparent inférieur à 1400 Da
telle que le rapport de cette valeur d'aire sur l'aire totale sous la courbe
(correspondant à l'ensemble des peptides de la composition) est inférieur à
40 % ;
ladite analyse étant réalisée comme décrit ci-après ;
o sur une colonne de filtration de dimensions 300 x 7,8 mm comprenant
une phase stationnaire formée d'un gel de silice d'une porosité de 5 Mm;
o la colonne étant maintenue à la température de 40 C;
o avec, à titre de phase mobile, une solution formée (A) d'eau ultra pure
comprenant 0,1% en volume d'acide trifluoroacétique et (B) d'acétonitrile,
dans laquelle le rapport volumique A/B est de 75/25 ;
o en introduisant en tête de la colonne de filtration sur gel un volume
d'une solution comprenant de la composition de peptides ;
o le débit de la phase mobile dans la colonne étant de 0,6 mL/min, et;
o les peptides de la composition étant détectés par absorbance à la
longueur d'onde de 214 nm.
L'invention concerne également une composition de
peptides, une telle composition de peptides pour son utilisation comme
médicament, un procédé d'obtention d'une telle composition de peptides et une
telle composition de peptides obtenue par un tel procédé d'obtention
caractérisés
en combinaison par tout ou partie des caractéristiques mentionnées ci-dessus
ou
ci-après.
D'autres buts, caractéristiques et avantages de l'invention
apparaîtront à la lecture de la description suivante donnée à titre non
limitatif et
CA 03039276 2019-04-03
WO 2018/078276 21 PCT/FR2017/052932
qui se réfère aux figures annexées, dans lesquelles :
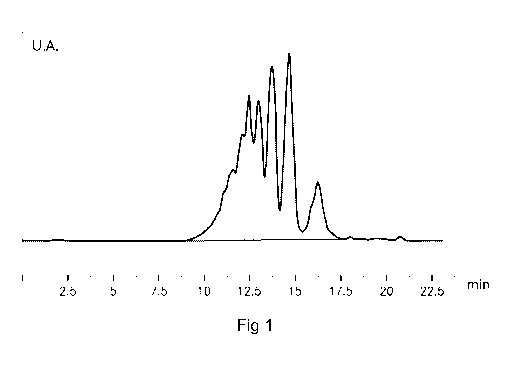
¨ la figure 1 est un chromatogramme représentatif d'une
analyse d'une composition de peptides selon l'invention par filtration sur
gel;
¨ la figure 2 est un chromatogramme représentatif d'un
analyse HPLC d'une composition de peptides selon l'invention sur une résine
échangeuse d'anions ;
¨ la figure 3 est un chromatogramme représentatif d'un
analyse d'une composition de peptides selon l'invention par chromatographie en
phase inverse ;
¨ la figure 4 est une représentation graphique
représentative de l'évolution de la masse corporelle de souris dont
l'inflammation colique est induite par le dextran sulfate de sodium (DSS) ;
¨ la figure 5 est une représentation graphique en
histogramme du résultat d'un dosage d'IL113 dans le colon de souris par la
méthode ELISA ;
¨ la
figure 6 est une représentation graphique en
histogramme du résultat d'un dosage d'IL6 dans le colon de souris par la
méthode ELISA ;
¨ la figure 7 est une représentation graphique en
histogramme du résultat d'un dosage de TNF-oc dans le colon de souris par la
méthode ELISA ;
¨ la figure 8 est une représentation graphique en
histogramme du résultat d'un dosage de TGF13 dans le colon de souris par la
méthode ELISA ;
¨ la figure 9 est une représentation graphique en
histogramme du résultat d'un dosage par PCR de la flore fongique dans le colon
de souris ;
¨ la figure 10 est une représentation graphique en
histogramme du résultat d'un dosage par PCR de Saccharomyces cerevisiae dans
le colon de souris ;
CA 03039276 2019-04-03
WO 2018/078276 22 PCT/FR2017/052932
¨ la figure 11 est une représentation graphique en
histogramme du résultat d'un dosage par PCR des entérobactéries dans le colon
de souris ;
¨ la figure 12 est une représentation graphique en
histogramme du résultat d'un dosage par PCR des firmicutes dans le colon de
souris ;
¨ la figure 13 est une représentation graphique en
histogramme du résultat d'un dosage par PCR des bacteroidetes dans le colon de
souris ;
¨ la figure 14 est une représentation graphique en
histogramme du résultat d'un dosage par PCR de Faecalibacterium prausnitzii
dans le colon de souris ;
¨ la figure 15 est une représentation graphique en
histogramme du résultat d'un dosage par PCR de Lactobacille murinus dans le
colon de souris ;
¨ la figure 16 est une représentation graphique en
histogramme d'une analyse par RT-PCR quantitative des ARN messagers du
TGF-(3 dans le colon de souris ;
¨ la figure 17 est une représentation graphique en
histogramme d'une analyse par RT-PCR quantitative des ARN messagers de la
NO-synthase inductible (iNOS) dans le colon de souris, et;
¨ la figure 18 est une représentation graphique en
histogramme d'une analyse par RT-PCR quantitative des ARN messagers de
Fizz 1 dans le colon de souris ;
¨ la figure 19 est une représentation graphique en
histogramme d'une analyse par RT-PCR quantitative des ARN messagers de la
5-LOX dans le colon de souris ;
¨ la figure 20 est une représentation graphique en
histogramme d'une analyse par RT-PCR quantitative des ARN messagers de la
12/15-LOX dans le colon de souris.
CA 03039276 2019-04-03
WO 2018/078276 23 PCT/FR2017/052932
Procédé de préparation d'une composition selon l'invention
On prélève ou on achète des peaux de poissons d'eaux de
régions tempérées, notamment de poisson de la famille des Pan gasiidae
-notamment de Pan gasius hypophtalmus (ou Pan gasianodon hypophtalmus), de
Pagasius pan gasius, de Pan gasius bocourti- et/ou de poisson-chat ou de la
famille des Cichlidae -notamment du genre Oreochromis, en particulier
d'Oreochromis niloticus ou du genre Tilapia-.
On réalise une succession d'étapes de lavage de la peau, de
traitement acide de la peau lavée et d'extraction et de purification du
collagène.
On réalise ensuite une étape d'hydrolyse enzymatique du collagène de peaux de
poissons ainsi obtenu de façon à former la composition selon l'invention. Pour
ce
faire, on chauffe de l'eau à une température comprise entre 70 C et 75 C. On
verse progressivement dans l'eau chaude et sous agitation une masse de
collagène de peaux de poissons telle que la proportion de massique de
collagène
dans l'eau soit de 45%, et on ajuste le pH de la solution à pH 6,0. On ajoute
ensuite à la solution de collagène refondu une quantité de protéase à cystéine
d'origine végétale. On choisit à titre de protéase à cystéine au moins une
protéase
de Carica papaïa, notamment la lypaine (Lypainee LYVEN, Collombelles,
France) à l'état sec. Le rapport de la masse de protéase à cystéine sur la
masse de
collagène est adapté selon les conditions d'hydrolyse souhaitées. Par exemple,
Le
rapport de la masse de protéase à cystéine sur la masse de collagène est de
0,2%.
On maintient la température de la solution à une valeur comprise entre 65 C et
70 C adaptée pour favoriser l'activité enzymatique de la protéase à cystéine
et
pour maintenir la fluidité optimale de l'hydrolysat de collagène en tenant
compte
du fait que la viscosité de l'hydrolysat de collagène diminue avec le temps
d'hydrolyse. On maintient la solution à cette température pendant une durée de
l'ordre de 45 minutes.
On stoppe la réaction d'hydrolyse enzymatique par
chauffage de l'hydrolysat de collagène à une température supérieure à la
température de dénaturation de la protéase à cystéine, par exemple à une
température comprise entre 85 C et 90 C pendant 20 minutes. L'hydrolysat de
CA 03039276 2019-04-03
WO 2018/078276 24 PCT/FR2017/052932
collagène de peaux de poisson est éventuellement soumis à une étape de
filtration
puis à une étape de pasteurisation pendant une durée d'au moins 2 minutes à
une
température de pasteurisation comprise entre 85 C et 90 C minimum.
L'hydrolysat de collagène ou peptides de collagène est
ensuite soumis à une étape de séchage dans des conditions propres à former une
composition selon l'invention formée d'une poudre de granulométrie
prédéterminée.
Caractérisations structurelles des peptides de la
composition selon l'invention
Composition en acides aminés
On réalise une caractérisation de la composition de
peptides issus d'une hydrolyse de collagène de peaux de poissons d'eaux
tempérées selon l'invention par dosage des acides aminés libres et totaux au
moyen
d'un analyseur d'acides aminés ou au moyen d'un équipement de chromatographie
liquide à haute performance (CLHP/HPLC) conformément à la norme ISO
13903:2005.
A titre de comparaison, on détermine la composition en acides aminés d'un
hydrolysat
de collagène de peaux de poissons d'eaux froides (colin d'Alaska, Alaska
pollock ),
péchés dans les eaux profondes de la mer de Béring (Alaska). Les résultats
comparatifs
sont présentés au tableau 6 ci-après.
Acide aminé, Collagène de poisson d'eau
Collagène de poisson d'eau froide
% en moles tempérée selon l'invention à titre de comparaison
Glycine 20,0 -24,5 25,1 - 34,7
Alanine 7,3 - 11,3 8,6 - 10,9
Proline 10,6 - 14,6 8,4 - 9,8
Acide glutamique 8,0 - 13,0 4,2 - 6,8
Sérine 1,5 - 5,5 6,3 - 8,6
Arginine 6,9 - 10,9 6,2 - 10,3
Hydroxyproline 6,0 - 12,0 5,2 - 5, 5
Acide aspartique 3,1 - 7,1 3,7 - 5,2
Thréonine 0,7 - 4,7 3,3 - 3,7
Lysine 1,5 - 5,5 3,2 - 4,5
Leucine 0,6 - 4,6 1,8 - 3,6
Valine 0 - 4,0 1,6 - 2,9
CA 03039276 2019-04-03
WO 2018/078276 25 PCT/FR2017/052932
Histidine 0 ¨ 3,3 1,5 ¨ 1,6
Phénylalanine 0,3 ¨ 4,3 1,3 ¨ 2,4
Méthionine 0 ¨ 2,5 1,2 ¨ 2,9
Isoleucine 0¨ 3,5 1,0¨ 2,0
Hydroxylysine 0¨ 3,5 0 - 0,9
Tyrosine 0¨ 1,5 0,3¨ 1,0
Cystéine 0¨ 2,0 0
Tryptophane 0 0
Tableau 6
On réalise également une caractérisation d'une composition
de peptides selon l'invention par la distribution des poids moléculaires
apparents
des peptides, par la polarité des peptides et pas l'hydrophobie des peptides.
Analyse des poids moléculaires apparents des peptides
On analyse la distribution en poids moléculaires apparent
des peptides constitutifs d'une composition selon l'invention par perméation
de
gel sur une colonne de chromatographie liquide de dimensions 300 x 7,8 mm
dans laquelle la phase stationnaire est constituée d'un gel à base de silice
(BioSep-SEC-S2000, Phénomenex, Le Peck, France) d'une porosité de 5 !am. La
colonne de filtration étant maintenue à une température de 40 C. La phase
mobile est constituée d'un mélange comprenant (A) de l'eau ultra pure
additionnée d'acide trifluoroacétique (0,1% en volume) et (B) de
l'acétonitrile
(A/B ; 75/25 ; v/v). Le débit de la phase mobile est maintenu à 0,6 mL/min. Le
volume de la solution comprenant la composition de peptides à analyser est de
L. La détection est réalisée en sortie de la colonne de perméation de gel par
la mesure d' absorbance à la longueur d'onde de 214 nm. On réalise en
parallèle
une courbe d'étalonnage de détermination d'un poids moléculaire apparent en
fonction du temps de rétention. Pour réaliser cette courbe d'étalonnage on
choisit
20 des peptides connus de poids moléculaire compris entre 100 Da et 30 kDa.
Les
étalons connus sont la proline, la glutathionne, la ribonucléase A et la
trypsine,
de poids moléculaires apparents respectifs de 115 Da, 307 Da, 13,7 kDa et 28,2
kDa.
CA 03039276 2019-04-03
WO 2018/078276 26 PCT/FR2017/052932
Les poids moléculaires apparents et les temps de rétention
exprimés en minutes des étalons sont donnés au tableau 1 ci-après :
Etalon PM, Da Temps de rétention, min
Proline 115 17.193
Glutathionne 307 16.938
Ribonucléase A 13700 10.275
Trypsine 28161 10.232
Tableau 1
Les peptides sont élués de la colonne successivement en
fonction de leur poids moléculaire apparent décroissant. Les valeurs des temps
de
rétention de chaque famille de peptides de la composition à analyser
correspondant à un pic du chromatogramme sont relevées au sommet de chaque
pic du chromatogramme et traduites en valeur de poids moléculaire apparent par
comparaison avec la courbe d'étalonnage. Les valeurs relatives des quantités
de
chaque famille de peptides correspondent à la valeur de l'air sous la courbe
correspondant à chaque pic du chromatographe. Ces valeurs sont exprimées par
le rapport de la valeur de l'aire sous la courbe correspondant à une famille
de
peptides sur la somme des valeurs des aires de chaque famille de peptides.
Les valeurs des temps de rétention (min), des poids
moléculaires apparents correspondant (Da) et du pourcentage de l'aire sous la
courbe (exprimée en pourcentage de l'aire totale sous la courbe) correspondant
à
chaque famille de peptides du chromatogramme représenté en figure 1 sont
données au tableau 2 ci-après. On identifie chaque groupe de peptides
correspondant à un pic du chromatogramme par la valeur du poids moléculaire
apparent correspondant au maximum de ce pic du chromatogramme.
Temps de rétention (min) Poids moléculaire Aire sous la courbe (%)
apparent (Da)
11,130 10869 6,6
11,560 8096 7,0
12,072 5703 9,6
12,430 4461 13,0
CA 03039276 2019-04-03
WO 2018/078276 27 PCT/FR2017/052932
12,962 3100 13,6
13,678 1897 19,0
14,638 983 21,6
16,217 333 9,6
Tableau 2
La proportion de peptides de la composition selon
l'invention -dont le chromatogramme est représenté en figure 1 et dont les
valeurs sont données au tableau 2- dont le poids moléculaire apparent est
inférieur à 1400 Da est de 31,2 % (poids moléculaires apparents de valeurs
983 Da et 333 Da) par rapport à l'ensemble des peptides de la composition.
Le poids moléculaire apparent moyen des peptides de la
composition selon l'invention dont les valeurs de poids moléculaire apparent
sont
données au tableau 2 est de 3442 Da. On définit le poids moléculaire apparent
moyen des peptides de la composition comme la moyenne des valeurs de poids
moléculaires apparents pondérés correspondant à chaque groupe de peptides de
la composition correspondant à un même pic du chromatogramme. La valeur du
poids moléculaire apparent pondéré d'un groupe de peptides d'un même pic du
chromatogramme correspond à la valeur du poids moléculaire apparent au
sommet (maximum) du pic pondérée par le rapport de la valeur de l'aire sous la
courbe du pic correspondant sur l'aire (totale) sous la courbe du
chromatogramme. On entend par aire sous la courbe ou aire sous le pic ,
l'aire de la surface s'étendant entre la courbe décrivant le pic du
chromatogramme et la ligne de base du chromatogramme. En particulier, l'aire
sous l'un des pics du chromatogramme s'étend entre deux minima de la courbe
du chromatogramme encadrant un sommet (ou maximum) de la courbe du
chromatogramme.
A titre de la généralisation, sont présentées au tableau 3 ci-
après, les valeurs moyennes des temps de rétention (min), des poids
moléculaires
apparents correspondant (Da) et du pourcentage de l'aire sous la courbe de
chaque famille de peptides correspondant à des analyses distinctes de trois
compositions de peptides selon l'invention.
CA 03039276 2019-04-03
WO 2018/078276 28 PCT/FR2017/052932
Temps de rétention (min) Poids moléculaire (Da) Aire (%)
11,13 0,15 10870 830 4,6 2
11,50 0,20 8596 700 5,6 2
11,7 0,1 7180 100 4,5 1
12,27 0,3 5703 400 9,6 2
12,45 0,20 4430 100 13,0 1
13,00 0,06 3100 100 13,5 1
13,67 0,06 1870 40 20,0 1
14,64 0,02 983 20 22,5 2
16,18 0,04 340 10 12,0 2,5
16,79 0,01 224 5 0,7 0,15
Tableau 3
La proportion moyenne de peptides de compositions selon
l'invention -dont les valeurs sont données au tableau 3- et dont le poids
moléculaire est inférieur à 1400 Da est de 35,2 % (correspondants
essentiellement aux poids moléculaires apparents de 983 Da et de 340 Da).
Analyse de la polarité des peptides constitutifs
On analyse la proportion de peptides anioniques dans la
composition selon l'invention dont la distribution des poids moléculaires
apparents est donnée au tableau 2, c'est-à-dire la proportion de peptides
présentant une charge négative à pH 8,35. On analyse également la proportion
de
peptides neutres et/ou cationiques dans la composition selon l'invention,
c'est-à-
dire la proportion de peptides présentant une charge globalement neutre à pH
8,35 ou présentant une charge positive à pH 8,35. On réalise une telle analyse
par
chromatographie liquide haute performance (HPLC) d'échange d'ions dans
laquelle la phase stationnaire est une résine échange d'anions (Hydrophase HP-
SAX, Interchim, Montluçon, France) de granulométrie 10 Luini. La colonne de
chromatographie HPLC d'échange d'ions est de dimensions 100 x 7,8 mm.
On conditionne la colonne de chromatographique HPLC
par échange d'ions dans un tampon tris(hydroxyméthyl)aminométhane) (Tris) à
une concentration de 5 mM dans l'eau et dont le pH est ajusté à la valeur de
8,35.
CA 03039276 2019-04-03
WO 2018/078276 29 PCT/FR2017/052932
La température de la colonne est maintenue une température de 25 C. Le débit
de
la phase mobile dans la colonne et de 1 mL/min. On prépare un échantillon de
la
composition de peptides à analyser de sorte que sa concentration soit de 2 g/L
par
dilution dans l'eau ultrapure. On introduit en tête de colonne un volume de 90
luiL
de cette solution à analyser. La détection est réalisée par mesure de
l'absorbance
en continu à 214 nm.
A compter de l'introduction de l'échantillon en tête de la
colonne, la phase mobile est constituée de Tris 5 mM à pH 8,35 (solution A)
pendant une durée de 7 minutes, puis d'une phase mobile dans laquelle une
solution B formée de Tris 5mM, NaCt 5 M, pH 8,35 augmente linéairement de 0
% à 100 % dans la solution A en 30 minutes. On maintient ensuite l'élution par
la
solution B pendant 2 minutes.
Le chromatogramme obtenu est représenté en figure 2. Les
peptides anioniques sortent de la colonne avec un temps de rétention compris
entre 10 min et 17,5 min correspondants à une concentration en NaCt comprise
entre 0,5 M et 1,7 M. La proportion de peptides anioniques dans la composition
de peptides selon l'invention dont l'analyse représentée en figure 2 est de
36,9 %.
Les peptides neutres et cationiques sortent de la colonne avec un temps de
rétention comprise entre 1 minute et 8 minutes. La proportion de peptides
neutres
et cationiques dans la composition de peptides selon l'invention dans
l'analyse
représentée en figure 2 est de 57,5 %.
A titre de la généralisation, on reproduit cette analyse sur
trois compositions de peptides selon l'invention. La proportion moyenne de
peptides anioniques dans ces compositions selon l'invention est comprise entre
27,9 % et 42,5 % et la proportion moyenne de peptides neutres et cationiques
dans ces compositions selon l'invention est comprise entre 57,5 % et 72,1 %.
Analyse de l'hydrophobie des peptides constitutifs
On analyse l'hydrophobie des peptides constitutifs de la
composition selon l'invention par chromatographie liquide en phase inverse sur
une colonne de silice greffée par des groupements butyle (Vydac 214TPTm C4,
CA 03039276 2019-04-03
WO 2018/078276 30 PCT/FR2017/052932
Grace, Epernon, France) de dimensions 250 x 4,6 mm. La granulométrie de la
silice est de 5 pim et sa porosité est de 300 A.
On conditionne la colonne dans l'eau ultrapure acidifiée
avec 0,1 % d'acide trifluoroacétique. La température de la colonne est
maintenue
une température de 40 C. Le débit de la phase mobile dans la colonne et de 0,6
mL/min. On prépare un échantillon de la composition de peptides à analyser de
sorte que sa concentration soit de 2 g/L par dilution dans l'eau ultrapure. On
introduit en tête de colonne un volume de 100 luiL de cette solution à
analyser. La
détection est réalisée par mesure de l'absorbance en continu à la longueur
d'onde
de 214 nm.
A compter de l'introduction de l'échantillon en tête de la
colonne, la phase mobile est constituée d'eau acidifiée (solution A) pendant
une
durée de 7 minutes, puis d'une phase mobile dans laquelle une solution B
formée
d'eau acidifiée avec 0,1% (en volume) d'acide trifluoroacétique et comprenant
40% d'acétonitrile augmente linéairement de 0 % à 100 % dans la solution A en
30 minutes.
Le chromatogramme obtenu est représenté en figure 3. Les
peptides de la composition selon l'invention sortent de la colonne avec un
temps
de rétention compris entre 16 min et 36 min correspondants à un pourcentage
d'acétonitrile compris entre 12 % et 38 % dans l'éluant. Le temps de rétention
médian des peptides de la composition selon l'invention est de 26 min
correspondant à un pourcentage d'acétonitrile de 25 % dans l'éluant.
Effets biologiques d'une composition selon l'invention
Effet sur la colonisation par Candida albicans et sur la
candidose digestive
On analyse l'effet d'une composition selon l'invention sur
la candidose digestive induite chez des souris femelles C57BL/6, âgées de 8
semaines et d'un poids compris entre 20-25g. On nourrit ces souris pendant une
durée de 21 jours avec la composition selon l'invention à raison de 4
g/Kg/jour.
Au 21ème jour, on induit la candidose digestive par gavage de chaque souris
avec
une quantité de 5.107 cellules de levure. Entre 2 jours (J2) et 7 jours (J7)
après
CA 03039276 2019-04-03
WO 2018/078276 31 PCT/FR2017/052932
induction, on collecte les selles des souris et on évalue la charge en levure
(CFU/mg de selles) sur un milieu chromogène. Les résultats sont donnés au
tableau 4 ci-après en comparaison avec les valeurs mesurées sur des souris
dont
une candidose digestive est induite mais qui ne sont pas traitées avec la
composition selon l'invention.
Jour après induction Composition selon l'invention CFU/mg selle
J3 Oui 125
J3 Non 263
J4 Oui 125
J4 Non 275
J5 Oui 150
J5 Non 250
Tableau 4
La composition selon l'invention induit une diminution de
la charge de Candida albicans.
Composition de peptides selon
l'invention
antiinflammatoire
On réalise une analyse comparative de la stimulation de
l'expression des récepteurs des macrophages de type 1 (M1) inflammatoires
et/ou des récepteurs des macrophages de type 2 (M2) antiinflammatoires par une
composition de peptides selon l'invention issus d'une hydrolyse enzymatique de
collagène de peaux de poissons d'eaux tempérées et par une composition de
peptides issus d'une hydrolyse enzymatique de collagène de peaux de poissons
d'eaux froides (hors invention).
Des macrophages/monocytes de sujets humains sains sont
cultivés pendant 24 heures en présence d'une composition de prétraitement
(contrôle sans peptides de collagène, Invention, Hors invention, tableau 7) à
une
concentration de 100pig/mL de milieu de culture. On évalue l'effet de ce
prétraitement sur l'expression des récepteurs caractéristiques des macrophages
de
type 1 (M1, inflammatoires) et sur l'expression des récepteurs
caractéristiques
des macrophages de type 2 (M2, antiinflammatoires) par le niveau de production
CA 03039276 2019-04-03
WO 2018/078276 32
PCT/FR2017/052932
de radicaux libres de l'oxygène ( Reactive Oxygen Species, ROS ) par les
récepteurs des macrophages de type 1 spécifiquement stimulés par un ester de
phorbol ( 12-myristate-13-acetate-phorbol, TPA ) à une concentration de 100
ILIM ou par les récepteurs des macrophages de type 2 spécifiquement stimulés
par
le Zymosan non opsonisé (ZNO) à une concentration de 100 pig/mL. On mesure
le niveau de production de radicaux libres de l'oxygène par chimioluminescence
en présence de luminol à une concentration de 66 M. Les résultats présentés
au
tableau 7 ci-après représentent les valeurs moyennes obtenues avec trois
essais.
Luminescence, unités arbitraires x 10-8
Prétraitement ¨> Sans collagène Invention Hors
invention
Non induit 1,23 +/- 0,16 1,64 +/- 0,10 1,80
+/- 0,18
=
I)
ZNO 4,49 +/- 0,43 5,06 +/- 0,02 3,91
+/- 0,38
=
-ri
TPA 9,96 +/- 0,40 6,75 +/- 0,11 1,4 +/- 0,59
Tableau 7
On observe que les macrophages/monocytes non traités
(non induits) par ZNO et TPA présentent un niveau de production de radicaux
libres de l'oxygène sensiblement constant selon la nature du prétraitement
(sans
collagène, selon l'invention et hors invention).
Les macrophages/monocytes prétraités par une composition
de peptides selon l'invention, c'est-à-dire issus d'une hydrolyse enzymatique
de
collagène de peaux de poissons d'eaux tempérées, présentent une expression
augmentée des récepteurs de macrophages de type 2 (M2) antiinflammatoires
révélée par l'intensité de chimioluminescence (5,06 108 u.a.) induite par ZNO,
par rapport aux macrophages/monocytes prétraités par une composition de
peptides hors invention, c'est-à-dire issus d'une hydrolyse enzymatique de
collagène de peaux de poissons d'eaux froides (3,91 108 u.a.).
Les macrophages/monocytes prétraités par une composition
de peptides selon l'invention, c'est-à-dire issus d'une hydrolyse enzymatique
de
collagène de peaux de poissons d'eaux tempérées, présentent une expression
diminuée des récepteurs de macrophages de type 1 (M1) inflammatoires révélée
par l'intensité de chimioluminescence (6,75 108 u.a.) induite par TPA, par
CA 03039276 2019-04-03
WO 2018/078276 33 PCT/FR2017/052932
rapport aux macrophages/monocytes prétraités par une composition de peptides
hors invention, c'est-à-dire issus d'une hydrolyse enzymatique de collagène de
peaux de poissons d'eaux froides (1,40 109 u.a.).
La composition de peptides selon l'invention présente un
phénotype antiinflammatoire par rapport à une composition de peptides hors
invention, c'est-à-dire issus d'une hydrolyse enzymatique de collagène de
peaux
de poissons d'eaux froides par augmentation du niveau d'expression des
récepteurs des macrophages de type 2 (M2) antiinflammatoires et par diminution
du niveau d'expression des récepteurs des macrophages de type 1 (M1)
inflammatoires.
La préparation d'une composition de peptides selon
l'invention issus de peaux de poissons d'eaux tempérées et présentant un
aminogramme dans lequel :
- la glycine est en quantité molaire telle que le rapport de cette quantité
sur
la somme des quantités molaires des acides aminés dans la composition est
compris entre 20,0 % et 24,5 % ;
- l'hydroxyproline est en quantité molaire telle que le rapport de cette
quantité sur la somme des quantités molaires des acides aminés dans la
composition est compris entre 6,0 % et 12,0 % ;
- la proline est en quantité molaire telle que le rapport de cette quantité
sur
la somme des quantités molaires des acides aminés dans la composition est
compris entre 10,6 % et 14,6 % ;
présente un tel phénotype antiinflammatoire confirmé par les essais
d'inflammation colique sur un modèle murin et non retrouvé avec une
composition de peptides issus de peaux de poissons d'eaux froides et
présentant
un aminogramme tel que décrit au tableau 6.
Inflammation colique sur un modèle murin
L'effet anti-inflammatoire de la composition de peptides
selon l'invention est démontré sur un modèle murin d'inflammation
pharmacologique induit par le dextran sulfate de sodium (DSS, MP Biomedical
LLC, Canada) caractérisée par une perte de poids et des diarrhées sanglantes.
CA 03039276 2019-04-03
WO 2018/078276 34 PCT/FR2017/052932
On étudie l'effet de la composition de peptides selon
l'invention pour limiter la perte de poids de souris traitées au DSS. On
traite
pendant 7 jours (J1 à J7) des souris de laboratoire C57BL/6 femelles âgées de
10 à
11 semaines et de masse comprise entre 20 et 25 grammes, avec du DSS dissout
à raison de 1,5% (poids/volume) dans l'eau de boisson des souris. On traite
également pendant 12 jours (J1 à J12) ces souris avec la composition selon
l'invention à raison de 0,1 g/Kg/jour; 1 g/Kg/jour et 4 g/Kg/jour. On délivre
cette quantité de composition selon l'invention dans l'eau de boisson des
souris.
A .112, les souris sont euthanasiées.
On prépare 5 lots de souris, chaque lot comprenant 10
souris, dont :
- le lot 1 est traité par le DSS pendant 7 jours ;
- le lot 2 est traité par le DSS pendant 7 jours et avec la composition
selon
l'invention à raison de 0,1 g/Kg/jour pendant 12 jours ;
- le lot 3 est traité par le DSS pendant 7 jours et avec la composition selon
l'invention à raison de 1 g/Kg/jour pendant 12 jours ;
- le lot 4 est traité par le DSS pendant 7 jours et avec la composition
selon
l'invention à raison de 4 g/Kg/jour pendant 12 jours ;
- le lot 5 est traité par le DSS pendant 7 jours et avec de la caséine
hydrolysée non conforme à l'invention à raison de 0,1 g/Kg/jour pendant 12
jours.
On réalise en parallèle un contrôle sur 5 souris qui ne sont
pas traitées par le DSS et pour lesquelles l'inflammation n'est pas induite,
et qui
ne sont pas traitées avec une composition de peptide selon l'invention.
1. Étude du poids corporel
On mesure chaque jour le poids de chaque souris et on
calcule la perte de poids subie par chaque souris de chaque lot. Les résultats
sont
présentés en figure 4, dans laquelle le contrôle est représenté par des
cercles
ouverts (0), le lot 1 est représenté par des cercles pleins (0), le lot 2 est
représenté par des carrés ouverts (El), le lot 3 est représenté par des carrés
pleins
(M), le lot 4 est représenté par des triangles ouverts (A) et le lot 5 est
représenté
CA 03039276 2019-04-03
WO 2018/078276 35 PCT/FR2017/052932
par des triangles pleins ( A ). On observe que dès 0,1g/Kg/jour (lot 2, El),
la
composition selon l'invention limite la perte de poids des souris. Cette
limitation
est également observée pour 1 g/Kg/jour (lot 3, a) et pour 4 g/Kg/jour (lot 4,
A).
Elle n'est pas observée pour le traitement avec la caséine hydrolysée (lot 5,
A)
pour lequel la perte de poids est comparable à la perte de poids des souris du
lot 1
(0).
La composition selon l'invention permet de limiter, voire
d'annuler quasiment intégralement, la perte de poids engendrée par
l'inflammation induite par le dextran sulfate de sodium (DSS) chez la souris.
La
composition selon l'invention est susceptible de pouvoir être utilisée à titre
de
médicament, notamment pour le traitement de l'inflammation colique.
2. Histologie
Les coupes histologiques transversales de colon de souris
traitées par le DSS seul présentent après coloration bichromatique par
l'hématoxyline et l'éosine d'importantes infiltrations de cellules
inflammatoires
au niveau de la muqueuse et de la sous muqueuse. L'épaisseur de l'épithélium
est
réduite. L'épithélium présente des ulcérations étendues. Les coupes
histologiques
transversales de colon de souris traitées par le DSS et par la composition
selon
l'invention à raison de 0,1 g/Kg/jour, 1 g/Kg/jour et 4 g/Kg/jour présentent
après
coloration bichromatique par l'hématoxyline et l'éosine des glandes tubulaires
serrées et rectilignes représentatives d'un épithélium sain et fonctionnel.
3. Score macroscopique
On calcule pour chaque condition de traitement un score
macroscopique à partir de notations établies selon l'échelle de Wallace
relatives à
l'aspect des selles, à l'aspect endommagé du colon, au poids du colon et à la
longueur du colon, selon l'échelle de Wallace (E. S. Kimball, N. H. Wallace,
C.
R. Scnneider, M. R. D'Andrea et P. J. Hornby; 2004 ; Neurogastroenterol Motil
;
16, 811-818. Vanilloid receptor 1 antagonists attenuate disease severity in
dextran sulphate sodium-induced colitis in mice). La valeur du score
macroscopique est d'autant plus élevée que le colon est inflammatoire et est
d'autant plus faible que le colon est sain.
CA 03039276 2019-04-03
WO 2018/078276 36 PCT/FR2017/052932
Les valeurs moyennes et l'écart-type du score
macroscopique des souris des lots 1 à 5 sont données au tableau 5 ci-après.
Score macroscopique moyen Écart-type
Lot 1 5,14 0,46
Lot 2 (0,1 g/Kg/jour) 1,30 0,33 p<0,01
Lot 3 (1 g/Kg/jour) 1,90 0,5 p<0,01
Lot 4 (4 g/Kg/jour) 3,00 0,33 p<0,01
Lot 5 5,00 0,61
Tableau 5
Il est observé une diminution du score macroscopique
induit par le traitement avec la composition selon l'invention, c'est-à-dire
une
amélioration de l'état inflammatoire du colon induite par la composition selon
l'invention.
4. Inhibition de l'expression de marqueurs pro-
inflammatoires chez la souris
A .112, on euthanasie les souris et on dose le niveau
d'expression au niveau du colon de cytokines pro-inflammatoires par la
technique d'ELISA :
- IL-113 : Le taux d'IL-113 est analysé par la technique ELISA et
exprimé en picogramme (pg) d'IL-113 par milligramme (mg) de colon. Les
résultats sont représentés en figure 5 dans laquelle la première colonne
(colonne
blanche) correspond à l'analyse effectuée sur les souris du contrôle. La
deuxième
colonne (colonne à hachures obliques) correspond à l'analyse effectuée sur les
souris du lot 1. La troisième colonne (colonne à hachures verticales)
correspond à
l'analyse effectuée sur les souris du lot 4. La quatrième colonne (colonne à
hachures horizontales) correspond à l'analyse effectuée sur les souris du lot
3. La
cinquième colonne (colonne grisée) correspond à l'analyse effectuée sur les
souris du lot 2. La sixième colonne (colonne pleine noire) correspond à
l'analyse
effectuée sur les souris du lot S. On observe une diminution statistiquement
significative (p<0,05) de l'expression d' IL 113 dans le colon de souris
traitées
avec la composition de peptides selon l'invention pour des doses de
CA 03039276 2019-04-03
WO 2018/078276 37 PCT/FR2017/052932
0,1g/Kg/jour, lg/Kg/jour et 4g/Kg/jour par rapport au colon de souris dont
l'inflammation est induite par le DSS et par rapport aux souris dont
l'inflammation est induite par le DSS et traitée avec la caséine hydrolysée.
Cet
effet a été confirmé par analyse des ARN messagers de IL-1(3 par RT-PCR
quantitative en particulier (p<0,01) pour les doses de 0,1g/Kg/jour et
lg/Kg/jour ;
- IL6 : Le taux d'IL6 est analysé par la technique ELISA et exprimé en
picogramme (pg) d'IL6 par milligramme (mg) de colon. Les résultats sont
représentés en figure 6 dans laquelle la première colonne (colonne blanche)
correspond à l'analyse effectuée sur les souris du contrôle. La deuxième
colonne
(colonne à hachures obliques) correspond à l'analyse effectuée sur les souris
du
lot 1. La troisième colonne (colonne à hachures verticales) correspond à
l'analyse
effectuée sur les souris du lot 4. La quatrième colonne (colonne à hachures
horizontales) correspond à l'analyse effectuée sur les souris du lot 3. La
cinquième colonne (colonne grisée) correspond à l'analyse effectuée sur les
souris du lot 2. La sixième colonne (colonne pleine noire) correspond à
l'analyse
effectuée sur les souris du lot 5. On observe une diminution statistiquement
significative de l'expression d'IL6 dans le colon de souris traitées avec la
composition de peptides selon l'invention pour des doses de 0,1g/Kg/jour
(p<0,01), lg/Kg/jour (p<0,01) et 4g/Kg/jour (p<0,05) par rapport au colon de
souris dont l'inflammation est induite par le DSS et par rapport aux souris
dont
l'inflammation est induite par le DSS et traitée avec la caséine hydrolysée.
Cet
effet a été confirmé par analyse des ARN messagers de IL6 par RT-PCR
quantitative ;
- TNF-oc : Le taux de TNF-oc est analysé par la technique ELISA et
exprimé en picogramme (pg) de TNF-oc par milligramme (mg) de colon. Les
résultats sont représentés en figure 7 dans laquelle la première colonne
(colonne
blanche) correspond à l'analyse effectuée sur les souris du contrôle. La
deuxième
colonne (colonne à hachures obliques) correspond à l'analyse effectuée sur les
souris du lot 1. La troisième colonne (colonne à hachures verticales)
correspond à
l'analyse effectuée sur les souris du lot 4. La quatrième colonne (colonne à
hachures horizontales) correspond à l'analyse effectuée sur les souris du lot
3. La
CA 03039276 2019-04-03
WO 2018/078276 38 PCT/FR2017/052932
cinquième colonne (colonne grisée) correspond à l'analyse effectuée sur les
souris du lot 2. La sixième colonne (colonne pleine noire) correspond à
l'analyse
effectuée sur les souris du lot 5. On observe une diminution statistiquement
significative de l'expression du TNF-oc dans le colon de souris traitées avec
la
composition de peptides selon l'invention pour des doses de 0,1g/Kg/jour
(p<0,05), lg/Kg/jour (p<0,05) et 4g/Kg/jour (p<0,05) par rapport au colon de
souris dont l'inflammation est induite par le DSS et par rapport aux souris
dont
l'inflammation est induite par le DSS et traitée avec la caséine hydrolysée.
L'analyse par RT-PCR ( Reverse Transcriptase
Polymerase Chain Reaction ) quantitative des ARN messagers de
MCP1 montre une diminution statistiquement significative de ces ARNm induits
par le DSS, en particulier pour les doses de 0,1 g/Kg/jour (p<0,01) et 1
g/Kg/jour
(p<0,05) de composition de peptides selon l'invention.
L'analyse par RT-PCR ( Reverse Transcriptase
Polymerase Chain Reaction ) quantitative des ARN messagers de la NO-
synthase inductible (iNOS) est représentée en figure 17 dans laquelle la
première
colonne (colonne blanche) correspond à l'analyse effectuée sur les souris du
contrôle. La deuxième colonne (colonne à hachures obliques) correspond à
l'analyse effectuée sur les souris du lot 1. La troisième colonne (colonne à
hachures verticales) correspond à l'analyse effectuée sur les souris du lot 4.
La
quatrième colonne (colonne à hachures horizontales) correspond à l'analyse
effectuée sur les souris du lot 3. La cinquième colonne (colonne grisée)
correspond à l'analyse effectuée sur les souris du lot 2. La sixième colonne
(colonne pleine noire) correspond à l'analyse effectuée sur les souris du lot
5. Il a
été observé une diminution statistiquement significative des ARNm de iNOS
induits par le DSS pour les doses de 0,1 g/Kg/jour (p<0,05) et 1 g/Kg/jour
(p<0,05) de la composition de peptides selon l'invention.
5. Stimulation de l'expression de marqueurs anti-
inflammatoires chez la souris
A .112, on euthanasie les souris et on analyse le niveau
d'expression au niveau du colon de marqueurs anti-inflammatoires :
CA 03039276 2019-04-03
WO 2018/078276 39 PCT/FR2017/052932
- TGF-P. Le taux de TGF13 est analysé par la technique ELISA et
exprimé en picogramme (pg) de TGF13 par milligramme (mg) de colon. Les
résultats sont représentés en figure 8 dans laquelle la première colonne
(colonne
blanche) correspond à l'analyse effectuée sur les souris du contrôle. La
deuxième
colonne (colonne à hachures obliques) correspond à l'analyse effectuée sur les
souris du lot 1. La troisième colonne (colonne à hachures verticales)
correspond à
l'analyse effectuée sur les souris du lot 4. La quatrième colonne (colonne à
hachures horizontales) correspond à l'analyse effectuée sur les souris du lot
3. La
cinquième colonne (colonne grisée) correspond à l'analyse effectuée sur les
souris du lot 2. La sixième colonne (colonne pleine noire) correspond à
l'analyse
effectuée sur les souris du lot 5. On observe une stimulation de l'expression
du
TGF-(3 dans le colon de souris traitées avec la composition de peptides selon
l'invention pour la dose de 0,1g/Kg/jour par rapport au colon de souris dont
l'inflammation est induite par le DSS. Cet effet a été confirmé par analyse
des
ARN messagers de TGF-(3 par RT-PCR quantitative, en particulier pour les doses
de 0,1 g/Kg/jour et 1 g/Kg/jour de composition de peptides selon l'invention
(figure 16) ;
-
Fizz 1 : Fizz 1 est un marqueur des macrophages M2 anti-
inflammatoires. L'analyse par RT-PCR ( Reverse Transcriptase Polymerase
Chain Reaction ) quantitative des ARN messagers de Fizz 1 est représentée en
figure 18 dans laquelle la première colonne (colonne blanche) correspond à
l'analyse effectuée sur les souris du contrôle. La deuxième colonne (colonne à
hachures obliques) correspond à l'analyse effectuée sur les souris du lot 1.
La
troisième colonne (colonne à hachures verticales) correspond à l'analyse
effectuée sur les souris du lot 4. La quatrième colonne (colonne à hachures
horizontales) correspond à l'analyse effectuée sur les souris du lot 3. La
cinquième colonne (colonne grisée) correspond à l'analyse effectuée sur les
souris du lot 2. La sixième colonne (colonne pleine noire) correspond à
l'analyse
effectuée sur les souris du lot 5. Il a été observé une augmentation
statistiquement significative des ARN messagers de Fizz 1 diminués par le DSS,
CA 03039276 2019-04-03
WO 2018/078276 40 PCT/FR2017/052932
pour les doses de 0,1 g/Kg/jour (p<0,05), 1 g/Kg/jour (p<0,01) et 4 g/Kg/jour
(p<0,05) de composition de peptides selon l'invention ;
- il a également été observé une augmentation statistiquement
significative des ARN messagers de Yml diminués par le DSS, pour les doses de
1 g/Kg/jour (p<0,05) de composition de peptides selon l'invention.
6. Effet de la composition de peptides selon l'invention
sur la flore colique ¨ microbiote du colon
A .112, on euthanasie les souris et on quantifie par PCR
( Polymerase Chain Reaction ) la flore colique de ces souris. Les valeurs
sont
normalisées par rapport à la quantité totale de bactéries ou de champignons et
par
rapport à la P¨actine. La J3¨actine constitue le gène de référence permettant
une
normalisation par rapport à la quantité de tissu colique analysé. On quantifie
en
particulier :
- la flore fongique totale par l'amplification quantitative de l'ADN
ribosomique fongique ITS1-2. Le rapport R de la quantité d'ADN ribosomique
fongique ITS1-2 sur la quantité d'ADN de la P¨actine est représenté en figure
9
dans laquelle la première colonne (colonne blanche) correspond au dosage
effectué sur les souris du contrôle. La deuxième colonne (colonne à hachures
obliques) correspond au dosage effectué sur les souris du lot 1. La troisième
colonne (colonne à hachures verticales) correspond au dosage effectué sur les
souris du lot 4. La quatrième colonne (colonne à hachures horizontales)
correspond au dosage effectué sur les souris du lot 3. La cinquième colonne
(colonne grisée) correspond au dosage effectué sur les souris du lot 2. La
sixième
colonne (colonne pleine noire) correspond au dosage effectué sur les souris du
lot
5. La composition de peptides selon l'invention restore la flore fongique en
particulier à la dose de 4g/Kg/jour ;
- la levure Saccharomyces cerevisiae par l'amplification quantitative de
l'ADN ribosomique 26S. Le rapport R de la quantité d'ADN ribosomique 26S
sur la quantité d'ADN de la P¨actine est représenté en figure 10. La première
colonne (colonne blanche) correspond au dosage effectué sur les souris du
contrôle. La deuxième colonne (colonne à hachures obliques) correspond au
CA 03039276 2019-04-03
WO 2018/078276 41 PCT/FR2017/052932
dosage effectué sur les souris du lot 1. La troisième colonne (colonne à
hachures
verticales) correspond au dosage effectué sur les souris du lot 4. La
quatrième
colonne (colonne à hachures horizontales) correspond au dosage effectué sur
les
souris du lot 3. La cinquième colonne (colonne grisée) correspond au dosage
effectué sur les souris du lot 2. La sixième colonne (colonne pleine noire)
correspond au dosage effectué sur les souris du lot 5. La composition de
peptides
selon l'invention restore de façon statistiquement significative la flore
Saccharomyces cerevisiae aux doses de 0,1 g/Kg/jour (p<0,05), lg/Kg/jour
(p<0,05) et 4g/Kg/jour (p<0,05). En l'espèce, S. cerevisiae présente un
potentiel
anti-inflammatoire ;
- la flore d'entérobactéries par l'amplification quantitative de l'ADN
ribosomique 16S. Le rapport R de la quantité d'ADN ribosomique 16S sur la
quantité d'ADN de la P¨actine est représenté en figure 11. La première colonne
(colonne blanche) correspond au dosage effectué sur les souris du contrôle. La
deuxième colonne (colonne à hachures obliques) correspond au dosage effectué
sur les souris du lot 1. La troisième colonne (colonne grisée) correspond au
dosage effectué sur les souris du lot 2. La quatrième colonne (colonne pleine
noire) correspond au dosage effectué sur les souris du lot 5. La composition
de
peptides selon l'invention permet la diminution de la flore d'entérobactéries
induite par le DSS à la concentration de 0,1 g/Kg/jour. Les entérobactéries
sont
associées à un potentiel pro-inflammatoire ;
- la flore de firmicutes par l'amplification quantitative de l'ADN
ribosomique 16S sur un fragment du gène permettant l'analyse de la diversité
dans le phylum. Le rapport R de la quantité d'un tel ADN ribosomique 16S sur
la
quantité d'ADN de la P¨actine est représenté en figure 12. La première colonne
(colonne blanche) correspond au dosage effectué sur les souris du contrôle. La
deuxième colonne (colonne à hachures obliques) correspond au dosage effectué
sur les souris du lot 1. La troisième colonne (colonne à hachures verticales)
correspond au dosage effectué sur les souris du lot 4. La quatrième colonne
(colonne à hachures horizontales) correspond au dosage effectué sur les souris
du
lot 3. La cinquième colonne (colonne grisée) correspond au dosage effectué sur
CA 03039276 2019-04-03
WO 2018/078276 42 PCT/FR2017/052932
les souris du lot 2. La sixième colonne (colonne pleine noire) correspond au
dosage effectué sur les souris du lot 5. La composition de peptides selon
l'invention induit la diminution statistiquement significative de la flore de
firmicutes induite par le DSS aux concentrations de 0,1 g/Kg/jour (p<0,05),
lg/Kg/jour (p<0,05) et 4 g/Kg/jour (p<0,05) mais aussi induit la diminution de
la
flore de firmicutes non induite à ces mêmes concentrations. Il est à noter que
l'augmentation de la flore de firmicutes est généralement observée de façon
connue au cours de l'inflammation digestive ( IBD, Inflammatory Bowel
Diseases );
- la flore de bacteroidetes par l'amplification quantitative de l'ADN
ribosomique 16S sur un fragment du gène permettant l'analyse de la diversité
dans le phylum. Le rapport R de la quantité d'un tel ADN ribosomique 16S sur
la
quantité d'ADN de la P¨actine est représenté en figure 13. La première colonne
(colonne à hachures obliques) correspond au dosage effectué sur les souris du
lot
1. La deuxième colonne (colonne à hachures verticales) correspond au dosage
effectué sur les souris du lot 4. La troisième colonne (colonne à hachures
horizontales) correspond au dosage effectué sur les souris du lot 3. La
quatrième
colonne (colonne grisée) correspond au dosage effectué sur les souris du lot
2. La
cinquième colonne (colonne pleine noire) correspond au dosage effectué sur les
souris du lot 5. La composition de peptides selon l'invention induit la
diminution
statistiquement significative de la flore bacteroidetes induite par le DSS aux
concentrations de 0,1 g/Kg/jour (p<0,05), 1g/Kg/jour (p<0,05) et 4 g/Kg/jour
(p<0,05). L'augmentation des bacteroidetes est généralement observée de façon
connue au cours de l'inflammation digestive ( IBD );
- la flore de Faecalibacterium praustnizii par l'amplification
quantitative d'ADN spécifique. Le rapport R de la quantité d'un tel ADN
spécifique sur la quantité d'ADN de la P¨actine est représenté en figure 14.
La
première colonne (colonne blanche) correspond au dosage effectué sur les
souris
du contrôle. La deuxième colonne (colonne à hachures obliques) correspond au
dosage effectué sur les souris du lot 1. La troisième colonne (colonne à
hachures
verticales) correspond au dosage effectué sur les souris du lot 4. La
quatrième
CA 03039276 2019-04-03
WO 2018/078276 43 PCT/FR2017/052932
colonne (colonne à hachures horizontales) correspond au dosage effectué sur
les
souris du lot 3. La cinquième colonne (colonne grisée) correspond au dosage
effectué sur les souris du lot 2. La sixième colonne (colonne pleine noire)
correspond au dosage effectué sur les souris du lot 5. La composition de
peptides
selon l'invention induit l'augmentation statistiquement significative de la
flore de
Faecalibacterium praustnizii détruite par le DSS à la concentration de 0,1
g/Kg/jour (p<0,01), 1 g/Kg/jour (p<0,01) et 4 g/Kg/jour (p<0,01).
L'augmentation de Faecalibacterium praustnizii est généralement observée de
façon connue au cours de l'inflammation digestive ( IBD ). Faecalibacterium
praustnizii aurait également des propriétés anti-inflammatoires ;
- la flore de Lactobacillus murinus par l'amplification quantitative d'un
ADN spécifique. Le rapport R de la quantité d'un tel ADN spécifique sur la
quantité d'ADN de la P¨actine est représenté en figure 15 dans laquelle la
première colonne (colonne blanche) correspond au dosage effectué sur les
souris
du contrôle. La deuxième colonne (colonne à hachures obliques) correspond au
dosage effectué sur les souris du lot 1. La troisième colonne (colonne à
hachures
verticales) correspond au dosage effectué sur les souris du lot 4. La
quatrième
colonne (colonne à hachures horizontales) correspond au dosage effectué sur
les
souris du lot 3. La cinquième colonne (colonne grisée) correspond au dosage
effectué sur les souris du lot 2. La sixième colonne (colonne pleine noire)
correspond au dosage effectué sur les souris du lot 5. La composition de
peptides
selon l'invention induit l'augmentation de la flore de Lactobacillus murinus
aux
concentrations de 0,1 g/Kg/jour, 1 g/Kg/jour et 4 g/Kg/jour (p<0,05).
Lactobacillus murinus aurait également des propriétés anti-inflammatoires.
7. Effet de la composition de peptides selon l'invention
sur les enzymes du métabolisme lipidique de l'acide arachidonique :
- 5-LOX : L'analyse par RT-PCR ( Reverse Transcriptase Polymerase
Chain Reaction ) quantitative des ARN messagers de l'enzyme 5-lipoxygenase
(5-LOX) est représentée en figure 19 dans laquelle la première colonne
(colonne
blanche) correspond à l'analyse effectuée sur les souris du contrôle. La
deuxième
colonne (colonne à hachures obliques) correspond à l'analyse effectuée sur les
CA 03039276 2019-04-03
WO 2018/078276 44 PCT/FR2017/052932
souris du lot 1. La troisième colonne (colonne à hachures verticales)
correspond à
l'analyse effectuée sur les souris du lot 4. La quatrième colonne (colonne à
hachures horizontales) correspond à l'analyse effectuée sur les souris du lot
3. La
cinquième colonne (colonne grisée) correspond à l'analyse effectuée sur les
souris du lot 2. La sixième colonne (colonne pleine noire) correspond à
l'analyse
effectuée sur les souris du lot 5. Il a été observé une diminution
statistiquement
significative de l'expression de la 5-LOX pour des doses de la composition de
peptides selon l'invention de 0,1 g/Kg/jour (p<0,01) et 1 g/Kg/jour (p<0,01)
par
rapport au contrôle non induit par le DSS. La composition de peptides selon
l'invention présente un effet inhibiteur de l'expression de la 5-LOX
favorisant la
production de médiateurs lipidiques pro-inflammatoires ;
- 12/15-LOX : L'analyse par RT-PCR ( Reverse Transcriptase
Polymerase Chain Reaction ) quantitative des ARN messagers de l'enzyme
12/15-lipoxygenase (12/15-LOX) est représentée en figure 20 dans laquelle la
première colonne (colonne blanche) correspond à l'analyse effectuée sur les
souris du contrôle. La deuxième colonne (colonne à hachures obliques)
correspond à l'analyse effectuée sur les souris du lot 1. La troisième colonne
(colonne à hachures verticales) correspond à l'analyse effectuée sur les
souris du
lot 4. La quatrième colonne (colonne à hachures horizontales) correspond à
l'analyse effectuée sur les souris du lot 3. La cinquième colonne (colonne
grisée)
correspond à l'analyse effectuée sur les souris du lot 2. La sixième colonne
(colonne pleine noire) correspond à l'analyse effectuée sur les souris du lot
5. Il a
été observé une augmentation statistiquement significative de l'expression de
la
12/15-LOX pour des doses de la composition de peptides selon l'invention de
0,1
g/Kg/jour (p<0,01) et 1 g/Kg/jour (p<0,01) par rapport au contrôle induit par
le
DSS.
Il va de soi que l'invention peut faire l'objet de nombreuses
variantes de réalisation et d'applications. En particulier, différentes
utilisations à
titre de médicament peuvent varier sans sortir de la portée de protection de
l'invention.