Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
SYSTEME FLUIDIQUE DE PRODUCTION DE VÉSICULES
EXTRACELLULAIRES ET PROCÉDÉ ASSOCIÉ
DOMAINE DE L'INVENTION
L'invention concerne de manière générale la production de vésicules
extracellulaires.
L'invention se rapporte plus précisément à un système de production de
vésicules
extracellulaires à partir de cellules productrices en suspension, un procédé
de production
et de récupération de telles vésicules et des vésicules produites par un tel
système, les
vésicules extracellulaires peuvent par exemple être d'intérêt comme vecteurs
d'agent
thérapeutiques et/ou d'imagerie, comme alternative à la thérapie cellulaire et
dans la
médecine régénérative.
ÉTAT DE LA TECHNIQUE
Les cellules sont connues pour libérer des vésicules extracellulaires dans
leur
environnement, par exemple, in vivo, dans les fluides biologiques d'un
organisme. Les
vésicules extracellulaires ont été identifiées comme des moyens efficaces pour
délivrer
des médicaments, de manière personnalisée ou ciblée, dans le corps humain.
Elles
présentent d'abord une biocompatibilité native et une tolérance immunitaire.
Elles
peuvent également intemaliser des nanoparticules théranostiques, permettant à
la fois
d'imager certaines parties du corps et de délivrer des principes actifs ayant
des fonctions
thérapeutiques. Les vésicules extracellulaires ont également une fonction de
communication intercellulaire : elles permettent, par exemple, de transporter
des lipides,
des protéines membranaires et cytoplasmiques et/ou des nucléotides du
cytoplasm.e
cellulaire, tels que des ARNm, des microARN ou des ARN longs non-codants,
entre
.. différentes cellules.
En particulier, l'utilisation de vésicules extracellulaires peut permettre de
résoudre des
problèmes connus lors de l'utilisation thérapeutique de cellules, tels que la
réplication
cellulaire, la différentiation, les occlusions vasculaires, les risques de
rejet et les
difficultés de stockage et congélation. Il existe en conséquent un besoin
industriel pour la
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
2
production de vésicules cellulaires en quantités suffisantes pour une
utilisation
thérapeutique, notamment en remplacement ou en complément de thérapies
cellulaires.
A cet effet, Piffoux et al. (Piffoux, M., Silva, A. K., Lugagne, J. B.,
Hersen, P., Wilhelm,
C., & Gazeau, F., 2017, Extracellular Vesicle Production Loaded with
Nanoparticles and
Drugs in a Trade-off between Loading, Yield and Purity: Towards a Personalized
Drug
Deliver), System, Advanced Biosystems) décrivent la comparaison de différentes
méthodes de production de vésicules extracellulaires.
Une première méthode consiste à produire des vésicules extracellulaires à
partir de
cellules endothéliales de la veine du cordon ombilical (HUVEC), en soumettant
ces
cellules à des contraintes hydrodynamiques mimant les contraintes exercées
dans des
conditions physiologiques au sein des capillaires sanguins ou dans des
conditions
pathologiques lors de sténose des vaisseaux sanguins. Ces contraintes sont
entraînées par
le passage des cellules productrices dans des canaux microfluidiques. Une puce
microfluidique comprend deux cents canaux dans lesquels les cellules sont
transportées
dans un écoulement laminaire, pour produire des vésicules de manière
parallélisée.
Toutefois, cette méthode présente des problèmes de dimensionnement : les
quantités de
vésicules produites par une puce microfluidique ne sont pas adaptées aux
quantités
requises pour les applications susmentionnées. De plus, le rendem.ent de
vésicules
extracellulaires produites par cellule introduite dans une telle puce (environ
2.104
vésicules par cellule) est très inférieur au rendement théorique maximum de
vésicules
produites par une cellule, par exemple de l'ordre de 3,5.106 vésicules par
cellule pour une
cellule de type MSC (acronyme de cellule souche m.ésench.ym.ateuse en
anglais). Enfin,
cette méthode nécessite une conformité aux normes dite G.M.P. (acronyme
anglais de
Bonnes Pratiques de Fabrication), nécessaires à la fabrication de médicaments.
Une deuxième méthode couramment utilisée dans la littérature et décrite par
Piffoux et
al. consiste à cultiver des HUVEC dans un milieu de culture de type DMEM
(acronyme
anglais de Dulbecco 's Modeied Eagle's Medium) sans sérum, pendant trois jours
(technique dite de starvation en anglais, ou carence en sérum). L'absence de
sérum
entraîne un stress cellulaire déclenchant une libération de vésicules par les
cellules
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
3
productrices. Cette méthode présente un. rendement plus élevé et permet de
produire une
plus grande quantité de vésicules que la méthode utilisant une puce
microfluidique
(environ 4.104 vésicules par cellule productrice). Toutefois, le rendement
calculé
correspond à une durée de production beaucoup plus longue que la durée de
production
de la méthode précédente. Cette méthode ne permet pas de produire une quantité
de
vésicules extracellulaires suffisante pour les applications susmentionnées.
Enfin, cette
méthode ne permet pas de produire des vésicules de manière continue car elle
induit la
mort des cellules.
Watson et al. (Watson, D. C., Bayik, D., Srivatsan, A., Bergamaschi, C.,
Valentin, A.,
Niu, G., ... & Jones, J. C., 2016, efficient production and enhanced tumor
delivety of
engineered extracellular vesicles, Biomaterials, 105, 195-205) décrivent une
méthode de
production des vésicules permettant d'augmenter la quantité de vésicules
produites. Cette
méthode consiste à cultiver des cellules adhérentes de type FIEK293 dans des
flasques de
culture, puis dans des membranes à fibres creuses (Hollow Fiber Membrane en
anglais).
Le passage central des fibres creuses permet d'acheminer le milieu de culture
aux cellules
productrices. Les cellules productrices sont au préalable ensemencées autour
de ce
passage, où elles produisent des vésicules dans un espace inter-fibre. Le
milieu liquide
compris dans l'espace inter-fibre est collecté trois fois par semaine,
permettant de
produire environ 3.10' vésicules en plusieurs semaines, pour des quantités de
cellules
ensemencées très grandes, par exemple de l'ordre de 5.108 cellules, entraînant
un
rendement d'environ 6000 vésicules extracellulaires par cellule et un ratio de
pureté très
bas (par exem.ple 1,09.1e particules par m.icrogramme de protéines). Cette
production
n'est toutefois pas assez élevée et trop lente au regard des applications
susmentionnées.
De plus, cette méthode est décrite en util.isant des cellules productrices
correspondant à
une lignée cellulaire particulièrement résistante à la culture en milieu
dépourvu en sérum
: cette méthode peut ne pas être transposable à une production de vésicul.es
par des cellul.es
productrices telles que des cellules souches, par exemple humaines, moins
résistantes et
particulièrement appropriées aux applications thérapeutiques visées.
Il est également bien connu de l'homme du métier que la culture de cellules en
suspension
en 3 dimensions (3D) nécessite d'utiliser une méthode à faible agitation afin
de ne pas
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
4
induire la mort des cellules qu'on cherche à cultiver. 11 est notamment connu
de 1 'homm.e
du métier que la longueur de Kolmogorov est un critère qui permet d'évaluer la
turbulence
créée par l'action de mélange et de déterminer quand la turbulence est
excessive pour une
culture 3D.
RÉSUMÉ DE L'INVENTION
De façon surprenante et inattendue et contrairement aux idées communément
acceptées
dans le domaine de la culture de cellules à 3D, les inventeurs ont découvert
que la
génération d'un écoulement turbulent dans le milieu de culture permet
d'obtenir une
production rapide de vésicules en grande quantité et d'obtenir leur
chargement.
Ainsi, un but de l'invention est de proposer une solution pour produire
rapidement des
vésicules extracellulaires en grande quantité à partir de cellules
productrices, plus
rapidement qu'avec les méthodes connues, dans des conditions conformes ou
pouvant
être rendues conformes aux normes G.M.P. Un autre but de l'invention est de
proposer
une solution permettant d'augmenter le rendement du système de production de
vésicules,
c'est-à-dire le rapport entre le nombre de vésicules produites et le nombre de
cellules
productrices introduites dans le système de production. Un autre but de
l'invention est de
proposer un système adapté à produire des vésicules extracellulaires à partir
d'une large
gamme de cellules productrices en suspension, quelle que soit la résistance du
type de
cellule introduite dans le systèm.e de production et résistante ou non à une
carence en
sérum. Selon un autre aspect de l'invention, les cellules productrices en
suspension sont
d'origine humaine, animale, végétale ou provenant des bactéries ou d'autres
micro-
organismes. Un autre but de l'invention est de proposer une solution pour
produire et
récupérer des vésicules extracellulaires en. continu ou en discontinu. Enfin,
un autre but
de l'invention est de simplifier la structure du système fluidique pour la
production de
vésicules et de réduire son coût de fabrication. Un des buts de l'invention
est encore
l'utilisation des vésicules produites par le système fluidique selon
l'invention, et/ou
obtenues grâce au procédé de production ex vivo de vésicules extracellulaires
à partir de
cellules productrices en suspension selon l'invention. Alternativement, un
autre but de
l'invention est de proposer une solution pour charger les vésicules
extracellulaires
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
produites par le système fluidique d'au moins un agent thérapeutique et/ou
agent
d'imagerie. Un des buts de l'invention est encore l'utilisation des vésicules
extracellulaires chargées avec au moins un agent thérapeutique et/ou agent
d'imagerie
obtenues grâce au procédé de chargement d'au moins un agent thérapeutique
et/ou
5 .. d'imagerie à l'intérieur ou à la membrane de vésicules extracellulaires à
partir de cellules
productrices selon l'invention.
En particulier, un objet de l'invention est un système fluidique de production
de vésicules
extracellulaires (EV) à partir de cellules productrices en suspension,
comprenant au moins
un récipient, un milieu liquide contenu par le récipient, des cellules
productrices en
suspension, un agitateur de milieu liquide, des moyens de commande de la
vitesse de
l'agitateur adaptés pour la croissance des cellules productrices en
suspension, caractérisé
en ce qu'il comprend également des moyens de commande de la vitesse de
l'agitateur et
un agitateur dont la forme et les dimensions du récipient sont adaptés à la
génération d'un
écoulement turbulent du milieu liquide dans le récipient pour exercer des
contraintes de
.. cisaillement sur les cellules productrices afin de réaliser la production
de vésicules
extracellulaires (EV), la longueur de Kolmogorov de l'écoulement étant
inférieure ou
égale à 50 lm, préférentiellement inférieure ou égale à 40 gm ; plus
préférentiellement
inférieure ou égale à 35 m. Selon un mode de réalisation, la longueur de
Kolmogorov
est de 5 à 50 gm, préférentiellement de 5 à 41 p,m, plus préférentiellement de
5 à 35 lm,
encore plus préférentiellement de 10 à 35 gm.
Autrement exprimé, un objet de l'invention est un systèm.e fluidique de
production de
vésicules extracellulaires (EV) à partir de cellules productrices en
suspension,
comprenant au moins un récipient, un milieu liquide contenu par le récipient,
des cellules
productrices en suspension, un agitateur de milieu liquide, des moyens de
commande de
.. la vitesse de l'agitateur adaptés pour la croissance des cellules
productrices en suspension,
caractérisé en ce que les moyens de commande de la vitesse de l'agitateur,
l'agitateur et
la forme et les dimensions du récipient sont adaptés à la génération d'un
écoulement
turbulent du milieu liquide dans le récipient pour exercer des contraintes de
cisaillement
sur les cellules productrices afin de réaliser la production de vésicules
extracellulaires
.. (EV), la longueur de Kolmogorov de l'écoulement étant inférieure ou égale à
50 pm,
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
6
préférentiellement inférieure ou égale à 40 itm ; plus préférentiellement
inférieure ou
égale à 35 m. Selon un mode de réalisation, la longueur de Kolmogorov est de
5 à 50 gm,
préférentiellement de 5 à 41 p.m, préférentiellement de 10 à 41 i.im, plus
préférentiellement de 5 à 35 m, encore plus préférentiellement de 10 à 35 m.
Selon un mode de réalisation, les cellules productrices utilisées dans le
cadre de la
présente invention sont des cellules humaines, préférentiellement des cellules
humaines
saines.
Alternativement, les cellules productrices utilisées dans le cadre de la
présente invention
sont des cellules pathologiques, par exemple des cellules cancéreuses telles
que des
cellules HeLa.
Selon un mode de réalisation, les cellules productrices utilisées dans le
cadre de la
présente invention sont des cellules animales, de préférence des cellules
murines, par
exemple des cellules MSC murines (cellules souches mésenchymateuses murines).
Selon une caractéristique préférée, les cellules productrices utilisées dans
le cadre de la
présente invention sont des cellules non-adhérentes.
Selon une autre caractéristique préférée, les cellules productrices utilisées
dans le cadre
de la présente invention sont des cellules adhérentes détachées de leur
support de culture,
par exemple par traitement approprié, par exemple enzymatique, par exemple
chimique
ou par exemple mécanique ou une combinaison de ces moyens.
Selon un mode de réalisation, les cellules productrices utilisées dans le
cadre de la
présente invention sont des cellules souches notamment des cellules souches
pluripotentes induites, des cellules multipotentes par exemple des cellules
mésenchymateuses multipotentes, des cellules génétiquement modifiées ou des
cellules
endothéliales de la veine du cordon ombilical (HUVEC).
Selon un mode de réalisation, les cellules productrices utilisées dans le
cadre de la
présente invention sont des cellules souches notamment des cellules souches
pluripotentes induites, des cellules multipotentes par exemple des cellules
mésenchymateuses multipotentes, des cellules génétiquement modifiées ou des
cellules
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
7
endothéliales de la veine du cordon ombilical (HUVEC) ou des cellules
primaires en
général.
Selon un autre mode de réalisation, les cellules productrices utilisées dans
le cadre de la
présente invention sont des cellules de lignée cellulaire, préférentiellement
de lignée
humaine de monocytes ou de lignée humaine de cellules d'origine
hématopoïétique
dérivées de lymphocytes B, plus préférentiellement il s'agit de cellules THP-1
ou de
cellules de Raji.
Selon un autre mode de réalisation, les cellules productrices utilisées dans
le cadre de la
présente invention sont des cellules primaires, par exemple des globules
rouges.
Selon une caractéristique préférée, les cellules productrices utilisées dans
le cadre de la
présente invention sont des cellules provenant du sujet pour lequel les
vésicules
extracellulaires produites par lesdites cellules productrices seront
utilisées, par exemple
par administration ou par utilisation ex vivo.
Selon une autre caractéristique préférée, les cellules productrices utilisées
dans le cadre
de la présente invention sont des cellules ne provenant pas du sujet pour
lequel les
vésicules extracellulaires produites par lesdites cellules productrices seront
utilisées, par
exemple par administration ou par utilisation ex vivo. Selon une
caractéristique plus
préférée, les cellules productrices utilisées dans le cadre de la présente
invention sont des
cellules provenant de la même espèce que l'espèce du sujet pour lequel les
vésicules
extracellulaires produites par lesdites cellules productrices seront
utilisées.
Alternativement, les cellules productrices utilisées dans le cadre de la
présente invention
sont des cellules provenant d'une espèce différente de l'espèce du sujet pour
lequel les
vésicules extracellulaires produites par lesdites cellules productrices seront
utilisées.
Selon une caractéristique préférée, la concentration des cellules productrices
dans le
milieu liquide du récipient du système fluidique est comprise entre 50 000 et
500 000 000
cellules productrices par litre de milieu liquide, de préférence entre 50 000
000 et
500 000 000 cellules productrices par litre, préférentiellement entre 50 000
000 et
300 000 000 par litre, plus préférentiellement entre 200 000 000 et 300 000
000 par litre,
encore plus préférentiellement environ 250 000 000 par litre dudit milieu
liquide. Selon
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
8
une autre caractéristique préférée, la concentration des cellules productrices
dans le
milieu liquide du récipient du système fluidique est comprise entre 100 000 et
250 000 000 cellules productrices par litre de milieu liquide.
Selon une caractéristique préférée, la concentration des cellules productrices
dans le
milieu liquide du récipient du système fluidique est comprise entre 50 000 et
900 000 000 000 000 cellules productrices par litre de milieu liquide, de
préférence entre
50 000 000 et 100 000 000 000 000 cellules productrices par litre,
préférentiellement
entre 50 000 000 et 10 000 000 000 000 par litre, encore plus
préférentiellement entre
200 000 000 et 1 000 000 000 000 par litre. Selon une autre caractéristique
préférée, la
concentration des cellules productrices dans le milieu liquide du récipient du
système
fluidique est comprise entre 100 000 000 et 1 000 000 000 000 cellules
productrices par
litre de milieu liquide.
En particulier, un objet de l'invention est constitué par les vésicules
produites par le
système fluidique selon l'invention.
En particulier, un objet de l'invention est l'utilisation des vésicules
produites par le
système fluidique selon l'invention pour agir sur des cellules.
En particulier, un objet de l'invention est l'utilisation des vésicules
produites par le
système fluidique selon l'invention à des fins d'imagerie et/ou à des fins
thérapeutiques.
Selon un mode de réalisation, la durée de l'agitation turbulente à une
longueur de
Kolmogorov inférieure ou égale à 50 i.tm par exemple de 17 à 35 im, est
supérieure ou
égale à 15 minutes, préférentiellement d'environ 20 minutes à environ 10
heures, plus
préférentiellement d'environ 20 minutes à environ 8 heures, encore plus
préférentiellement d'environ 1 heure à environ 6 heures, encore plus
préférentiellement
entre environ. 2 heures et environ 3 heures, encore plus préférentiellement
environ
2 heures ou alternativement environ 3 heures ou alternativement environ 4
heures.
Selon un mode de réalisation, l'agitateur du système fluidique de production
de vésicules
extracellulaires à partir de cellules productrices en suspension selon
l'invention est
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
9
constitué d'une pale. Alternativement, ledit agitateur est constitué de 2, 3,
4, 5, 6, 7, 8 ou
plus de 8 pales.
Selon une caractéristique préférée, l'au moins une pale dudit agitateur est
une pale
verticale.
Selon un mode de réalisation, l'agitateur du système fluidique de production
de vésicules
extracellulaires à partir de cellules productrices en suspension selon
l'invention est un
agitateur du type hélice par exemple marine ou hélice à pales profilées, ou
une turbine
par exemple turbine de Rushton, ou une ancre d'agitation, ou un agitateur
barrière, ou un.e
hélice à rubans hélicoïdaux, ou une roue à aubes, ou une roue dentée, ou un
agitateur
magnétique ou une combinaison de ces agitateurs.
Dans un mode de réalisation, des structures statiques peuvent être présentes
dans le
récipient, par exemple des baffles, ou encore des structures formant barrières
partielles
au mouvement liquide, telles celles utilisées dans un mélangeur statique.
On comprend qu'avec un tel système, il est possible de produire des vésicules
en grande
quantité, et dans un système adapté ou qui peut être adapté aux normes G.M.P.
On
comprend également qu'un tel système est plus simple et moins coûteux à
fabriquer que
les systèmes connus pour produire des vésicules extracellulaires.
L'invention est avantageusement complétée par les caractéristiques suivantes,
prises
individuellement ou en l'une quelconque de leurs combinaisons techniquement
possibles :
- l'agitateur du milieu liquide et les dimensions du récipient sont
adaptés à commander
un écoulement du milieu liquide, la longueur de Kolmogorov de l'écoulement
étant
inférieure ou égale 50 rn, et préférentiellement inférieure ou égale à 40 gm
; plus
préférentiellement inférieure ou égale à 35 m.
- le système fluidique comprend une sortie et une connectique reliée à la
sortie, la
conn.ectique étant susceptible de comprendre du milieu liquide et des
vésicules
extracellulaires;
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
-
l'agitateur est préférentiellement un agitateur rotatif ou orbital dont la ou
les vitesses
de rotation, la forme et la taille sont adaptées, avec la forme et les
dimensions du
récipient, à la génération d'un écoulement turbulent du milieu liquide dans le
récipient ;
5 - le
récipient est utilisé ou peut être utilisé en mode discontinu, c'est-à-dire
que le liquide
contenu dans le récipient est extrait après que les cellules productrices ont
produit des
vésicules extracellulaires pendant un temps donné.
- le système fluidique comprend un. séparateur de vésicules
extracellulaires.
- le système fluidique comprend un séparateur de vésicules extracellulaires
relié
10
fluidiquement au récipient de manière à être susceptible de réintroduire dans
le
récipient un milieu liquide appauvri en vésicules extracellulaires (EV).
- Le séparateur est positionné à l'intérieur ou à l'extérieur du
récipient, le liquide peut
être contenu dans le récipient et appauvri en vésicules grâce à un. séparateur
interne au
récipient, tandis que les cellules sont maintenues dans le récipient ou le
liquide peut
être contenu dans le récipient et appauvri, en vésicules grâce à un séparateur
extérieur
au récipient.
- l'entrée du séparateur étant reliée fluidiquement au récipient, la sortie du
séparateur
étant reliée fluidiquement au récipient de manière à être susceptible d'être
réintroduit
dans le récipient sous la forme d'un milieu liquide appauvri en vésicules.
Selon un mode de réalisation, le récipient du système fluidique de production
de vésicules
extracellulaires à partir de cellules productrices en suspension selon
l'invention est une
flasque à agitation d'une contenance de 100 mi: (par exemple l'appareil
Spinner stirring
flask Bellco for cell suspensions, référence Belle 505001), comprenant une
pale d'un
diamètre de 3,8 cm et un volume de travail inférieur à 100 mL.
Selon un autre mode de réalisation, le récipient du système fluidique de
production de
vésicules extracellulaires à partir de cellules productrices en suspension
selon l'invention
est une flasque à agitation dont les caractéristiques structurelles
(contenance, diamètre de
la pale et volume de travail) sont toutes augmentées ou diminuées de manière
proportionnelle par rapport à celles mentionnées ci-dessus pour la flasque à
agitation
d'une contenance de 100 mL ; selon un autre mode de réalisation, lesdites
caractéristiques
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
11
structurel les sont toutes augmentées ou diminuées de manière non
proportionnelle par
rapport à celles mentionnées ci-dessus pour la flasque à agitation d'une
contenance de
100 mL, notamment lors d'un changement d'échelle.
Selon un mode de réalisation, le récipient du système fluidique de production
de vésicules
extracellulaires à partir de cellules productrices en suspension selon
l'invention est une
flasque à agitation d'une contenance de 500 nit (par exemple l'appareil
Spinner stirring
flask Belle for cell suspensions, référence Belle 505010), comprenant une
pale d'un
diamètre de 7,6 cm et un volume de travail de 200 mL: à 500 mL, ou une flasque
à agitation
dont les caractéristiques structurelles (contenance, diamètre de la pale et
volume de
travail) sont toutes augmentées ou diminuées de manière proportionnelle par
rapport à
celles mentionnées ci-avant pour la flasque à agitation d'une contenance de
500 mL, ou
une flasque à agitation dont lesdites caractéristiques structurelles sont
toutes augmentées
ou diminuées de manière non proportionnelle par rapport à celles mentionnées
ci-dessus
pour la flasque à agitation d'une contenance de 500 mL, notamment lors d'un
changement
d'échelle.
Selon un mode de réalisation, le récipient du système fluidique de production
de vésicules
extracellulaires à partir de cellules productrices en suspension selon
l'invention est une
flasque à agitation d'une contenance de 1000 mL (par exemple l'appareil
Spinner stirring
flask Bellco for cell suspensions, référence Belle 505010), comprenant une
pale d'un
diamètre de 10,8 cm et un volume de travail supérieur ou égal à 300mL et
inférieur à IL,
ou une flasque à agitation dont les caractéristiques structurelles
(contenance, diamètre de
la pale et volume de travail) sont toutes augmentées ou diminuées de manière
proportionnelle par rapport à celles mentionnées ci-avant pour la flasque à
agitation d'une
contenance de 1000 mL.
Selon un autre mode de réalisation, le récipient du système fluidique de
production de
vésicules extracellulaires à partir de cellules productrices en suspension
selon l'invention
est un bioréacteur dont le volume de travail est de 400 mL à 1000 mi, et le
diamètre de la
pale est de 6 cm.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
12
Selon un. autre mode de réalisation, le récipient du système fluidique de
production de
vésicules extracellulaires à partir de cellules productrices en suspension
selon l'invention
est un bioréacteur dont le volume de travail et le diamètre de la pale sont
augmentés ou
diminués de manière proportionnelle par rapport aux valeurs respectives de 400
rriL et
.. 6 cm.
Selon un autre mode de réalisation, le récipient du système fluidique de
production de
vésicules extracellulaires à partir de cellules productrices en suspension
selon l'invention
est un bioréacteur avec moyen d'agitation par pale, dont l'homme de l'art peut
disposer
ou concevoir.
Selon un autre mode de réalisation, le récipient du système fluidique de
production de
vésicules extracellulaires à partir de cellules productrices en suspension
selon l'invention
est un bioréacteur dont le volume de travail et le diamètre de la pale sont
augm.en tés ou
diminués de manière non proportionnelle par rapport aux valeurs respectives
mentionnées
ci-dessus, notamment lors d'un changement d'échelle.
Selon un autre mode de réalisation, le récipient du système fluidique de
production de
vésicules extracellulaires à partir de cellules productrices en suspension
selon l'invention
est un bioréacteur ou une flasque à agitation dont les caractéristiques
géométriques, le
volume de travail, le type de mélangeur et ses caractéristiques, et le mode de
fonctionnement sont choisis selon des pratiques accessibles par l'homme de
l'art.
Un autre objet de l'invention est un procédé de production ex vivo de
vésicules
extracellulaires (EV) à partir de cellules productrices en suspension,
comprenant :
- un moyen de commande de la vitesse d'un agitateur adaptés pour la croissance
des cellules productrices en suspension, et dont la forme et les dimensions du
récipient
sont adaptés à la génération d'un écoulement turbulent du milieu liquide dans
le récipient
pour exercer des contraintes de cisaillement sur les cellules productrices
afin de réaliser
la production de vésicules extracellulaires (EV), la longueur de Kolmogorov de
l'écoulement étant inférieure ou égale à 50 m., préférentiellement inférieure
ou égale à
40 lm dans un. récipient, le récipient comprenant une sortie, le milieu
liquide comprenant
des cellules productrices en suspension, et
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
13
- une collecte du mi lieu liquide comprenant des vésicules extracellulaires
(EV) en
sortie du récipient.
Le procédé est avantageusement complété par les caractéristiques suivantes,
prises individuellement ou en l'une quelconque de leurs combinaisons
techniquement
possibles :
- on agite le milieu liquide pendant au moins vingt minutes ;
- on commande l'agitateur pour entraîner un écoulement du milieu liquide
constant ou
intermittent, d'intensité croissante ou décroissante, la longueur de
Kolmogorov de
l'écoulement étant inférieure ou égale à 40 pm ;
.. - un séparateur appauvrit une partie du milieu liquide collecté en sortie
du récipient en
vésicules extracellulaires, et on réintroduit la partie du milieu liquide dans
le récipient.
Le procédé est alternativement complété par les caractéristiques suivantes,
prises
individuellement ou en l'une quelconque de leurs combinaisons techniquement
possibles :
- le procédé comprend une étape préalable de chargement d'au moins un. agent
thérapeutique et/ou d'imagerie présent dans le milieu liquide.
- l'écoulement du milieu liquide permet de simultanément charger l'au
moins un agent
thérapeutique et/ou d'imagerie à l'intérieur des cellules productrices et
produire les
vésicules extracellulaires (EV) dans un récipient.
L'invention porte ainsi sur un procédé de production ex vivo de vésicules
extracellulaires
à partir de cellules productrices en
suspension, comprenant :
(i) l'insertion de cellules productrices dans un récipient comprenant un
milieu liquide:
(ii) l'actionnement d'une commande d'un agitateur entraînant un écoulement
turbulent
du milieu liquide, la longueur de Kolmogorov de l'écoulement étant inférieure
ou égale
à 50 pm, préférentiellement inférieure ou égale à 40 pm, ledit écoulement
permettant de
produire les vésicules extracellulaires dans ledit récipient ; et
(iii) la collecte du milieu liquide comprenant les vésicules extracellulaires
produites à
l'étape (ii).
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
14
Selon un mode de réalisation, le récipient dans lequel les cellules
productrices sont
insérées à l'étape (i) est un système fluidique de production de vésicules
extracellulaires
à partir de cellules productrices en suspension selon l'invention tel que
décrit dans la
présente demande.
En particulier, un objet de l'invention est constitué par les vésicules
obtenues grâce au
procédé de production ex vivo de vésicules extracellulaires à partir de
cellules
productrices en suspension selon l'invention.
En particulier, un objet de l'invention est l'utilisation des vésicules
obtenues grâce au
procédé de production ex vivo de vésicules extracellulaires à partir de
cellules
productrices en suspension selon l'invention pour agir sur des cellules.
En particulier, mi objet de l'invention est l'utilisation des vésicules
obtenues grâce au
procédé de production ex vivo de vésicules extracellulaires à partir de
cellules
productrices en suspension selon l'invention à des fins d'imagerie et/ou à des
fins
thérapeutiques.
Selon un objet similaire, l'invention est un procédé de chargement d'au moins
un agent
thérapeutique et/ou d'imagerie à l'intérieur ou à la membrane de vésicules
extracellulaires
(EV) à partir de cellules productrices, comprenant les étapes suivantes :
- ajouter dans un récipient un milieu liquide comprenant des cellules
productrices et au
moins un agent thérapeutique et/ou d'imagerie,
- actionner une commande d'un agitateur entraînant un écoulement turbulent
d'un
milieu liquide, la longueur de Kolmogorov de l'écoulement étant inférieure ou
égale
à 50 itm, préférentiellement inférieure ou égale à 40 itm, ledit écoulement
permettant
de simultanément charger ['au moins un agent thérapeutique et produire les
vésicules
extracellulaires (EV) dans le récipient, le récipient comprenant une sortie,
- collecter le milieu liquide comprenant des vésicules extracellulaires (EV)
en sortie du
récipient.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
Le procédé est alternativement complété par les caractéristiques suivantes,
prises
individuellement ou en l'une quelconque de leurs combinaisons techniquement
possibles :
- on commande l'agitateur pour entraîner un écoulement du milieu liquide,
la longueur
5 de Kolmogorov de l'écoulement étant inférieure ou égale à 40 itm ;
- les vésicules extracellulaires (EV) en sortie du récipient comprennent
un mélange de
vésicules extracellulaires chargées d'au moins un agent thérapeutique et/ou
d'imagerie ou des vésicules extracellulaires non chargées.
Selon un mode de réalisation, l'au moins un agent d'imagerie médicale est
choisi, par
10 exemple parmi un agent de fluorescence, un agent de luminescence, un
isotope radioactif,
un agent de contraste aux propriétés magnétiques, plasmoniques, acoustiques ou
radio
opaques et leurs mélanges.
Les caractéristiques préférées notamment quant au type de cellules
productrices, à leur
concentration dans le milieu liquide, aux gammes de longueur de Kolmogorov, à
la durée
15 .. de l'agitation turbulente à une longueur de Kolmogorov inférieure ou
égale à 50 itm par
exemple de 5 à 35 itm, et à la contenance, milieu de travail, au type
d'agitateur et au
diamètre de l'éventuelle au moins une pale du système fluidique, qui sont
décrites pour
le système fluidique ci-dessus, sont également des caractéristiques préférées
des procédés
selon l'invention, à savoir le procédé de production ex vivo de vésicules
extracellulaires
à partir de cellules productrices en suspension et le procédé de chargement
d'au moins un
agent thérapeutique et/ou d'imagerie à l'intérieur ou à la membrane de
vésicules
extracellulaires à partir de cellules productrices.
En particulier, un objet de l'invention est constitué par les vésicules
obtenues grâce au
procédé de chargement d'au moins un agent thérapeutique et/ou d'imagerie à
l'intérieur
ou à la membrane de vésicules extracellulaires à partir de cellules
productrices selon
l'invention.
En particulier, un objet de l'invention est l'utilisation des vésicules
obtenues grâce au
procédé de chargement d'au moins un agent thérapeutique et/ou d'imagerie à
l'intérieur
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
16
ou à la membrane de vésicules extracellulaires à partir de cellules
productrices selon
l'invention pour agir sur des cellules.
En particulier, un objet de l'invention est l'utilisation des vésicules
obtenues grâce au
procédé de chargement d'au moins un agent thérapeutique et/ou d'imagerie à
l'intérieur
ou à la membrane de vésicules extracellulaires à partir de cellules
productrices selon
l'invention à des fins d'imagerie et/ou à des fins thérapeutiques.
L'invention a également pour objet les vésicules extracellulaires produites
par le systèm.e
de production de vésicules extracellulaires à partir de cellules productrices
en suspension
selon l'invention.
L'invention porte aussi sur les vésicules extracellulaires obtenues grâce au
procédé de
production et de récupération de vésicules extracellulaires selon l'invention.
L'invention porte également sur les vésicules extracellulaires obtenues grâce
au procédé
de chargement de vésicules extracellulaires selon l'invention.
L'invention porte aussi sur les vésicules extracellulaires obtenues par mise
en oeuvre du
système fluidique selon l'invention tel que décrit dans la présente demande,
et/ou par le
procédé de production ex vivo de vésicules extracellulaires (EV) à partir de
cellules
productrices en suspension selon l'invention tel que décrit dans la présente
demande,
et/ou par le procédé de chargement d'au moins un agent thérapeutique et/ou
d'imagerie à
l'intérieur ou à la membrane de vésicules extracellulaires (EV) à partir de
cellules
productrices selon l'invention tel que décrit dans la présente demande.
Il est bien connu de l'homme du métier que la structure des vésicules
extracellulaires
varie en fonction des cellules productrices utilisées et en fonction du
procédé d'obtention
utilisé, notamment en termes de marqueurs membran.aires et constituants
présents sur ces
vésicules.
Selon un mode de réalisation, les vésicules extracellulaires selon la présente
invention
présentent un diamètre moyen compris entre 40 et 300 nm, préférentiellement
entre 45 et
90 nm, plus préférentiellement entre 50 et 65 nm, encore plus
préférentiellement environ
60 nm, ledit diamètre moyen des vésicules extracellulaires étant mesuré par
une méthode
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
17
d'interférom.étrie en combinaison ou non avec de la fluorescence, de
préférence ledit
diamètre moyen est mesuré grâce à l'appareil ExoViewTM R100 commercialisé par
l'entreprise NanoView Bioscience.
Selon un mode de réalisation, les vésicules extracellulaires selon la présente
invention
présentent un diamètre moyen compris entre 50 et 500 nm, préférentiellement
entre
100 et 110 nm, plus préférentiellement entre 105 et 109 nm, encore plus
préférentiellement environ 106 nm ou alternativement environ 108 nm, ledit
diamètre
moyen des vésicules extracellulaires étant mesuré par une méthode de suivi
individuel de
particules (ou NTA pour Nanoparticle Tracking An.alysis) par exemple avec
l'appareil
NanoSight NS300 commercialisé par l'entreprise Malvem Panalytical.
Avantageusement, lesdites vésicules extracellulaires présentent des marqueurs
membran.aires CD81, CD63, et/ou CD9 tel que décrit dans la figure 11. Plus
avantageusement, lesdites vésicules extracellulaires expriment les marqueurs
CD81 et/ou
CD63. Les vésicules extracellulaires produites à partir du système fluidique
selon
l'invention et/ou selon le procédé selon l'invention peuvent être refroidies à
une
température souhaitée, par exemple environ 4 degrés centigrades, ou encore
elles peuvent
être congelées si on le souhaite pour un transport.
L'invention a aussi pour objet l'utilisation des vésicules extracellulaires
produites par le
système fluidique selon l'invention tel que décrit dans la présente demande,
et/ou
obtenues grâce au procédé de production ex vivo de vésicules extracellulaires
(EV) à partir
de cellules productrices en suspension selon l'invention tel que décrit dans
la présente
demande, et/ou obtenues grâce au procédé de chargement d'au moins un agent
thérapeutique etiou d'imagerie à l'intérieur ou à la membrane de vésicules
extracellulaires
(EV) à partir de cellules productrices selon l'invention tel que décrit dans
la présente
demande, en tant que vecteur pour l'administration d'au moins un agent
d'imagerie
médicale, par exemple pour réaliser une imagerie médicale. Selon un mode de
réalisation,
l'au moins un agent d'imagerie médicale est choisi, par exemple, parmi un
agent de
fluorescence, un agent de luminescence, un isotope radioactif, un agent de
contraste aux
propriétés magnétiques, plasmoniques, acoustiques ou radio opaques et leurs
mélanges.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
18
La présente invention porte aussi sur les vésicules extracellulaires produites
par le
système fluidique selon l'invention tel que décrit dans la présente demande,
et/ou
obtenues grâce au procédé de production ex vivo de vésicules extracellulaires
(EV) à partir
de cellules productrices en suspension selon l'invention tel que décrit dans
la présente
demande, et/ou obtenues grâce au procédé de chargement d'au moins un agent
thérapeutique etiou d'imagerie à l'intérieur ou à la membrane de vésicules
extracellulaires
(EV) à partir de cellules productrices selon l'invention tel que décrit dans
la présente
demande, pour leur utilisation thérapeutique.
La présente invention porte aussi sur les vésicules extracellulaires produites
par le
système fluidique selon l'invention tel que décrit dans la présente demande,
et/ou
obtenues grâce au procédé de production ex vivo de vésicules extracellulaires
(EV) à partir
de cellules productrices en suspension selon l'invention tel que décrit dans
la présente
demande, et/ou obtenues grâce au procédé de chargement d'au moins un agent
thérapeutique et/ou d'imagerie à l'intérieur ou à la membrane de vésicules
extracellulaires
(EV) à partir de cellules productrices selon l'invention tel que décrit dans
la présente
demande, pour leur utilisation en immunothérapie, en médecine régénérative, en
alternative ou en complément à la thérapie cellulaire, en tant que vecteur
pour délivrer au
moins un agent thérapeutique et/ou d'imagerie et/ou dans le traitement de
tumeurs, de
maladies infectieuses, de maladies inflammatoires, de maladies immunologiques,
de
maladies métaboliques, de maladies cancéreuses, de maladies génétiques, de
maladies
dégénératives ou de maladies secondaires à des chirurgies ou traumatismes.
La présente invention porte aussi sur une méthode de traitement en
immunothérapie, en
médecine régénérative, en alternative ou en complément à la thérapie
cellulaire, en. tant
que vecteurs d'au moins un agent thérapeutique et/ou d'imagerie, et/ou de
traitement de
tumeurs, de m.aladies infectieuses, de maladies inflammatoires, de maladies
immunologiques, de maladies métaboliques, de maladies cancéreuses, de maladies
génétiques, de maladies dégénératives ou de maladies secondaires à des
chirurgies ou
traumatismes, impliquant l'administration à un sujet en ayant besoin de
vésicules
extracellulaires produites par le système fluidique selon l'invention tel que
décrit dans la
présente demande, et/ou obtenues grâce au procédé de production ex vivo de
vésicules
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
19
extracellulaires (EV) à partir de cellules productrices en suspension selon
l'invention tel
que décrit dans la présente demande, et/ou obtenues grâce au procédé de
chargement d'au
moins un agent thérapeutique et/ou d'imagerie à l'intérieur ou à la membrane
de vésicules
extracellulaires (EV) à partir de cellules productrices selon l'invention tel
que décrit dans
la présente demande.
La présente invention porte aussi sur l'utilisation des vésicules
extracellulaires produites
par le système fluidique selon l'invention tel que décrit dans la présente
demande, et/ou
obtenues grâce au procédé de production ex vivo de vésicules extracellulaires
(EV) à partir
de cellules productrices en suspension selon l'invention tel que décrit dans
la présente
demande, et/ou obtenues grâce au procédé de chargement d'au moins un agent
thérapeutique et/ou d'imagerie à l'intérieur ou à la membrane de vésicules
extracellulaires
(EV) à partir de cellules productrices selon l'invention tel que décrit dans
la présente
demande, en vue de la fabrication d'un médicament utilisé en immunothérapie,
en
médecine régénérative, en alternative ou en complément à la thérapie
cellulaire, en tant
que vecteur d'au moins un agent thérapeutique et/ou d'imagerie, et/ou utilisé
dans le
traitement de tumeurs, de maladies infectieuses, de maladies inflammatoires,
de maladies
immunologiques, de maladies métaboliques, de maladies cancéreuses, de maladies
génétiques, de maladies dégénératives ou de maladies secondaires à des
chirurgies ou
traumatismes.
Selon un mode de réalisation, l'utilisation thérapeutique des vésicules
extracellulaires, les
vésicules extracellulaires pour leur utilisation thérapeutique, les méthodes
de traitement
ou l'utilisation des vésicules extracellulaires pour leur utilisation en vue
de la fabrication
d'un médicament, telles que décrites ci-dessus, implique l'administration
et/ou
l'utilisation ex vivo desdites vésicules extracellulaires. L'administration
peut par exemple
être parentérale ou en.téral.e, telles qu'une administration injectable
(notamment
intraveineuse, intramusculaire, sous-cutanée, intrarachidienne...), orale
buccale, cutanée,
locale, vaginale, rectale, oculaire, auriculaire, etc.
Selon une caractéristique préférée, l'invention porte sur les vésicules
extracellulaires
selon l'invention, telles que décrites dans la présente demande, obtenues à
partir de
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
cellules productrices TUP-I ou de lymphocytes, pour leur utilisation par
exemple en
immunothérapie et/ou cancérologie.
Selon une autre caractéristique préférée, l'invention porte sur les vésicules
extracellulaires selon l'invention, telles que décrites dans la présente
demande, obtenues
5 à partir de cellules productrices qui sont des cellules souches
mésenchymateuses (MSC),
pour leur utilisation en médecine régénérative ou dans le traitement de
tumeurs, de
maladies infectieuses, de maladies inflammatoires, de maladies immunologiques,
de
maladies métaboliques, de maladies cancéreuses, de maladies génétiques, de
maladies
dégénératives ou de maladies secondaires à des chirurgies ou traumatismes.
10 Selon une autre caractéristique préférée, l'invention porte sur les
vésicules
extracellulaires selon l'invention, telles que décrites dans la présente
demande, obtenues
à partir de tout type de cellules ou à partir de globules rouges, et chargées
en au moins un
agent thérapeutique, pour leur utilisation pour délivrer ['au moins un agent
thérapeutique
dans le corps d'un sujet.
15 Selon une autre caractéristique préférée, l'invention porte sur
l'utilisation des vésicules
extracellulaires selon l'invention, telles que décrites dans la présente
demande, obtenues
à partir de tout type de cellules ou à partir de globules rouges, et chargées
en au moins un
agent d'imagerie, pour réaliser un examen d'imagerie médicale.
Selon une autre caractéristique préférée, l'invention porte sur l'utilisation
des vésicules
20 extracellulaires selon l'invention, telles que décrites dans la présente
demande, obtenues
à partir de tout type de cellule ou à partir de globules rouges, et chargées
en au moins un
agent thérapeutique et au moins un agent d'imagerie, pour réaliser le suivi de
la
distribution desdites vésicules extracellulaires dans le corps d'un sujet par
imagerie
médicale et délivrer l'au moins un agent thérapeutique dans le corps dudit
sujet.
DÉFINITIONS
Le terme vésicule extracel.lulaire désigne de manière générale une vésicule
libérée de
manière endogène par une cellule productrice, dont le diamètre est compris
entre 30 nm
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
21
et 5000 nm. Une vésicule extracellulai.re correspond en particulier à un
exosotne et/ou
une microvésicule et/ou un corps apoptotique cellulaire.
Le terme cellule productrice en suspension désigne de manière générale une
cellule
qui n'est pas adhérente sur un milieu et peut se diviser et se multiplier.
Selon un autre
aspect de l'invention, le terme cellules productrices en suspension
désigne des cellules
humaines, d'origine animale ou végétale, des bactéries ou autres micro-
organismes
capables de sécréter des vésicules extracellulaires. Selon un autre aspect de
l'invention,
le terme cellules productrices en suspension désigne des cellules
adhérentes détachées
de leur support de culture et mises en suspension. Un mélange doux créé par
l'agitateur
permet aux cellules productrices en suspension telles que définies de rester
en suspension
dans le milieu liquide de culture. Selon un autre aspect de l'invention, le
terme cellules
productrices en suspension désigne des agrégats cellulaires. Le terme
agrégats
cellulaires désigne un assemblage de plusieurs cellules productrices en
suspension qui
adhèrent entre elles. Un mélange doux créé par l'agitateur permet aux cellules
productrices en suspension telles que définies de rester en suspension dans le
milieu
liquide de culture.
Le terme agent thérapeutique ou agent d'imagerie désigne de manière
générale
tout agent, molécule ou particule, composé d'intérêt pouvant être chargé,
inséré dans les
vésicules extracellulaires. Ces agents peuvent être des agents thérapeutiques
molécules
ou particules pour traiter les maladies infectieuses, inflammatoires,
métaboliques,
dégénératives, traumatiques, post-chirurgicales, génétiques, malignes
(tumeurs),
orphelines, du système vasculaire, lymphatique, locomoteur, digestif, nerveux,
reproducteur, excréteur etlou des agents (molécules ou particules) d'imagerie
nucléaire,
magnétique, optiques, acoustiques, etc. Ainsi, l'au moins un agent d'imagerie
médicale
selon la présente invention peut avantageusement être choisi parmi un agent de
fluorescence, un agent de luminescence, un isotope radioactif, un agent de
contraste aux
propriétés magnétiques, plasmoniques, acoustiques ou radio opaques et leurs
mélanges.
Le terme agitateur doit être compris selon un sens extrêmement général, qui
est celui
d'un moyen ou d'une combinaison de moyens permettant par action sur le liquide
de
.. générer au moins un écoulement, de favoriser le mélange du liquide ou de
générer de la
turbulence dans ce liquide.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
22
Le terme environ , placé devant un nombre, signifie plus ou moins 10% de la
valeur
nominale de ce nombre.
Le terme cellule désigne la plus petite unité structurale et fonctionnelle
fondamentale
des organismes vivants, constituée d'un protoplasme ou cytoplasme, séparée du
milieu
externe par une membrane. Dans le cadre de la présente invention, le terme
cellule
englobe aussi les globules rouges et les plaquettes.
Le terme cellules saines désigne des cellules issues de tissus sains, par
opposition à
des cellules issues de tissus ou organes pathologiques c'est-à-dire dont les
fonctions sont
altérées.
Le terme entre X et Y concerne la gamme de valeurs comprises entre X et Y,
les
bornes X et Y étant incluses dans ladite gamme.
Le terme immunothérapie désigne le traitement d'une maladie par une
intervention
sur le système immunitaire.
Le terme médecine régénérative désigne l'ensemble des méthodes biomédicales
utilisées pour le remplacement ou la régénération de tissus ou organes humains
dans un
but thérapeutique.
Le terme sujet désigne un animal, y compris un être humain, masculin ou
féminin,
quel que soit l'âge. Au sens de la présente invention, un sujet peut être un
patient, à savoir
une personne recevant des soins médicaux, subissant ou ayant subi un
traitement médical,
ou surveillée dans le cadre du développement d'une maladie.
Le terme thérapie cellulaire désigne l'utilisation chez l'homme de cellules
somatiques
vivantes, manipulées ou modifiées en leurs caractéristiques biologiques, pour
prévenir,
traiter, ou atténuer certaines pathologies.
PRÉSENTATION DES FIGURES
D'autres caractéristiques et avantages ressortiront encore de la description
qui suit,
laquelle est purement ill.ustrative et non limitative, et doit être lue en
regard des figures
annexées, parmi lesquelles :
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
23
[Fig. 1] illustre schématiquement un système fluidique pour la production de
vésicules
extracellulaires;
[Fig. 2] illustre le nombre de vésicules extracellulaires produites par des
cellules THP1
dans un système fluidique après 20 minutes d'agitation pour différentes
intensités
d'agitations ;
[Fig. 3] illustre le nombre de vésicules extracellulaires produites par des
cellules THP1
après 3 heures d'agitation pour différentes intensités d'agitations ;
[Fig. 4] illustre le nombre de vésicules extracellulaires produites par des
cellules THP1
dans un système fluidique après 20 minutes d'agitation pour différentes
longueurs de
Kolmogorov ;
[Fig. 5] illustre le nombre de vésicules extracellulaires produites par des
cellules THP1
dans un système fluidique pour les agitations 200 RPM et 300 RPM en fonction
du
temps ;
[Fig. 6] illustre le nombre de vésicules extracellulaires produites par des
cellules
C3H/10T1/2 dans un système fluidique après 20 minutes d'agitation pour
différentes
longueurs de Kolmogorov ;
[Fig. 7] illustre le nombre de vésicules extracellulaires produites par des
cellules de Raji
et des cellules HeLa soit dans un système fluidique après 3 heures d'agitation
turbulente
(pour les cellules HeLa l'agitation est de 250 RPM et longueur de Kolmogorov
de 41 p.m
et pour les cellules de Raji l'agitation est de 500 RPM et longueur de
Kolmogorov est de
24 itm) soit en conditions de carence ;
[Fig. 8] illustre en 8a) le nombre de cellules de Raji viables avant et après
soit une
agitation turbulente de 3 heures (500 RPM avec longueur de Kolmogorov de 24
m), soit
des conditions de carence. En 8b) est illustré le pourcentage d'adénylate
kinase dans le
surnageant de l'essai contrôle, de l'essai en carence 2D 72h et de l'essai
selon
l'invention ;
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
24
[Fig. 9] illustre l'aspect des cellules productrices de Raji entre après 3
heures dans l'essai
contrôle et après 3 heures d'agitation turbulente (500 RPM avec longueur de
Kolmogorov
de 24 gm), par observation au microscope optique ;
[Fig. 10] illustre le nombre de vésicules extracellulaires produites par des
cellules
THP-1 en carence 3D ou en carence 2D pour différents temps ;
[Fig. 11] illustre la distribution de taille de vésicules extracellulaires
produites à partir de
cellules productrices THP-1, Hel,a ou de Raji, en conditions de carence ou de
turbulence
(500 RPM avec longueur de Kolmogorov de 24 gm), mesurée par NTA ;
[Fig. 12] illustre la distribution de taille de vésicules extracellulaires
produites à partir de
cellules productrices THP-1 en conditions de carence pendant 72 h ou de
turbulence
pendant 3 heures (500 RPM avec longueur de Kolmogorov de 24 itm), mesurée par
l'ExoViewTM R100;
[Fig. 13] illustre l'analyse des marqueurs membranaires de vésicules
extracellulaires
produites à partir de cellules productrices THP-1 en conditions de carence ou
de
turbulence (500 RPM avec longueur de Kolmogorov de 24 m), mesurée par
l'ExoViewTM R100 ;
[Fig. 14] illustre le nombre de vésicules extracellulaires produites par des
globules rouges
après 2 heures d'agitation pour différentes longueurs de Kolmogorov (18,6 i.tm
pour la
figure du haut et 10,9 pm pour la figure du bas versus un contrôle sans
agitation) ; et
[Fig. 15] illustre le chargement de vésicules extracellulaires en doxorubicine
à partir de
cellules productrices THP-1 via un chargement passif (incubation avec la
doxorubicine à
10 j.IM à 34 RPM avec longueur de Kolmogorov de 181 ium pendant 2h, suivie des
lavages
puis agitation à 2h à 400RPM avec longueur de Kolmogorov 28 pin) ou bien via
un
chargement et production en présence d'une agitation turbulente (pendant 2h à
400 RPM
avec longueur de Kolmogorov de 28 1.1m avec la doxorubicine à 10 }LM) suivie
des
lavages.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
DESCRIPTION DÉTAILLÉE
Eléments théoriques
La longueur de Kolmogorov (ou dimension de Kolmogorov ou longueur d'eddy) est
la
longueur à partir de laquelle la viscosité d'un fluide permet de dissiper
l'énergie cinétique
5 d'un écoulement de ce fluide. En pratique, la longueur de Kolmogorov
correspond à la
taille des plus petits tourbillons dans un écoulement turbulent. Cette
longueur Li( est
calculée dans la publication de Kolmogorov (Kolmogorov, A. N., 1941, January,
The
local structure of turbulence in incompressible viscous fluid for very large
Reynolds
numbers, In Dokl. Akad. Nauk, SSSR, Vol. 30, No. 4, pp. 301-305) et décrite
par la
10 formule (I) suivante :
[Math 1] Lk = v3/ . e-1/ (I)
dans laquelle y est la viscosité cinématique du milieu liquide en écoulement
et s est le
taux moyen de dissipation d'énergie dans le fluide par unité de masse (ou taux
d'injection
d'énergie dans le fluide).
15 Zhou et al. (Zhou, G., Kresta, S. M., 1996, Impact of tank geometry on
the maximum
turbulence energy dissipation rate for impellers, AIChE journal, 42(9), 2476-
2490)
décrivent la relation entre c moyen et la géométrie d'un récipient dans lequel
un milieu
liquide est agité par agitateur de type roue à aubes. Cette relation est
donnée par la formule
(II) suivante :
P
20 [Math 2] e =ND5N3 . = (II)
dans laquelle Np est le nombre de puissance (ou nombre de Newton) adimensionné
de
l'agitateur dans le milieu liquide, D est le diamètre de l'agitateur (en
mètre), N est la
vitesse de rotation (en nombre de tours par seconde) et V est le volume de
milieu liquide
(en mètre cube). Cette relation est utilisée pour le calcul de s moyen
correspondant à la
25 géométrie d'un récipient et d'un agitateur utilisés pour la mise en
oeuvre de l'invention.
Le nombre de puissance Np est donné de manière connue par la formule (III) :
P
[Math 3] = e N-, D5 p (111)
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
26
dans laquelle P est la puissance apportée par l'agitateur, et p est la densité
du milieu
liquide. La formule (III) peut être ajustée comme décrit dans Nienow et al.
(Nienow, A.
W., & Miles, D., 1971, Impeller power numbers in closed vessels, in.dustrial &
Engineering Chemistry Process Design and Development, 10(1), 41-43) ou Zhou et
al.
(Zhou, G., Kresta, S. M., 1996, Impact of tank geometry on the maximum
turbulence
energy dissipation rate for impellers, AlChE journal, 42(9), 2476-2490) en
fonction du
nombre de R.eynolds de l'écoulement du milieu liquide. Il est également
possible de
calculer le nombre de Reynolds du système par la formule (IV) suivante :
N.D2 õ
[Math 4] Re =¨ (1V)
Alternativement, l'homme du métier de par ses connaissances générales et avec
des
modes de calcul alternatifs peut calculer la longueur de Kolmogorov par unité
de volume.
En tout état, le calcul présenté ci-dessus n'est qu'une façon parmi tant
d'autres connues
de l'homme du métier de calculer la longueur de Kolmogorov.
Architecture générale du système fluidique
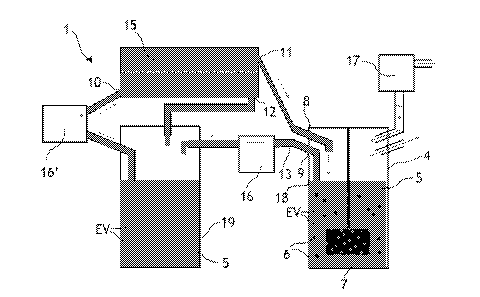
La figure 1 illustre schématiquement un systèm.e fluidique (1) pour la
production de
vésicules extracellulaires (EV). Le système fluidique (1) de production de
vésicules
extracellulaires (EV) vise à la production en grande quantité de vésicules
extracellulaires
(EV) dans un récipient (4). Toutefois, l'invention n'est pas limitée à ce mode
de
réalisation et peut comprendre une série de récipients (4) reliés
fluidiquem.ent en parallèle
ou en série.
Le récipient (4) contient un milieu liquide (5). Le récipient (4) peut
notamment être une
cuve, une flasque, par exemple en verre ou en matière plastique, ou tout autre
récipient
adapté à contenir un milieu liquide (5). Le récipient peut être souple, ou
contenir des
parties souples. Le volume du récipient (4) est l'un des facteurs permettant
de produire
des vésicules extracellulaires (EV) en grande quantité : ce volume peut être
compris entre
50 mL et 500 L, préférentiellement entre 100 mL et 100 L, et
préférentiellement entre
300 mi, et 40 L. Le volum.e du récipient (4) illustré schématiquement dans la
figure 1 est
de 1 L. Le récipient (4) comprend typiquement une ou plusieurs entrées
gazeuses et une
ou plusieurs sorties gazeuses, par lesquelles peut s'écouler une atmosphère
comprenant
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
27
des concentrations en air, 02, N2 et en CO2 adaptées à la culture cellulaire,
par exemple
comprenant 5% de CO2. Cette atmosphère peut provenir d'un injecteur/mélangeur
de gaz
adapté ou d'une étuve à atmosphère contrôlée en CO2. Une deuxième pompe (17)
permet
de commander cet écoulement gazeux dans le récipient (4). Le récipient (4)
comprend
également une sortie (9) susceptible de comprendre du milieu liquide (5) et
des vésicules
extracellulaires (EV). Cette sortie peut être complétée d'un moyen de
séparation et/ou de
filtration des cellules en suspension perm.ettant de ne pas récupérer des
cellules en
suspension en dehors du récipient (4). Cette sortie (9) permet d'extraire hors
du récipient
(4) les vésicules extracellulaires (EV) produites. Le récipient (4) peut
également
.. comprendre au moins une entrée (8) adaptée à introduire le milieu liquide
(5) dans le
récipient (4).
Le milieu liquide (5) peut être de manière générale une solution saline, par
exemple
isotonique. Préférentiellement, le milieu liquide (5) est un milieu liquide de
culture avec
adjonction de composés permettant la culture des cellules d'intérêt, ou un
milieu
complémenté en sérum ou I.ysat plaqu.ettaire préalablement purifié des
vésicules
extracellulaires ou un milieu sans sérum, permettant de ne pas contaminer les
vésicules
extracellulaires (EV) produites par le système fluidique (1) par des protéines
ou d'autres
vésicules provenant d'un sérum ou I.ysat plaquettaire. Un milieu liquide (5)
de type
DMEM sans sérum peut être utilisé. Le volume maximum de milieu liquide (5) est
déterminé en partie par le récipient (4). Ce volume maximum peut également
être compris
entre 50 mL et 500 L, préférentiellement entre 100 mL et 100 L, et plus
préférentiellement
entre 300 mL et 40 L. Le volume minimum de milieu liquide (5) contenu par le
récipient
(4) est en partie déterminé par le choix de l'agitateur (7) permettant
d'agiter le milieu
liquide (5).
Le système fluidique (1) comprend également des cellules productrices en
suspension (6),
le terme cellules productrices en suspension incluant à la fois les cellules
en suspension
(cellules non-adhérentes) et les cellules mises en suspension (cellules
adhérentes). Les
vésicules extracellulaires (EV) sont produites par le système fluidique (1) à
partir de ces
cellules productrices en suspension (6). Les cellules productrices en
suspension (6)
peuvent être cultivées, avant la production de vésicules extracellulaires (EV)
par le
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
28
système fluidique (1) dans un milieu de culture cellulaire adapté. Ainsi,
aucun transfert
de cellules n'est nécessaire entre la culture des cellules productrices en
suspension (6) et
la production des vésicules extracellulai.res (EV), ce qui permet d'éviter
toute
contamination et de simplifier le procédé dans son ensemble. La majorité des
cellules
productrices en suspension (6) est en suspension de manière homogène dans le
milieu,
même si une proportion minoritaire de cellules productrices en suspension (6)
peut être
sédimentée au fond du récipient (4) ou collée sur la paroi du récipient (4),
par exemple
par l'agitation du milieu liquide (5). Préférentiellement, le système
fluidique (1) est
adapté de manière à générer une agitation douce permettant d'homogénéiser les
cellules
productrices (6) dans le milieu liquide (5) au sein du récipient (4),
préférentiellement
avant la production des vésicules extracellulaires. De manière générale, tout
type de
cellules productrices (6) peut être utilisé, de préférence des cellules
productrices (6) en
suspension non adhérentes.
Le récipient (4) comprend également un agitateur (7) permettant d'agiter le
milieu liquide
(5). L'agitateur (7) peut être une roue à aubes, dont les aubes sont au moins
en partie
plongées dans le milieu liquide (5), et mise en mouvement par une transmission
de forces
magnétiques ou mécaniques. L'agitateur (7) peut également être un système de
perfiision
de milieu liquide (5) à un débit suffisant pour agiter le milieu liquide (5)
contenu par le
récipient, ou un système à murs rotatifs (par exemple agencés sur des
rouleaux).
L'agitateur (7) peut alternativement être du type rouleur à bouteilles ou
rollers à
bouteilles, agitateur orbital pour Erlenmeyers, avec ou sans baffles (shaken
flask),
agitateur à bascule (wave), biorécipient avec agitation pneumatique (air-lift)
ou un
agitateur rotatif à pales tel qu'un agitateur de type hélice marine, turbine
de Rushton,
ancres d'agitation, agitateur barrière, hélice rubans hélicoïdaux. Un
agitateur rotatif
préféré est une turbine à pales verticales. Enfin, des structures statiques
peuvent être
présentes dans le récipient, par exemple des baffles, ou encore des structures
formant
baiTières partielles au mouvement liquide, telles celles utilisées dans un
mélangeur
statique, peuvent naturellement aussi être utilisées. L'agitateur (7) et les
dimensions du
récipient (4) sont adaptés à commander un écoulement turbulent du milieu
liquide (5)
dans le récipient (4). L'homme du métier de par ses connaissances générales
sait calculer
la longueur de Kolmogorov adaptée pour chaque type d'agitateur (7) en fonction
des
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
29
dimensions du récipient (4), de la géométrie de l'agitateur (7) et de
l'intensité de
l'agitation. Par écoulement turbulent, on entend un écoulement dont le nombre
de
Reynolds est supérieur à 2000. Le nombre de Reynolds peut par exemple être
calculé par
la formule (IV). Préférentiellement, le nombre de Reynolds Re de l'écoulement
de milieu
liquide (5) est supérieur à 7 000, préférentiellement à 10 000 et
préférentiellement à
12 000.
D'autres agitateurs (7) permettant de commander un écoulement turbulent selon
la
présente invention sont des agitateurs bien connus de l'homme du métier et
susceptibles
d'être implantés dans le système selon la présente invention.
L'agitateur (7) utilisé dans les exemples de réalisation de l'invention
comprend une roue
à aube ou une pale agencée dans un récipient (4) et mise en mouvement par un
système
de transmission de forces magnétiques ou mécaniques. La vitesse de la roue à
aube ou de
la pale dans le milieu liquide (5) entraine un écoulement du milieu liquide
(5). L'agitateur
est adapté à commander un écoulement, qui, compte-tenu des dimensions du
récipient
.. (4), est turbulent. Dans le cas de l'agitateur (7) illustré en figure 1,
plusieurs paramètres
permettent de calculer une valeur représentative de la turbulence du milieu
liquide (5), en
particulier la viscosité cinématique y du milieu liquide (5), les dimensions
du récipient
(4) et en particulier le volume V de milieu liquide (5) contenu dans le
récipient (4), le
nombre de puissance Np correspondant à la partie immergée de la roue à aube ou
de la
pale, le diamètre D de l'agitateur et en particulier de la roue ou de la pale,
la vitesse N de
rotation de la roue ou de la pale. L'utilisateur peut ainsi calculer, en
fonction de ces
paramètres, des valeurs représentatives de la turbulence de l'écoulement, et
en particulier
la longueur de Kolmogorov Lx, telle que donnée par les équations (I), (II) et
(III). En
particulier, l'agitateur (7) est adapté à commander un écoulement dans lequel
la longueur
.. Lx est inférieure ou égale à 50 gm et préférentiellement à 40 m..
Dans un exemple de réalisation du systèm.e fluidique (1), la vitesse de
rotation de
l'agitateur (7) est susceptible d'être commandée à 500 ITom (rotations par
minute) par
exemple, le diamètre d'une roue à aube ou de la pale est de 10,8 cm et le
volume de milieu
liquide contenu par le récipient (4) est de 400 mL. Le nombre de puissance Ni'
mesuré de
la roue à aube ou de la pale dans le milieu liquide (5), par la formule (III),
est sensiblement
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
égal à 3,2. L'énergie dissipée par unité de masse 6, calculée, par la formule
(11), est égale
à 6,80.10 J.kg-1. La longueur de Kolmogorov Lx calculée par la formule (I) est
ainsi
égale à 11,0 m.
Aspect chargement d'agent thérapeutique ou d'imagerie
5 .. Le système fluidique (1) pour la production de vésicules extracellulaires
(EV) vise à la
production en grande quantité de vésicules extracellulaires (EV) dans un
récipient (4).
Toutefois, l'invention n'est pas limitée à ce mode de réalisation et permet
également de
charger en grande quantité des agents thérapeutiques et/ou agents d'imagerie
dans les
vésicules extracellulaires (EV) produites selon l'invention. Ainsi, les
cellules en
10 .. suspension (6) et l'au moins un. agent thérapeutique et/ou d'imagerie
sont simultanément
en suspension dans le milieu liquide (5) et mélangés dans le récipient (4).
Alternativement, les cellules en suspension (6) peuvent être ajoutées dans le
milieu
liquide (5) avant ou après l'ajout des agents thérapeutiques et/ou agents
d'imagerie dans
ledit milieu liquide (5). De manière générale, tout type d'agent thérapeutique
ou
15 d'imagerie peut être utilisé, de préférence des agents thérapeutiques
molécules ou
particules pour traiter les maladies infectieuses, inflammatoires,
métaboliques,
dégénératives, traumatiques, post-chirurgicales, génétiques, malignes
(tumeurs),
orphelines, du système vasculaire, lymphatique, locomoteur, digestif, nerveux,
reproducteur, excréteur et/ou des agents (molécules ou particules) d'imagerie
nucléaire,
20 magnétique, optiques, acoustiques. Le récipient (4) comprend également
un agitateur (7)
tel que décrit précédemment et permettant d'agiter le milieu liquide (5)
comprenant les
cellules productrices en suspension (6) et l'au moins un agent thérapeutique
ou
d'imagerie. Préférentiellement, le système fluidique (1) est adapté de manière
à générer
une agitation douce permettant d'homogénéiser les cellules productrices (6)
dans le
25 milieu liquide (5) au sein du récipient (4) et ce afin de charger
efficacement les agents
d'intérêt dans les cellules productrices (6) et par conséquent dans les
vésicules
extracellulaires.
Selon un autre objet, l'invention est un procédé de production ex vivo de
vésicules
extracellulaires à partir de cellules productrices, comprenant :
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
31
- une commande d'un agitateur (7) entraînant un écoulement turbulent d'un
milieu
liquide (5), la longueur de Kolmogorov de l'écoulement étant inférieure ou
égale à
50 pm, préférentiellement inférieure ou égale à 40 pm dans un récipient (4),
le
récipient comprenant une sortie (9), le milieu liquide (5) comprenant des
cellules
productrices (6) en suspension et l'au moins un agent thérapeutique et/ou
d'imagerie,
et
- une collecte du milieu liquide (5) comprenant des vésicules
extracellulaires (EV) en
sortie (9) du récipient (4).
Préférentiellement, le procédé selon l'invention comprend une étape de
chargem.ent d'au
moins un agent thérapeutique et/ou d'imagerie. Plus préférentiellement,
l'étape de
chargement dudit au moins un agent thérapeutique et/ou d'imagerie est
simultanée à
l'étape de production de vésicules extracellulaires. Bien entendu, cette étape
peut
également être préalable à l'étape de production de vésicules
extracellulaires.
Alternativement, l'étape de chargement peut être postérieure à l'étape de
production de
vésicules extracellulaires. Ce mode de réalisation peut être d'intérêt dans le
cas où l'on
souhaite obtenir une 1ère production de vésicules non chargées suivie d'une
21"
production de vésicules extracellulaire chargées dudit au moins un agent
thérapeutique
et/ou d'imagerie, et ce dans le cadre de la mise en place d'un système
fluidique avec une
collecte du milieu liquide (5) en continu. De manière surprenante,
l'écoulement qui
permet aux cellules productrices en suspension (6) de produire des vésicules
extracellulaires permet également et simultanément de charger l'au moins un
agent
thérapeutique et/ou d'imagerie dans les cellules productrices en suspension
(6) et par
conséquent produire lesdites vésicules extracellulaires (EV) dans un récipient
(4) chargé
de l'au moins un agent thérapeutique et/ou. d'imagerie.
De manière préféré, l'invention est un procédé de chargement d'au moins un
agent
thérapeutique et/ou d'imagerie à l'intérieur ou à la membrane de vésicules
extracellulaires
(EV) à partir de cellules productrices (6), comprenant les étapes suivantes :
= ajouter dans un récipient (4), un milieu liquide (5) comprenant des
cellules productrices (6) et au moins un agent thérapeutique et/ou
d'imagerie,
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
32
= actionner une commande d'un agitateur (7) entraînant un. écoulement
turbulent d'un milieu liquide (5), la longueur de Kolmogorov de
l'écoulement étant inférieure ou égale à 50 p.m, préférentiellement
inférieure ou égale à 40 p,m, ledit écoulement permettant de
simultanément charger l'au moins un agent thérapeutique et produire les
vésicules extracellulaires (EV) dans un récipient (4), le récipient
comprenant une sortie (9),
= collecter le milieu liquide (5) comprenant des vésicules extracellulaires
(EV) en sortie (9) du récipient (4).
Préférentiellement les vésicules extracellulaires (EV) en. sortie (9) du
récipient (4)
comprennent un mélange de vésicules extracellulaires chargées d'au moins un
agent
thérapeutique et/ou d'imagerie et de vésicules extracellulaires non chargées
d'au moins
un agent thérapeutique et/ou d'imagerie.
Préparation du milieu de culture, des agents thérapeutiques et/ou agents
d'imagerie et
des cellules productrices
Le récipient (4) peut être à usage unique ou bien stérilisé avant toute
introduction de
milieu liquide (5), de cellules productrices (6) et de l'au moins un agent
thérapeutique ou
agent d'imagerie. L'au moins un agent thérapeutique et/ou agent d'imagerie est
incubé
dans le milieu de culture des cellules productrices (6), comprenant du sérum.,
dans le
récipient (4).
Les cellules productrices (6), avant d'être introduites dans le système
fluidique 1, sont
mises en suspension par un moyen quelconque ou une combinaison de moyens
connus
de l'homme de l'art, par exemple au moyen d'un. milieu comprenant de la
trypsine ou
toute autre enzyme permettant la mise en suspension de cellules adhérentes
connue de
l'homme du métier. Elles peuvent être ensuite centrifugées à 300 G pendant
cinq minutes
pour être concentrées dans le culot d'un tube, de manière à remplacer le
milieu
comprenant de la trypsine par un milieu DMEM. Les cellules productrices (6)
ensuite
sont introduites dans le récipient (4), comprenant du milieu de culture et
selon un mode
de réalisation, alternatif l'au moins un agent thérapeutique et/ou agent
d'imagerie. Les
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
33
cellules productrices (6) et les agents thérapeutique et/ou agents d'imagerie
sont ensuite
agités de manière à mettre en contact les agents thérapeutiques et/ou agents
d'imagerie et
les cellules productrices (6), et favoriser le chargement des agents
thérapeutiques et/ou
agents d'imagerie dans les cellules productrices (6). L'agitation peut
reprendre
.. périodiquement, de manière à favoriser l'homogénéité des cellules
productrices (6) et des
agents thérapeutiques et/ou agents d'imagerie dans le milieu liquide (5). Par
exemple,
l'homogénéisation des éléments présents dans le milieu de culture (5) est
réalisée avec
une faible agitation du milieu de culture (par exemple la rotation d'une roue
à aube à une
vitesse de 20 rpm), ainsi qu'un remplacement régulier du milieu de culture
(par exemple
un remplacement de 5% à 40% du milieu de culture chaque jour, par exem.ple un
remplacement de 5%, 10%, 15%, 20%, 25%, 30%, 35% ou 40% du milieu de culture
chaque jour).
Exemple de production des vésicules extracellulaires (EV) sans chargement
d'agent
thérapeutique et/ou agent d'imagerie
Les vésicules extracellulaires (EV) sont produites dans un récipient (4)
contenant un
milieu liquide (5), par exemple sans sérum, des cellules productrices (6) en
suspension.
Le milieu utilisé avant la production pour la culture des cellules
productrices (6)
comprenant du sérum, on lave trois à quatre fois le récipient (4) avec du
milieu liquide
(5) DMEM sans sérum, chaque lavage correspondant par exemple à un volume
d'environ
400 mL. On commande ensuite l'agitation du milieu liquide (5) par l'agitateur
(7) de
manière à entraîner un. écoulement turbulent dans le récipient (4).
L'agitation est
préférentiellement réglée de manière à commander un écoulement du milieu
liquide (5)
dans lequel la longueur de Kolmogorov Li( est inférieure ou égale à 50 m. et
préférentiellement à 40 m. L'agitation du milieu liquide (5) est commandée au
moins
pendant vingt minutes, préférentiellement pendant plus d'une heure, et
préférentiellement
pendant plus de deux heures, par exemple environ trois heures. La production
de vésicules extracellulaires (EV) peut être mesurée pendant la production. A
cet effet,
l'agitation peut être continue, intermittente, croissante ou décroissante. On
laisse
sédimenter les cellules productrices (6) au fond du récipient (4), puis on
prélève un
échantillon de milieu liquide (5) comprenant des vésicules extracellulaires
EV. On réalise
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
34
une centrifugation de l'échantillon à 2000 G pendant 10 minutes, de manière à
éliminer
les débris cellulaires. Le surnageant est analysé par une méthode de suivi
individuel de
particules (ou NIA, acronyme anglais de Nanoparacle Tracking Analysis) de
manière à
compter le nombre de vésicules extracellulaires (EV) et d'en déduire la
concentration en
vésicules extracellulaires (EV) des échantillons. On peut vérifier que la
concentration en
vésicules extracellulaires (EV) au début de l'agitation est proche de zéro ou
négligeable.
Les vésicules extracellulaires (EV) produites peuvent également être observées
etlou
comptées par cryo-microscopie électronique à transmission. A cet effet, une
goutte de
2,7 de solution comprenant des vésicules extracellulaires (EV) est
déposée sur une
grille adaptée à la cryo-microscopie, puis plongée dans l'éthane liquide,
entraînant une
congélation quasi-instantanée de ladite goutte, évitant la formation de
cristaux de glace.
La grille supportant les vésicules extracellulaires (EV) est introduite dans
le microscope
et les vésicules extracellulaires (EV) sont observées à une température de
l'ordre de
-170 C.
Séparation des vésicules extracellulaires
Les vésicules extracellulaires (EV) produites dans le récipient (4) sont
susceptibles d'être
extraites du récipient (4) par la sortie (9) du récipient (4), suspendues dans
du milieu
liquide (5). Un filtre (18) peut être agencé à la sortie (9) de manière à
filtrer les cellules
productrices (6) en suspension et les débris cellulaires lors de l'extraction
de vésicules
extracellulaires (EV) du récipient (4). Une connectique (13) est fluidiquement
reliée à la
sortie (9), permettant le transport du milieu liquide (5) comprenant les
vésicules
extracellulaires (EV) produites.
Le système fluidique (1) peut comprendre un séparateur (15) de vésicules
extracellulaires
(EV). Le séparateur (15) comprend une entrée du séparateur (10), dans laquelle
le milieu
liquide (5) comprenant des vésicules extracellulaires (EV) issu du récipient
(4) peut être
acheminé de manière directe ou indirecte. Le séparateur (15) peut également
comprendre
une première sortie (11) du séparateur, par laquelle le milieu liquide (5) est
susceptible
de sortir du séparateur (15) avec une concentration en vésicules
extracellulaires (EV) plus
petite qu'en entrée (10) du séparateur (15), voire sensiblement nulle. Le
séparateur (15)
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
peut également comprendre une deuxième sortie (12) du séparateur (15), par
laquelle le
milieu liquide (5) est susceptible de sortir du séparateur (15) avec une
concentration en
vésicules extracellulaires (EV) plus élevée qu'en entrée (10) du séparateur
(15).
De manière générale, le séparateur (15) de vésicules extracellulaires (EV)
peut être relié
5 fluidiquement au récipient (4) de manière à être susceptible de
réintroduire un milieu
liquide (5) appauvri en vésicules (EV) dans le récipient (4), par exemple par
l'entrée (8)
du récipient (4). Ainsi, la production et/ou l'extraction de vésicules
extracellulaires (EV)
peu(ven)t être réalisée(s) de manière continue, à volume de milieu liquide (5)
sensiblement constant dans le récipient (4). Selon un mode de réalisation
alternatif, le
10 système fluidique ne comprend pas de séparateur (15) de vésicules
extracellulaires (EV)
ou le système fluidique comprend un séparateur (15) de vésicules
extracellulaires (EV)
pouvant être relié fluidiquement ou non, par exemple par l'intermédiaire d'un
moyen de
fermeture dudit séparateur (15), au récipient (4). Ainsi, la production. et/ou
l'extraction. de
vésicules extracellulaires (EV) peu(ven)t être réalisée(s) de manière
discontinue ou
15 continue en fonction de l'ouverture ou fermeture du moyen de fermeture
disposé en amont
du séparateur (15).
Dans le cas d'un fonctionnement en discontinu, le récipient contenant les
cellules
productrices est agité et la durée de production est choisie de préférence
pour un temps
(Tv) supérieur à 20 minutes.
20 Le liquide peut ensuite être extrait du récipient, et peut être soumis à
une ou plusieurs
étapes de purification ultérieures, pour notamment séparer les vésicules des
cellules
productrices. Cette séparation peut être réalisée au moyen de techniques
connues de
l'homme de l'art, par exemple et pris de façon non limitative, par des
techniques
acoustiques, des méthodes de filtration telle la séparation par filtration
tangentielle,
25 l'utilisation de filtres rotatifs ou des combinaisons quelconques de
moyens de séparation.
Dans le cas d'un fonctionnement en continu et selon un mode de réalisation
préféré, le
système de séparation est interne au récipient, les vésicules sont séparées
progressivement
dans un sous-compartiment du récipient. Divers moyens techniques sont connus
de
l'homme de l'art pour réaliser ce type de séparation, par exemple et de façon
non
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
36
limitative, l'utilisation de filtres rotatifs, ou encore de moyens
acoustiques, ou des
combinaisons quelconques de moyens de séparation. Selon un autre mode de
réalisation,
le système de séparation entre cellules et vésicules peut faire intervenir un
circuit
fluidique conçu pour faire circuler le milieu avec les cellules productrices
et les vésicules
entre le récipient d'une part et un système de séparation extérieur au
récipient d'autre
part. Ce système de séparation extérieur au récipient peut faire intervenir
des techniques
connues de l'homme de l'art, par exemple, et de façon non-limitative, de la
filtration
tangentielle, ou de la séparation acoustique, ou encore des combinaisons
quelconques de
moyens de séparation connus. A la sortie du système de séparation, le liquide
appauvri
en vésicules est réinjecté dans le récipient, de façon à ce que la production
de vésicules
par les cellules productrices puisse continuer dans le récipient.
Dans l'exemple de réalisation d'un système fluidique (1) illustré dans la
figure 1, le milieu
liquide (5) peut être extrait du récipient (4) par une première pompe (16),
via une
connectique (13), de manière à transporter le milieu liquide (5) dans un
collecteur (19).
Une autre première pompe (16') permet d'acheminer le milieu liquide (5)
contenu dans
le collecteur (19) à l'entrée (10) du séparateur (15), via une autre
connectique. La
première sortie (11) du séparateur (15) est reliée au récipient (4) via une
connectique, de
manière à réintroduire du milieu liquide (5) appauvri en vésicules
extracellulaires (EV)
dans le récipient (4). La deuxième sortie (12) du séparateur (15) est reliée
au collecteur
(19) vi.a une connectique, de manière à enrichir le milieu liquide (5) contenu
dans le
collecteur (19) en vésicules extracellulaires (EV). Dans une variante,
l'entrée (10) du
séparateur (15) peut être directement reliée à la sortie (9) du récipient (4)
(ou par
l'intermédiaire d'une première pompe (16)). La première sortie (11) du
séparateur (15)
est reliée au récipient (4) et la deuxième sortie (12) du séparateur (15) est
reliée au
collecteur (19). Plusieurs séparateurs peuvent également être disposés en
série pour faire
varier le degré de séparation en vésicules extracellulaires (EV) dans le
milieu liquide (5),
et/ou en parallèle pour adapter le débit de milieu liquide (5) dans chaque
séparateur (15)
au débit d'une première pompe (16).
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
37
Influence de l'agitation sur la production des vésicules extracellulaires (EV)
Dans les figures qui suivent, différents types de cellules productrices sont
utilisés. Avant
leur utilisation pour la production de vésicules extracellulaires, ces
cellules productrices
sont mises en culture, à l'exception des globules rouges dont la préparation
avant leur
utilisation pour la production de vésicules extracellulaires consiste en
l'obtention d'une
suspension de globules rouges lavés à la concentration souhaitée dans du DMEM
sans
rouge de phénol.
Les cellules THP-1, issues d'une lignée humaine de monocytes, sont cultivées
dans du
milieu de culture ICA: (Roswell Park Memorial :Institute medium) à une
concentration
de 2.105 à 1.106 cellules par millilitre de milieu de culture, à 37 C et sous
une atmosphère
comprenant 5% de CO2. Le milieu de culture RPMI contient 10% en volume de
sérum
bovin foetal et 1% en volume de pénicilline/streptomycine, les volumes étant
exprimés
par rapport au volume total du milieu de culture RPMI. Elles sont passées tous
les 3 à
5 jours en les diluant d'un facteur 5 dans du milieu neuf.
Les cellules de Raji, une lignée humaine de cellules d'origine hématopoïétique
dérivées
de lymphocytes B, sont cultivées dans du milieu de culture RPMI contenant 10%
en
volume de sérum bovin foetal et 1% en volume de pénicilline/streptomycine, les
volumes
étant exprimés par rapport au volume total du milieu de culture RPMI. Elles
sont passées
tous les 3 à 4 jours en les diluant d'un facteur de 10 à 20 dans du milieu
neuf.
Les cellules C3H/10T1/2 sont des cellules mésenchymateuses multipotentes
issues des
cellules embryonnaires de souris CH3, qui sont adhérentes. Elles sont
cultivées dans du
DMEM avec 10% en volume de sérum bovin foetal et 1% en volume de
pénicilline/streptomycine, les volumes étant exprimés par rapport au volume
total du
milieu de culture DMEM. Elles sont passées tous les 3 à 5 jours en les diluant
d'un facteur
entre 2 et 10.
Les cellules HeLa sont une lignée de cellules issues d'un cancer du col de
l'utérus. Elles
sont cultivées dans du DMEM avec 10% en volume de sérum bovin foetal et 1% en
volume de pénicilline/streptomycine, les volumes étant exprimés par rapport au
volume
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
38
total du milieu de culture DMEM. Initialement adhérentes, ces cellules HeLa
sont
détachées avec de la trypsine puis mises en suspension dans un bioréacteur
agité à
50 RPM, et cultivées à une concentration comprise entre 105/mL et 106/mL.
Avant d'utiliser les cellules productrices pour la production de vésicules
extracellulaires,
les cellules qui ont été mises en culture sont lavées puis re-suspendues dans
du DMEM
blanc, avec 1% en volume de pénicilline/streptomycine par rapport au volume du
milieu
DMEM, dans le contenant dans lequel la production de vésicules
extracellulaires aura
lieu (flasque, flasque à agitation ou bioréacteur, de préférence conformes aux
normes
G.:M. P).
La figure 2 illustre le nombre de vésicules extracellulaires produites par des
cellules THP1
dans un système fluidique (1) pour différentes agitations commandées par
l'agitateur (7).
L'ordonnée correspond aux nombres de vésicules extracellulaires (EV) produites
par
cellule dans le récipient (4). Chaque colonne correspond à une production de
vésicules
extracellulaires (EV) pour différentes vitesses de rotation de l'agitateur (7)
dans le
récipient (4). Les vésicules extracellulaires (EV) sont produites à partir de
cellules
productrices (6) de type TFEP1 dans le récipient (4) en utilisant une
concentration de
100 000 000 de cellules en suspension (6) dans 400 niL de milieu liquide (5)
dans une
flasque à agitation (spinner flask en anglais) de 1000 ml. Une production
significativement élevée de vésicules extracellulaires (EV) est observable en
commandant un écoulement de milieu liquide (5) dans lequel la production
correspond à
la colonne 300 RPM soit une longueur LK égale ou inférieure à 17 um par
rapport à la
production en vésicules extracellulaires (EV) dans des conditions d'agitation
plus faible
dans lequel la vitesse d'agitation est de 200 RPM soit une longueur LK égale à
23 pm. De
plus, dans des conditions d'agitation encore plus importantes, à savoir
respectivement
400 RPM et 515 RPM, correspondant à l'obtention de longueurs LK égales
respectivement à 13,8 um et 11,4 pm, la production de vésicules
extracellulaires par
cellule productrice augmente encore, de façon inversement proportionnelle à la
longueur
LK. Cela illustre que plus l'agitation est importante, plus les cellules
productrices
produisent des vésicules extracellulaires.
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
39
La figure 3 illustre le nombre de vésicules extracellulaires produites par des
cellules
productrices (6) de type THP-1 pour différentes agitations commandées par
l'agitateur
(7) dans un système fluidique (1) dont le récipient (4) et la quantité de
milieu liquide (5)
sont différents de ceux utilisés dans le cadre de l'expérience de la figure 2,
et sur une
durée d'agitation plus longue à savoir 3 heures au lieu de 20 minutes. Dans
une flasque à
agitation de 0,1 L comprenant 50 mL de milieu liquide (5), 3553 vésicules
extracellulaires
sont produites par cellule productrice en trois heures sous une agitation de
250 RPM
réalisée par une pale de 3,8 cm de diamètre, la longueur de Kolmogorov LK
étant égale à
41 m. Dans une flasque à agitation de 0,1 L comprenant 50 mL de milieu
liquide (5),
environ 17 400 vésicules extracellulaires sont produites par cellule
productrice en trois
heures sous une agitation de 300 RPM réalisée par une pale de 3,8 cm de
diamètre, la
longueur de Kolmogorov LK étant égale à 35 m. Dans une flasque à agitation de
0,1 L
comprenant 50 mL de milieu liquide (5), entre 30 000 et 40 000 vésicules
extracellulaires
sont produites par cellule productrice en trois heures sous une agitation de
500 RPM
réalisée par une pale de 3,8 cm de diamètre, la longueur de Kolmogorov Li(
étant égale à
24 m. Un essai contrôle correspondant à l'utilisation d'une flasque à
agitation de 0,1 L
comprenant 50 mL de milieu liquide (5), sous une agitation de 34 RPM réalisée
par une
pale de 3,8 cm de diamètre, la longueur de Kolmogorov LK étant égale à 181 lm,
conduit
à la production d'environ 1 400 vésicules extracellulaires par cellule
productrice en trois
heures.
Les résultats des figures 2 et 3 illustrent que, quel que soit le type de
récipient (4), lorsque
la longueur de Kol.mogorov obtenue par agitation du milieu liquide (5) est
comprise entre
5 et 50 m, de préférence entre 10 gm et 41 gm, par exemple 11,4 m, 13,8 gm,
17 ;lm,
23 pin, 24 pin, 35 tm et 41 ;lm, des vésicules extracellulaires sont produites
par les
cellules productrices en suspension dans le milieu liquide (5). De plus, plus
la longueur
de Kolmogorov diminue, plus il y a augmentation du nombre de vésicules
extracellulaires
produites par cellule productrice.
La figure 4 illustre le nombre de vésicules extracellulaires (EV) produites
dans un. système
fluidique (1) pour différentes longueurs de Kolmogorov commandées par
l'agitateur (7).
Les vésicules extracellulaires (EV) sont produites à partir de cellules
productrices (6) de
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
type THP1 dans le récipient (4) en utilisant une concentration de 100 000 000
de cellules
en suspension (6) dans 400 mi: de milieu liquide (5) dans une spinner flask de
1000 ml.
L'abscisse correspond à la longueur LK entraînée par l'agitateur (7) pendant
la production
de vésicules extracellulaires (EV), calculée par les formules (I), (II) et
(III). Une
5 production significativement élevée de vésicules extracellulaires (EV)
est observable en
commandant un écoulement de milieu liquide (5) dans lequel la longueur LK est
inférieure
à 17 m. par rapport à la production en vésicules extracellulaires (EV) dans
des conditions
d'agitation plus faible. Le rendement de production de vésicules
extracellulaires (EV) par
cellule productrice est plus important lorsque la longueur LK est inférieure
ou égale à
10 .. 50 gm par rapport à des longueurs iLK plus grandes, notamment
supérieures à 100 m.
La figure 5 illustre le nombre de vésicules extracellulaires produites par
cellule en
fonction du temps, par des cellules productrices (6) de type THP-1 humaines
dans un
système fluidique en commandant l'écoulement du milieu liquide (5) à des
agitations 200
RPM et 300 RPM. Les conditions utilisées sont 100 000 000 cellules dans 400 mL
dans
15 une spi.nner fiask de 1000 ml.õ avec une pale de diamètre 10,8 cm. Les
longueurs Lk
calculées par les formules (I), (II) et (III) sont respectivement de 23 m
(pour 300 RPM)
et 17 pm (pour 400 RPM). Le nombre de vésicules extracellulaires (EV)
produites est
bien supérieur pour un écoulement caractérisé par une longueur Lk de 17 itm
que par une
longueur Lk de 23 m.
20 La figure 6 illustre le nombre de vésicules extracellulaires produites par
des cellules
productrices C3F1/10T1/2 (cellules souches mésenchymateuses issues de souris)
dans mi
système fluidique pour différentes longueurs de Kolmogorov commandées par
l'agitateur
(7). Une concentration de 100 000 000 cellules productrices (6) dans 400 mL de
milieu
liquide (5) dans une spinner flask de 1000 mL a été utilisée. L'abscisse
correspond à la
25 .. longueur LK entraînée par l'agitateur (7) pendant la production de
vésicules
extracellulaires EV, calculée par les formules (I), (II) et (III). La
production de vésicules
par cellule augmente de façon importante en commandant un écoulement de milieu
liquide (5) dans lequel la longueur LK est de 17 m. par rapport à la
production en
vésicules extracellulaires (EV) dans des conditions d'agitation plus faible.
Le rendement
30 de production de vésicules extracellulaires (EV) par cellule productrice
est plus important
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
41
lorsque la longueur LK est inférieure ou égale à 50 gm par rapport à des
longueurs LK plus
grandes, notamment supérieures à 100 m à partir de laquelle un plateau du
rendement
EV/cellule est atteint.
La figure 7 illustre premièrement le nombre de vésicules produites en trois
heures par des
cellules productrices (6) de type Raji d'une part selon la méthode de l'art
antérieur de
carence 2D 72h et d'autre part dans un systèrne fluidique (1) dont le
récipient (4) est une
flasque à agitation d'une contenance de 100 mL, le milieu liquide (5) est de
50 mL, le
diamètre de la pale est de 3,8 cm, l'agitation est de 500 RPM et la longueur
de
Kolmogorov LK est de 24 gm. Deuxièmement, cette figure illustre le nombre de
vésicules
extracellulaires produites en trois heures par des cellules productrices (6)
de type HeLa
d'une part selon la m.éthode de l'art antérieur de carence 3D 72h et d'autre
part dans un
système fluidique (1) dont le récipient (4) est une flasque à agitation d'une
contenance de
100 mL, le milieu liquide (5) est de 50 mlõ le diamètre de la pale est de 3,8
cm, l'agitation
est de 250 RPM et la longueur de Kolmogorov LK est de 41 m.
Cette figure illustre qu'une production de vésicules extracellulaires dans un
système
fluidique selon la présente invention et selon le procédé selon la présente
invention,
permet une production de vésicules extracellulaires en bien plus grande
quantité et en
moins de temps que l'art antérieur. De plus, cette figure illustre que tout
type de cellules
productrices peut être utilisé pour produire des vésicules extracellulaires
dans un système
fluidique selon la présente invention et selon le procédé selon la présente
invention.
La figure 8a) illustre le nombre de cellules productrices du type Raji viables
en suspension
au cours du temps, soit après 72 heures en flasques classiques dans le milieu
liquide (5)
sans agitation (conditions appelées carence 2D ou carence 2D 72h dans la
présente
demande), soit après 3 heures en présence d'une agitation turbulente dans un
système
fluidique selon l'invention. Le système fluidique selon l'invention qui est
utilisé dans
cette figure est une flasque à agitation de 100 mL comprenant un milieu
liquide (5) de
50 mL, un diamètre de la pale de 3,8 cm, une agitation de 500 RPM et une
longueur de
Kolmogorov LK de 24 iLtm. Un essai contrôle est réalisé et correspond à une
flasque à
agitation de 100 mL comprenant un milieu liquide (5) de 50 mL, un diamètre de
la pale
de 3,8 cm, une agitation de 34 RPM et une longueur de Kolmogorov LK de 181 m.
Les
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
42
concentrations et viabilités cellulaires sont mesurées au NucleoCountee (NC-
2001m
commercialisé par l'entreprise Chemometec) aux temps t=Oh et soit t=3h soit
t=72h.
Les résultats obtenus démontrent que le nombre de cellules productrices ne
diminue pas
significativement au cours de l'agitation turbulente selon l'invention, les
cellules
productrices résistent aux contraintes de cisaillement.
La figure 8b) illustre le pourcentage d'adénylate kinase dans le surnageant
entre l'essai
contrôle, l'essai en carence 2D 72h et l'essai selon l'invention. L'adénylate
kinase est
dosée dans le surnageant aux temps t=Oh et soit t=3h soit t=72h pour mesurer
l'intégrité
des membranes grâce au ToxiLight Assay kit commercialisé par l'entreprise
Lanza ; le
contrôle positif (100% de lyse) est réalisé avec 0,3% en volume de Triton X-
100 par
rapport au volume du milieu liquide du contrôle.
Il apparait que la concentration d'adénylate kinase dans le surnageant ne
varie pas
significativement entre les différents essais, ce qui démontre l'absence
d'endommagement des cellules et notamment le maintien de l'intégrité de leurs
membranes cellulaires malgré le cisaillement.
De plus, la figure 9 illustre l'aspect des cellules productrices de type R.aji
entre après
3 heures dans l'essai contrôle et après 3 heures dans le système fluidique
selon l'invention
(les essais contrôle et selon l'invention sont les mêmes que ceux en figure
8), par
observation au microscope optique à un grossissement x4. Ces images illustrent
le fait
que même après l'action de la turbulence, il y a peu voire pas d'endommagement
des
cellules productrices, maintien de l'intégrité des cellules et identité de
leur aspect avec
les cellules de l'essai contrôle.
La figure 10 illustre le nombre de vésicules extracellulaires produites par
des cellules
TFIP-1 humaines en flasques classiques dans le milieu liquide (5) sans
agitation pendant
72 h (appelé carence 2D 72h), et dans un système fluidique en commandant un
écoulement du milieu liquide (5) dans lequel la longueur Li( est supérieure à
200 1.1m
(appelé carence 3D). Ces conditions sont les conditions classiques de
production de
vésicules extracellulaires EV. La production de vésicules extracellulaires
(EV) par
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
43
cellules dans ces différentes conditions est significativement inférieure à la
production
dans un écoulement où la longueur Lk est inférieure à 17 pm.
La figure 11 illustre la distribution de taille des vésicules
extracellulaires, produites à
partir de cellules productrices TI-1P-1, HeLa ou de Raji, en conditions de
carence ou de
.. turbulence par agitation à une vitesse de 500 RPM. Pour établir ces
distributions, les
surnageants des différents essais sont prélevés de manière homogène et
centrifugés 5 min
à 2000 g, puis la concentration en vésicules et la distribution en taille des
particules sont
mesurées par Nanoparticle Tracking Analysis (sur l'appareil NanoSight NS300
commercialisé par l'entreprise Malvern Panal.ytical). Ces résultats illustrent
que les
diamètres moyens et médians des vésicules extracellulaires produites selon
l'invention
sont similaires à la fois entre eux et avec ceux des vésicules
extracellulaires produites
selon les méthodes de l'art antérieur (carence).
Les figures 12 et 13 qui suivent correspondent aux résultats d'analyse de la
distribution
en taille de vésicules extracellulaires et des marqueurs membranaires de
vésicules
extracellulaires. Ces analyses sont effectuées grâce à l'appareil ExoViewTM
R100
commercialisé par l'entreprise NanoView Bioscience. Les vésicules
extracellulaires sont
incubées sur une puce contenant des spots marqués avec différents anticorps
(anti-CD81,
anti-CD9, anti-CD63) ; après lavage, des anticorps secondaires anti-CD81 Alexa
Fluor 555, anti-CD9 Alexa Fluor 647 et anti-CD63 Alexa Fluor 488 sont
ajoutés.
Le recueil des images de fluorescence et d'interférométrie permettent
d'obtenir les
mesures des tailles et concentrations des vésicules extracellulaires dans le
milieu liquide.
La figure 12 illustre la distribution en taille de vésicules extracellulaires
produites selon
l'invention durant 3 heures (turbulence) ou selon la méthode de carence 3D
durant
72 heures, dans les deux cas à partir de cellules productrices du type THP1.
Les vésicules
extracellulaires produites selon l'invention sont produites à partir de
cellules productrices
de type THP1 dans une flasque à agitation de 100 mL, un milieu liquide (5) de
50 mL,
une vitesse d'agitation de 500 RPM, une longueur de Kol.mogorov Lk de 24 gm et
un
diamètre de la pale de 3,8 cm. Les vésicules extracellulaires produites selon
la méthode
de carence 3D 72 h sont produites à partir de cellules productrices de type
THP1 dans une
.. fiasque à agitation de 100 mL, un milieu liquide de 50 mL, une vitesse
d'agitation de
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
44
34 RPM, une longueur de Kol.mogorov Lk de 181 i.tm et un diamètre de la pale
de 3,8 cm.
Les résultats donnent des valeurs de diamètres moyens des vésicules
extracellulaires
inférieurs à ceux donnés dans la figure 11, car la méthode d'analyse n'est pas
la même
(mesure par NTA dans la figure 11, qui ne permet pas la détection des
vésicules
extracellulaires de petite taille, contre mesure par l'ExoViewTM R.100 dans la
figure 12).
Les résultats obtenus dans la figure 12 par l'ExoViewTM R100 concernent
l'analyse des
vésicules qui s'attachent à des anticorps de capture anti. CD9, CD63 et CD81.
Les résultats obtenus sont les suivants :
[Table 1]
Marqueurs membranaires Diamètre moyen des vésicules extracellulaires
produites en fonction des conditions
Carence 3D Turbulence (Lk = 24 1.1m)
CD81 62,6 nm 63,6 mn
CD63 59,0 nm 59,8 mn
CD9 59,9 nm 60,9 nrn
Ces résultats illustrent d'une part que les diamètres moyens des vésicules
extracellulaires
produites selon l'invention ou selon la méthode de carence 3D sont identiques
et d'autre
part que la distribution des marqueurs de membrane n'est pas la même en
fonction de la
méthode de production des vésicules extracellulaires (c'est-à-dire selon
l'invention ou
selon la méthode de carence 3D).
La figure 13 illustre l'analyse des marqueurs membranaires de deux types de
vésicules
extracellulaires:
- des vésicules extracellulaires produites à partir de cellules productrices
du type
THP-1 dans une flasque à agitation de 100 mL, un milieu liquide (5) de 50 mL,
mie vitesse
d'agitation de 500 RPM et une longueur de Kolmogorov de 24 itm, durant 3
heures ; et
- des vésicules extracellulaires produites à partir de cellules productrices
du type
en carence 3D 72h.
Les deux types de vésicules extracellulaires sont analysés avec l'ExoViewTm
R100 de la
manière suivante : les vésicules sont capturées par des anticorps (anti-CD9,
anti-CD63,
anti-CD81.) sur une puce, où les spots de chaque anticorps sont séparés. Puis,
les vésicules
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
capturées sont incubées avec un anticorps secondaire (anti-CD9, anti-CD63,
anti-CD81
également) associé à un fluorophore, ce qui permet de faire de la
colocalisation de ces
marqueurs. Sur le graphique, les anticorps de capture sont représentés sur
l'axe des
abscisses tandis que les trois différentes colonnes par point d'abscisse
représentent les
5 anticorps secondaires fluorescents. Ainsi, pour l'anticorps de capture
CD81, toutes les
vésicules capturées devraient être marquées par le fluorophore Alexa Fluor
555, sauf
s'il n'y a plus d'épitope disponible.
Les résultats montrent d'une part que les marqueurs membranaires typiques de
vésicules
extracellulaires, à savoir CD81 et CD63 essentiellement, sont présents sur les
vésicules
10 extracellulaires produites en présence d'une longueur de Kolmogorov de
24 m. Cela
démontre que les particules produites par le procédé selon l'invention sont
bien des
vésicules extracellulaires, et qu'elles disposent des marqueurs spécifiques de
leurs
cellules productrices mères.
D'autre part, ces résultats montrent que pour les vésicules produites à 500
RPM, il y a le
15 même nombre de particules marquées par les fluorophores en CD81 et en CD63
sur
l'anticorps de capture CD81, et à peu près la moitié des vésicules capturées
par l'anticorps
de capture CD63 sont marquées par fluorescence en CD81. III ya donc présence
de ces
deux marqueurs membranaires CD63 et CD81 sur les vésicules extracellulaires
produites
en présence d'une longueur de Kolmogorov de 24 m. On retrouve la même
tendance de
20 présence et de colocalisation significative des deux marqueurs
membranaires CD63 et
CD81 sur les vésicules extracellulaires produites en carence 3D, mais les
distributions
relatives diffèrent de celles des vésicules extracellulaires produites en
présence d'une
longueur de Kolmogorov de 24 p.m.
La figure 14 illustre le nombre de vésicules extracellulaires produites par
des globules
25 rouges après 2 heures d'agitation pour différentes longueurs de Kolmogorov.
Le
décompte des vésicules extracellulaires, après 2 heures d'agitation
(conditions selon
l'invention : BR. 500mL et BR 1L) ou 2 heures de maintien sans agitation
(condition
contrôle), est réalisé par prélèvement homogène des surnageants (avant
expérience et
après expérience) puis centrifugation de ces surnageants pendant 5 minutes à
2000G, puis
30 mesure de la concentration en vésicules par Nanoparticle Tracking
Analysis (NanoSight
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
46
NS300, M:alvern Panalytical). Le détail des conditions opératoires et les
résultats sont
présentés ci-après.
Dans une flasque à agitation d'une contenance de 500 mL et possédant une pale
d'un
diamètre de 7,6 cm., 1,5.10' globules rouges sont introduits dans 150 mi, de
DMEM
blanc. Une agitation est réalisée à 350 RPM pendant 2 heures, la longueur de
Kolmogorov
LK étant de 18,6 gm. Un contrôle est réalisé dans un tube à bouchon vissant,
en utilisant
5,1.10' globules rouges dans 50 mL de DMEM blanc, ce tube contrôle étant
maintenu
fixe et n'étant pas agité. Les résultats (colonnes de résultats BR 500 mL ¨ TO
et BR
500 mL T2h) illustrent qu'une agitation de globules rouges à une
longueur de
Kolmogorov inférieure à 50 um telle que 18,6 um engendre la production de
vésicules
extracellulaires par ces globules rouges selon un rendement de 10,4 vésicules
extracellulaires par globule rouge.
Dans une flasque à agitation d'une contenance de 1 L et possédant une pale
d'un diamètre
de 10,8 cm, 1,05.1011 globules rouges sont introduits dans 300 mlõ de DMEM
blanc. Une
agitation est réalisée à 500 RPM pendant 2 heures, la longueur de Kolmogorov
LK étant
de 10,9 m. Un contrôle est réalisé dans un tube à bouchon vissant, en
utilisant 1,15.10'
globules rouges dans 50 mL de DMEM blanc, ce tube contrôle étant maintenu fixe
et
n'étant pas agité. Les résultats (colonnes de résultats BR IL ¨ TO et BR IL ¨
T2h)
illustrent qu'une agitation de globules rouges à une longueur de Kolmogorov
inférieure à
50 m telle que 10,9 um engendre la production de vésicules extracellulaires
par ces
globules rouges selon un rendement d'environ 100 vésicules extracellulaires
par globule
rouge.
Ainsi, plus la vitesse d'agitation augmente et la longueur de Kolmogorov
diminue, plus
la quantité de vésicules extracellulaires produites par globule rouge
augmente.
La figure 15 illustre le chargement de vésicules extracellulaires en
doxorubicine en
présence d'une agitation turbulente.
Des cellules THP-1 sont lavées puis re-suspendues dans du RPMI dans lequel a
été ajouté
I% en volume de pénicilline/streptomycine et 10 M de doxonlicine (Merck). Les
cellules THP-1 sont introduites dans une flasque à agitation dont le milieu
liquide est de
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
47
50 mL, la concentration en cellules THP-1 dans la flasque à agitation étant de
cellules/mL de milieu liquide. Les cellules THP-1 sont agitées pendant 2
heures
soit à 400 RPM, la longueur de Kolmogorov étant de 28 Itin (condition
d'internalisation
de la doxorubicine). Soit à 34 RPM, la longueur de Kolmogorov étant de 181
(condition contrôle = passif) ; les cellules TFIP-1 sont ensuite lavées puis à
nouveau
agitées dans les mêmes conditions que précédemment à 400 RPM et longueur de
Kolmogorov de 28 jim, dans du RPMI comprenant en outre 1% en volum.e de
pénicilline/streptomycine. Les échantillons (comprenant les cellules THP-1 et
les
vésicules extracellulaires produites) sont ensuite centrifugés 5 minutes à
2000G. Le
surnageant est ultracentriftigé 1h30 à 150 000G, puis les culots de vésicules
sont re-
suspendus dans du PBS (phosphate buffered saline, tampon phosphate salin), et
lysés
avec 0,3% de Triton X-100. La fluorescence est mesurée avec un
spectrophotomètre à
fluorescence Hitachi F7000 (longueur d'onde d'excitation : 485nm, longueur
d'onde
d'émission : 560nm.).
Les résultats illustrent que pour un nombre de cellules de départ égal, la
quantité de
doxorubicine mesurée dans les vésicules extracellulaires après chargement et
production
par turbulence (condition turbulence) est bien plus élevée qu'après un
chargement sans
turbulence suivie d'une production en turbulence (condition contrôle = passif)
: le
chargement en doxorubicine passe de 0,08 nmol pour la fraction contenant les
vésicules
extracellulaires en condition contrôle (=passif) à 0,78 nmol pour la fraction
contenant les
vésicules extracellulaires en condition de turbulence.
Par ailleurs, un ratio appelé pureté a été déterminé ; il s'agit du ratio de
la concentration
en vésicules extracellulaires mesurée par NTA par la concentration en
protéines
(en gg/mL). La mesure par NTA de la concentration en vésicules
extracellulaires est
réalisée grâce au protocole suivant :
- prélèvement homogène du surnageant du milieu liquide des différentes
conditions de production de vésicules extracellulaires à partir de cellules
productrices de
type THP-1 : milieu liquide des conditions de carence 2D 72h, milieu liquide
de carence
3D 72h, milieu liquide après 3 heures d'agitation à 250 RPM, milieu liquide
après
3 heures d'agitation à 500 RPM ; puis
CA 03124605 2021-06-22
WO 2020/136362 PCT/FR2019/053309
48
- centrifugation pendant 5 minutes à 2000 G ; puis
- mesure de la concentration en vésicules extracellulaires et de leur
distribution en
taille par Nanoparticle Tracking Analysis (sur l'appareil NanoSight NS300
commercialisé par l'entreprise Malvem Panalytical).
La mesure de la concentration en protéines est réalisée par le test de
Bradford
(ThermoFisher S cientific).
La mesure de la concentration en protéines se faisant sans lyser les
vésicules, on considère
que le ratio de la concentration en vésicules extracellulaires par la
concentration en
protéines (¨pureté) est une indication des contaminants présents dans
l'échantillon. Les
résultats sont les suivants
[Table 2]
Carence 2D Carence 3D 250 RPM 500 RPM
THP-1 4,83.108 9,928.108 3,67.108 1, .-
109
HeLa N/A .2,71.108 6,74.108 6,55.108
Ces résultats démontrent que les échantillons de vésicules extracellulaires
produites selon
l'invention présentent une pureté similaire à celle des échantillons de
vésicules
extracellulaires produites en carence 2D et 3D. Cela illustre que le procédé
de production
de vésicules extracellulaires selon la présente invention permet une
augmentation de la
quantité de vésicules extracellulaires produites et du rendement de production
des
vésicules extracellulaires, tout en maintenant le niveau de pureté par rapport
aux
méthodes de l'art antérieur.