Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
1
MOTIF DE LA. PROTEINE SECLIN
INTERAG[SSANT AVEC LES MEMBRES ANTI APOPTQTIQUES DE LA
FAMILLE DE PROTEINES BCL-2, ET UTILISATIONS
La présente invention s'inscrit dans le cadre de la recherche et de la mise
au point de nouveaux agents utiles pour réguler la mort cellulaire
programmée de type apoptose et/ou autophagie lors du traitement de
patients atteints de cancers.
L'invention concerne une nouvelle méthode d'identification de modulateurs
de la mort cellulaire programmée comprenant l'interaction entre un motif de
la protéine Beclin et un membre anti-apoptotique de la famille de protéines
Bcl-2 ainsi que la détection de cette interaction par polarisation de
fluorescence. Les modulateurs identifiés à partir de la méthode décrite
supra sont administrés aux patients atteints de cancers afin d'induire de la
mort cellulaire programmée de type apoptotique et/ou autophagique chez
ces derniers.
L'invention concerne en particulier un motif de la protéine Beclin capable
d'interagir avec un membre anti-apoptotique de la famille de protéines Bcl-2
et son utilisation pour induire de la mort cellulaire programmée chez les
patients atteints de cancers.
La mort cellulaire programmée est composée, d'une part de l'apoptose et,
d'autre part de la mort autophagique. L'apoptose est le phénomène le
mieux connu. Ce type de mort cellulaire fait intervenir des changements
morphologiques, tels que la condensation du noyau, la fragmentation de
l'ADN, ainsi que des phénomènes biochimiques, tels que l'activation des
caspases qui vont dégrader des composants structuraux clés de la cellule
pour induire son désassemblage et sa mort. La régulation du processus
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
2
d'apoptose est complexe et implique l'activation ou la répression de
plusieurs voies de signalisation intracellulaire.
La mort autophagique est un deuxième mécanisme moins connu de la mort
cellulaire programmée. Sur le plan cellulaire, l'autophagie peut se résumer
en trois étapes : la formation d'une vacuole autophagique initiale
(autophagosome) et la maturation de l'autophagosome en vacuole
dégradative puis sa fusion avec le lysosome. La mort autophagique fait
donc intervenir des processus de dégradation lysosomale, caractérisés par
l'accumulation de vacuoles autophagiques, indépendants d'une voie de
io régulation de type caspase.
La dérégulation de l'équilibre cellulaire existant entre la croissance, la
survie et la mort cellulaire programmée est à l'origine de nombreuses
pathologies, telles que les cancers.
Conformément à l'acception usuelle dans le cadre de l'invention, le
cancer se définit par deux caractéristiques principales : la croissance et
la prolifération cellulaire non régulées par des signaux externes et la
capacité d'envahir les tissus ainsi que, le cas échéant, la capacité de
former des métastases en colonisant des sites à distance.
Ces caractéristiques sont la conséquence des propriétés intrinsèques des
cellules cancéreuses, c'est-à-dire de leur instabilité caryotypique et
génomique, de leur prolifération incontrôlée, de leur pouvoir métastasique
s'accompagnant de l'acquisition de nouveaux phénotypes ainsi que de
l'activation et de la dérépression d'oncogènes dans lesdites cellules
cancéreuses. On entend donc par cancer dans le cadre de la présente
invention toute phase de la croissance ou de la prolifération cellulaire ayant
les caractéristiques ci-dessus, évoluant notamment vers le développement
de tumeurs primaires et/ou de tumeurs métastasiques (tumeurs
secondaires).
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
3
Maintenir une cellule en vie ou programmer sa mort nécessite la régulation
d'une voie de signalisation majeure impliquant en particulier les protéines
de la famille Bcl-2.
Les protéines de la famille Bcl-2 sont divisées en trois classes principales.
Les protéines anti-apoptotiques, telles que Bcl-2, Bci-XL et Bcl-W,
présentent une forte homologie au niveau de leurs quatre domaines BH.
Les protéines pro-apoptotiques sont divisées en deux catégories : d'une
part, les protéines multidomaines telles que BAX et BAK et, d'autre part, les
protéines pro-apoptotiques telles que BID, NOXA, PUMA, BIK, BIM et BAD
se caractérisant par la présence d'un seul domaine d'homologie, le motif
BH3 (Cory and Adams, The Bcl-2 family : regulators of the cellular life-or-
death switch Nature reviews vol.2 september 2002).
Le motif BH3 est une région a hélicoïdale amphiphile dont l'homologie de
séquences est relativement faible dans la famille de protéines Bcl-2. En
outre, la présence du motif BH3 chez une protéine est requise pour
permettre une interaction avec les membres anti-apoptotiques de la famille
de protéines Bcl-2. En effet, l'activité d'un membre anti-apoptotique de la
famille de protéines Bcl-2 est régulée par le produit des gènes pro-
apoptotiques de ladite famille, les deux protéines s'assemblant en
hétérodimères. Sous cet état le membre anti-apoptotique de la famille de
protéines Bcl-2 est inactif et n'a donc plus son activité anti-apoptotique. En
outre l'interaction spécifique du motif BH3 avec les membres anti-
apoptotiques de la famille de protéines Bcl-2 peut être modifiée par des
modulateurs de façon à induire de manière spécifique la mort cellulaire
programmée de type apoptotique.
Par ailleurs, notons que la voie de signalisation apoptotique peut également
être modulée par des stratégies d'infection virales. En effet, un grand
nombre de protéines virales interfèrent avec la voie de l'apoptose par
homologie structurale, mimétisme fonctionnel ou au niveau de la
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
4
transduction des signaux pro- et anti-apoptotiques. Ainsi certains virus
codent des analogues anti-apoptotiques de Bcl-2 inhibant la voie
mitochondriale ou des inhibiteurs de caspases bloquant la phase effectrice.
L'apoptose précoce de la cellule infectée représente un mécanisme de
défense de l'hôte limitant l'abondance des particules virales ; au contraire
l'apoptose retardée de la cellule hôte permet au virus de se répliquer et de
se disséminer.
L'autophagie est impliquée dans le mécanisme de survie de la cellule et est
aussi associée dans le déroulement de la mort cellulaire programmée. De
nombreux travaux ont établi que l'autophagie est sous le contrôle de
produits de gènes suppresseurs de tumeur tels que Beclin, PTEN, TSC1.
L'inactivation de ces gènes et la réduction des capacités autophagiques
sont des événements précoces de la progression tumorale chez les
patients atteints de cancers. Beclin joue un rôle central et précoce dans le
phénomène d'autophagie en particulier dans la formation des vacuoles
autophagiques ou autophagosomes (Edinger et al. Defective autophagy
leads to cancer, Cancer Cell December 2003).
La résistance des tumeurs aux agents de chimiothérapie constitue un
problème central en cancérologie médicale. On constate l'apparition de
résistances acquises se manifestant au niveau de tumeurs qui, au départ,
ont répondu à la chimiothérapie et qui développent ensuite, à plus ou moins
court terme, une résistance aux traitements. Ces résistances présentes au
niveau des cellules tumorales sont généralement associées à une inhibition
de la voie caspase dépendante ou voie apoptotique de la mort cellulaire
programmée au niveau de laquelle agissent les principaux traitements
anticancéreux actuels (agents cytotoxiques). Pour être plus efficaces les
traitements anticancéreux doivent donc proposer une stratégie alternative
et/ou complémentaire aux traitements agissant sur la voie apoptotique de la
mort cellulaire programmée en vue de remédier, au moins en partie, aux
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
inconvénients de traitements connus agissant exclusivement sur
l'apoptose. L'invention propose à ce titre d'agir, par l'intermédiaire de
modulateurs duals, sur la voie autophagique et/ou apoptotique.
Dès lors, la modulation de la voie caspase-indépendante ou autophagique
5 mise en oruvre dans le cadre de l'invention propose une alternative aux
traitements agissant spécifiquement au niveau de la voie apoptotique.
Considérant d'une part, le rôle des membres anti-apoptotiques de la famille
de protéines Bcl-2 dans le processus d'apoptose et d'autre part, le rôle de
la protéine Beclin dans le phénomène d'autophagie ainsi que l'importance
io des résistances acquises dans le développement tumoral, on comprend
l'intérêt d'agir simultanément sur les voies autophagique et apoptotique de
la mort cellulaire programmée dans le cadre des traitements anticancéreux.
Dès lors, il est essentiel de pouvoir identifier des modulateurs pouvant agir
tant sur les membres anti-apoptotiques de la famille Bcl-2 qu'au niveau de
la protéine Beclin. Afin de faciliter et accélérer le criblage de ces
modulateurs duals, les inventeurs ont élaboré une stratégie consistant,
d'une part, à vérifier l'interaction structurelle entre les membres anti-
apoptotiques de la famille de protéines Bcl-2 et la protéine Beclin, et
d'autre
part, à rechercher les modulateurs de cette interaction qui seront de façon
inhérente capables d'agir à la fois sur les membres anti-apoptotiques de la
famille de protéines Bcl-2 ainsi que sur la protéine Beclin. En conséquence,
ces modulateurs duals ainsi sélectionnés seraient idéaux afin d'obtenir des
candidats médicaments pour lutter contre les pathologies dérégulant la
mort cellulaire programmée de type apoptotique et/ou autophagique.
La sélection et l'identification de modulateurs de l'interaction protéique
entre la protéine Beclin ou un motif spécifique de celle-ci et un membre anti-
apoptotique de la famille de protéines Bcl-2 a été étudiée sur la base du
système du double hybride. Fields et al. (US 5,283,173 ; US 5,468,614 ; US
5,667,973) ont initialement décrit et développé ce système du double hybride.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
6
Le système du double hybride consiste initialement en un test en levure
entre deux protéines recombinées. La première protéine, appelée
appât , est une protéine de fusion contenant un domaine de liaison à
l'ADN (DNA binding domain ou BD) lié en amont d'une protéine A. La
seconde protéine est également une protéine de fusion, communément
appelée proie , contenant un domaine d'activation (activation domain ou
AD) lié à une protéine B. Les domaines de liaison et d'activation
couramment utilisés sont ceux de Ga14 ou E. Coli Lex A. Les protéines A et
B sont respectivement un membre anti-apoptotique de la famille de
protéines Bcl-2 et un motif spécifique de Beclin. L'association des protéines
A et B par interaction protéique permet la formation, par complémentation,
d'un domaine fonctionnel (BD-AD) capable de se lier au site de liaison
(binding site ou BS) présent en amont d'un gène rapporteur et d'assurer la
transcription dudit gène rapporteur.
Cependant, cette méthode conventionnelle du double hybride a ses limites.
Il est par exemple bien connu que de tels criblages peuvent conduire à des
faux positifs et/ou faux négatifs et des confirmations biochimiques des
résultats obtenus sont nécessaires. Les faux positifs obtenus via le
système du double hybride sont particulièrement fréquents et sont à
l'origine de mise en évidence d'interactions fonctionnelles et non
structurelles.
Une technique plus performante, permettant de minimiser les faux positifs
et/ou négatifs, est décrite dans la demande de brevet international WO
99/42612 ou le brevet US 6,187,535 et utilise des levures haploïdes
recombinantes contenant les polypeptides appât et proie . Ce système
permet la détection d'un plus grand nombre de proies à partir d'un seul
appât , de façon plus précise, plus reproductible et plus sensible que les
autres méthodes conventionnelles utilisées dans le domaine.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
7
Les inventeurs ont établi, sur la base du système du double hybride,
l'existence d'une interaction structurelle entre les membres anti-
apoptotiques de la famille de protéines Bcl-2 et la protéine Beclin. Cette
interaction protéique entre ces partenaires, similaire à celle existant dans
la
régulation du phénomène apoptotique entre les partenaires anti- et pro-
apoptotiques de la famille de protéines Bcl-2, est impliquée dans l'équilibre
du processus de mort cellulaire programmée.
Un motif original de la protéine Beclin a été, en particulier, mis en évidence
dans le cadre de l'invention. Ce motif de la protéine Beclin est capable
d'interagir de manière très spécifique avec les membres anti-apoptotiques
de la famille des protéines Bcl-2 en vue de son utilisation pour sélectionner
des modulateurs spécifiques de l'apoptose et/ou de l'autophagie. Cette
spécificité d'interaction est liée à la séquence, la structure
tridimensionnelle
et/ou l'hélicité du motif original de la protéine Beclin.
En effet, ce motif original de la protéine Beclin de 26 acides aminés
correspond au domaine précis d'interaction avec Bcl-2, BcI-XL et/ou Bcl-W
et possède les critères structuraux typiques permettant la formation
d'homo- ou d'hétérodimères.
La taille de ce motif en fait un candidat idéal pour l'élaboration d'un test
permettant le criblage hautement efficace de molécules capables de
moduler les interactions entre ce peptide de Beclin et une protéine anti-
apoptotique. On trouve dans la littérature de nombreux tests de criblage de
modulateurs d'interactions protéines-protéines mais ils présentent souvënt
des limites quant à leur sensibilité et leur faisabilité à haut débit. Les
méthodes couramment utilisées nécessitent la mise en uvre d'outils
complexes (protéines de fusion, protéines recombinantes...) peu
compatibles avec un criblage à haut débit. Elles génèrent le plus souvent
un bruit de fond important et sont peu fiables d'un point de vue quantitatif :
elles présentent une fenêtre de lecture réduite ne permettant pas un
criblage optimal des molécules testées.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
8
De manière alternative aux méthodes déjà disponibles, un test de criblage
hautement efficace basé sur la polarisation de fluorescence a été mis en
oeuvre dans la présente invention (Owicki et al., Journal of Biomolecular
Screening, 5, 2000, 297-306). Cette technique permet par exemple de
mesurer l'interaction entre un ligand marqué avec un fluorophore et un
récepteur. Le principe consiste à mesurer une augmentation de la
polarisation de fluorescence émise par le ligand fixé à son récepteur
comparée à celle émise par le ligand libre. La polarisation de fluorescence
du ligand libre est dépendante de son poids moléculaire et sera d'autant
lo plus importante que le poids moléculaire sera élevé. Ainsi lorsque ce test
est réalisé avec un ligand de haut poids moléculaire, ayant une forte
polarisation de fluorescence intrinsèque, il sera difficile d'apprécier de
façon
fiable la différence de polarisation de fluorescence entre le ligand libre et
le
ligand fixé. L'utilisation d'un ligand au poids moléculaire minimal permettra
ls au contraire d'exacerber cette différence, et par conséquent d'augmenter la
précision de la méthode. Il sera ainsi possible de mieux évaluer la réelle
activité d'une molécule, et d'effectuer des criblages à haut débit.
Le peptide correspondant au motif GTMENLSRRLKVTGDLFDIMSGQTDV
(SEQ ID NO.1) de Beclin selon l'invention peut, avantageusement, être
20 utilisé pour le criblage de composés modulant l'interaction protéique entre
le motif de Beclin et un membre anti-apoptotique de la famille de protéines
Bcl-2 soit en activant soit en inhibant cette interaction.
L'invention a pour objet une méthode d'identification de modulateurs de la
mort cellulaire programmée comportant une étape d'interaction entre le
25 motif GTMENLSRRLKVTGDLFDIMSGQTDV de la protéine Beclin et un
membre anti-apoptotique de la famille de protéines Bcl-2 puis une étape de
détection de l'interaction en présence ou non du composé à tester.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
9
Avantageusement, la méthode d'identification de modulateurs de la mort
cellulaire programmée comprend les étapes suivantes :
a) le marquage par sonde de fluorescence du motif
GTMENLSRRLKVTGDLFDIMSGQTDV de la protéine Beclin ;
b) l'addition d'un membre anti-apoptotique de la famille de protéines
Bcl-2 audit motif ;
c) l'incubation des partenaires décrits en a) et b) en présence ou non
du composé à tester ;
d) la mesure de la polarisation de fluorescence ; et
io e) la comparaison de la mesure avec et sans composé à tester.
On entend par modulateur tout composé capable d'accroître,
d'empêcher ou au moins de limiter une activité spécifique telles qu'une
interaction protéine-protéine, une activité enzymatique, une fixation à des
récepteurs cellulaires. Selon la présente invention, les modulateurs sont
is des inhibiteurs ou bien des activateurs de l'interaction protéique entre
les
partenaires Beclin et les membres anti-apoptotiques de la famille de
protéines Bcl-2.
L'invention concerne aussi une méthode d'identification d'un inhibiteur de
l'interaction entre le motif de la protéine Beclin et un membre anti-
20 apoptotique de la famille de protéines Bcl-2 capable de diminuer la
polarisation de fluorescence par rapport à un témoin consistant en cette
interaction en l'absence de modulateur.
L'invention porte également sur une méthode d'identification d'un activateur
de l'interaction entre le motif de la protéine Beclin et un membre anti-
25 apoptotique de la famille de protéines Bcl-2 capable d'augmenter la
polarisation de fluorescence par rapport à un témoin consistant en cette
interaction en l'absence de modulateur.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
Le ligand fluorescent, i.e. le peptide Beclin fluorescent, après liaison avec
le
partenaire anti-apoptotique de la famille de protéines Bcl-2 a une constante
de rotation plus faible que le ligand libre correspondant et de ce fait la
fluorescence émise par le ligand lié devient polarisée. En conséquence, on
5 observe une augmentation de la polarisation de la fluorescence émise par
le ligand lié versus ligand libre.
Dans un mode de réalisation préférée, la sonde de fluorescence utilisée
dans le procédé de criblage selon l'invention est le bodipy, l'Oregon Green
et de manière préférée la fluorescéine.
10 Plus particulièrement, le membre anti-apoptotique de la famille de
protéines
Bcl-2, intervenant comme partenaire de l'interaction dans le processus de
criblage et d'identification selon l'invention, peut être la protéine Bcl-2,
BCI-XL
ou Bcl-W.
Avantageusement, le membre anti-apoptotique de la famille de protéines
Bcl-2 est une protéine de fusion. Par protéine de fusion , on entend la
fusion entre un domaine de la protéine Bcl-2, BcI-XL ou Bcl-W et un
domaine d'une protéine telle que GST (Glutathion-S-transferase).
La présente invention a pour objet un motif de Beclin de séquence d'acides
aminés GTMENLSRRLKVTGDLFDIMSGQTDV et ses variants fonctionnels.
Par séquence d'acides aminés , il doit être compris une séquence
peptidique isolée du contexte naturel. Il s'agit notamment de séquences
isolées, synthétisées chimiquement et/ou purifiées et éventuellement
modifiées par génie génétique.
On entend par variants fonctionnels les séquences d'acides aminés du
motif de Beclin comprenant des substitutions conservatrices ou des
mutations ponctuelles conservatrices et ayant essentiellement les mêmes
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
11
propriétés que ce motif codé par la séquence SEQ ID NO.1, soit la capacité
d'interagir avec un membre anti-apoptotique de la famille de protéines Bcl-2.
Les substitutions ou mutations conservatrices de la séquence d'acides
aminés SEQ ID NO.1 sont, par exemple, les suivantes : glycine par alanine
(G--A), valine par leucine (V--L) ; acide aspartique par acide glutamique (D-
-E), asparagine par glutamine (N--Q), leucine par isoleucine (L--I), arginine
par lysine (R--K).
Les inventeurs ont observé que le motif de Beclin de séquence peptidique
SEQ ID NO.1 interagissait avec un membre anti-apoptotique de la famille
de protéines Bic-2, tel que Bcl-2, BcI-XL ou Bcl-W.
L'invention concerne aussi la séquence d'acides nucléiques
5'ggcaccatggagaacctcagccgaagactgaaggtcactggggacctttttgacatcatgtcgggcc
agacagatgtg 3' (SEQ ID NO.2) codant pour le motif original de la protéine
Beclin. Cette séquence d'acides nucléiques selon l'invention peut être
obtenue d'après le code génétique à partir de la séquence d'acides aminés
du motif de Beclin et ses variants.
Les variants de cette séquence d'acides nucléiques sont notamment :
- des séquences capables de s'hybrider dans des conditions
stringentes avec la séquence d'acides nucléiques SEQ ID NO.2 ou
une séquence complémentaire de celle-ci, et codant un polypeptide
ayant essentiellement les mêmes propriétés que le motif de Beclin
codé par la séquence SEQ ID NO.1, ou,
- des séquences d'une espèce de mammifère homologues à la
séquence SEQ ID NO.2 isolée chez l'Homme.
Par conditions stringentes , on entend les conditions qui permettent
l'hybridation spécifique de deux séquences d'ADN simple brin à environ
65 C par exemple dans une solution de 6 x SSC, 0,5 % SDS, 5X
Denhardt's solution et 100 pg d'ADN carrier non spécifique ou toute autre
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
12
solution de force ionique équivalente et après un lavage à 65 C, par
exemple dans une solution d'au plus 0,2 x SSC et 0,1 % SDS ou toute
autre solution de force ionique équivalente. Les paramètres définissant les
conditions de stringence dépendent de la température à laquelle 50 % des
brins appariés se séparent (Tm). Pour les séquences comprenant plus de
30 bases, Tm est définie par la relation : Tm = 81,5 + 0,41 (%G+C) +
16,6Log (concentration en cations) - 0,63 (% formamide) - (600 / nombre
de bases). Pour les séquences de longueur inférieure à 30 bases, Tm est
définie par la relation : Tm = 4 (G+C) + 2(A+T). Les conditions de
stringence peuvent donc être adaptées par l'homme du métier selon la
taille de la séquence, la teneur en GC et tout autre paramètre, selon
notamment les protocoles décrits dans Sambrook et al., 2001 (Molecular
Cloning : A laboratory Manual, 3rd Ed., Cold Spring Harbor, laboratory
press, Cold Spring Harbor, New York).
1s On entend par séquences d'une espèce de mammifères homologues à la
séquence SEQ ID NO.2 , une séquence de structure similaire à la
séquence SEQ ID NO.2 et codant un polypeptide ayant essentiellement les
mêmes propriétés chez des espèces de mammifères non-humains,
notamment les primates, le rat ou la souris. Le pourcentage d'identité entre
deux séquences homologues dans les régions fonctionnelles est en
général supérieur à 80 %, de préférence supérieur à 90 %.
L'invention concerne également un vecteur recombinant comprenant une
séquence d'acides nucléiques telle que revendiquée selon l'invention. Par
vecteur, il faut comprendre tout type de vecteur permettant l'introduction de
la séquence d'acides nucléiques dans une cellule hôte et éventuellement
l'expression du polypeptide codé par la séquence d'acides nucléiques dans
la cellule hôte.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
13
Un tel vecteur est par exemple un plasmide, un cosmide, un chromosome
bactérien artificiel ou un bactériophage comprenant les séquences
nécessaires à l'expression du motif de la protéine Beclin.
De façon préférée, le vecteur recombinant selon l'invention comprend les
séquences nécessaires à l'expression du motif revendiqué de la protéine
Beclin dans la cellule hôte. Ces séquences sont notamment des séquences
promotrices de la transcription et de la traduction dans la cellule hôte ainsi
que des séquences terminatrices. Le vecteur recombinant peut également
comprendre des séquences codant pour des signaux de sécrétions
permettant la libération des protéines traduites dans l'environnement
extracellulaire.
L'invention porte aussi sur les cellules hôtes transformées par un vecteur
recombinant selon l'invention. Dans un mode de réalisation particulier, ces
cellules hôtes sont des cellules bactériennes telles que Escherichia coli, les
streptococci par exemple ou des cellules eucaryotes telles que des cellules
de levures, de champignons filamenteux, cellules d'insectes et de
préférence des cellules de mammifères.
La transformation de cellules hôtes appropriées par un vecteur recombinant
comprenant les séquences d'acides nucléiques selon l'invention permet
d'exprimer le motif revendiqué de la protéine Beclin. Dans un second
temps, il est possible de purifier les protéines exprimées dans ces cellules
hôtes à partir de différentes méthodes connues de l'homme du métier et
abondamment décrites dans l'état de la technique. Citons par exemple les
purifications par précipitation au sulfate d'ammonium, par chromatographie
d'exclusion par la taille et de préférence par chromatographie d'affinité.
Ce peptide de séquence d'acides aminés SEQ ID NO.1 peut également
être synthétisé chimiquement à façon par Néosystem. La synthèse
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
14
chimique de SEQ ID NO.1 et de ses variants fonctionnels est réalisée par
synthèse sur support solide selon la stratégie Boc/benzyle à l'aide d'un
synthétiseur de peptides Applied Biosystems 430A . La synthèse repose
sur l'élaboration sur résine de la séquence voulue, puis la déprotection des
fonctions amines N et C-terminales. En stratégie Boc/benzyle, il est
nécessaire d'introduire l'acide aminé Boc-L-Lys(Fmoc)-OH lors de la
synthèse du peptide. Après avoir élaboré toute la séquence, la fonction
amino est déprotégée et le peptide coupé de la résine en présence d'un
acide fort.
L'invention porte également sur une composition pharmaceutique
comprenant un peptide, correspondant au motif SEQ ID NO.1 de Beclin
selon l'invention en tant que principe actif en combinaison avec un ou
plusieurs excipients pharmaceutiquement acceptables.
Dans le contexte de l'invention, on entend par excipients d'une
composition pharmaceutique tout agent assurant le transport du principe
actif dans les voies internes chez le patient traité. Par principe actif ,
on
entend toute substance responsable des propriétés pharmacodynamiques
ou thérapeutiques de la composition pharmaceutique.
Parmi les excipients, non toxiques, pharmaceutiquement acceptables, on
peut citer à titre indicatif et non limitatif les diluants, les solvants, les
conservateurs, les agents mouillants, les émulsifiants, les agents
dispersants, les liants, les agents gonflants, les agents désintégrants, les
retardants, les lubrifiants, les absorbants, les agents de suspension, les
colorants ou les aromatisants.
La présente invention concerne non seulement la composition
pharmaceutique considérée en tant que telle et définie supra, mais
également l'utilisation de cette composition dans une méthode d'induction
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
de mort cellulaire programmée de type apoptotique et/ou autophagique
selon l'invention.
La présente invention porte donc sur une méthode d'induction de mort
cellulaire programmée de type apoptotique, i.e. voie de mort cellulaire
5 programmée caspase dépendante, et/ou de type autophagique, i.e. voie de
mort cellulaire programmée caspase indépendante, comprenant
l'administration au patient atteint notamment de cancer d'une quantité
efficace de composition pharmaceutique comprenant un peptide de Beclin
de séquence SEQ ID NO.1.
10 L'invention vise également une composition pharmaceutique comprenant
au moins un modulateur, activateur ou inhibiteur, identifié à partir de la
méthode d'identification de modulateurs selon l'invention, en tant que
principe actif de ladite composition en combinaison avec un ou plusieurs
excipients pharmaceutiquement acceptables .
15 L'invention porte aussi sur une méthode d'induction de mort cellulaire
programmée de type apoptotique (caspase dépendante) et/ou autophagique
(caspase indépendante) à partir de l'administration d'une quantité efficace de
composition définie supra à un patient atteint de cancer.
Les compositions pharmaceutiques telles que décrites supra sont
utilisables dans le traitement des cancers par action sur la mort cellulaire
programmée de type apoptotique et/ou autophagique.
Les compositions selon l'invention sont sous une forme convenant à
l'administration orale, parentérale, nasale, per ou transcutanée, rectale,
perlinguale, oculaire ou respiratoire et notamment les comprimés simples
ou dragéifiés, les comprimés sublinguaux, les sachets, les paquets, les
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
16
gélules, les glossettes, les tablettes, les suppositoires, les crèmes, les
pommades, les gels dermiques, et les ampoules buvables ou injectables.
La présente invention est illustrée sans pour autant être limitée par les
figures et exemples suivants :
- Figure 1: séquence d'acides aminés SEQ ID NO.1 du motif de
Beclin interagissant avec un membre anti-apoptotique de la famille
de protéines Bcl-2.
- Figure 2: séquence d'acides nucléiques SEQ ID NO.2 codant pour
le motif de Beclin interagissant avec un membre anti-apoptotique de
la famille de protéines Bcl-2.
- Figure 3: détermination de Ki en polarisation de fluorescence du
peptide compétiteur Beclin muté ou non sur l'interaction entre le
peptide pro-apoptotique Bak et les membres anti-apoptotiques Bcl-2,
BCI-XL et Bcl-W.
- Figure 4: résultats de co-immunoprécipitation entre la protéine Bcl-
XL et la protéine Beclin.
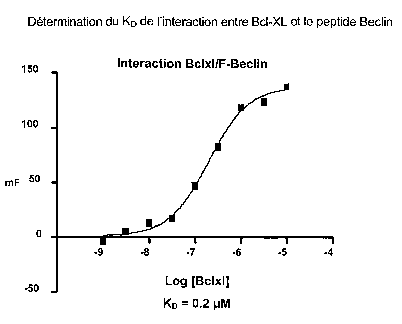
- Figure 5: détermination du KD de l'interaction entre BcI-XL et le
peptide Beclin.
- Figure 6: détermination de l'IC50 d'un antagoniste de BCI-XL de
référence.
EXEMPLE 1: Identification, par le système du double hybride, du
peptide décrit dans la figure 1
Trois banques de cDNA humains ont été criblées (placenta, cerveau, lignée
cellulaire CEMC7) par la technique du double hybride (Fields et al.) chez la
levure en utilisant le protocole de conjugaison décrit par Legrain et al. dans
Nature Genetics, 1997, vol.16, 277-282 (US 6,187,535).
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
17
1) Préparation des appâts et proies
a) Les appâts utilisés sont :
- BCI-XL (numéro d'accession Z23115) délétée de son extrémité C-
terminale (1-209) et fusionnée au domaine de liaison à l'ADN LexA
- Bcl-2 (numéro d'accession XM_008738) délétée de son extrémité C-
terminale (1-211) et fusionnée au domaine de liaison à l'ADN LexA.
Ces appâts sont exprimés dans les levures Saccharomyces cerevisiae
souche L40Agal4 (MATa ade2, trpl-901, leu2-3, 112, lys2-801,
his3A200, LYS2 (IexAop)4-HIS3, ura3-52 ::URA3 (IexAop)$-LacZ,
GAL4 ::KanR) et mis en préculture à 30 C dans un milieu synthétique
dépourvu de tryptophane (DO-Trp) jusqu'à obtention d'une densité
optique DO6ooõm comprise entre 0,1 et 0,5. Cinquante ml d'une dilution de
cette préculture (DOsoor,m =0,006) sont incubés à 30 C pendant une nuit.
b) Une collection de levures Saccharomyces cerevisiae, souche YHGX13
(MATa GaI40 GaI80A ade2-101 ::KanR, his3, leu2-3-112, trpl-901, ura3-
52 URA3 ::UASGAL1-LacZ, Met) contenant les plasmides exprimant les
banques de cDNA fusionnés au domaine d'activation de la transcription
Ga14 est obtenue par transformation après sélection sur un milieu de
culture dépourvu en leucine (DO-Leu). Ces levures sont aliquotées et
conservées à -80 C.
2) Coniugaison
La conjugaison est réalisée avec un ratio appât / proie égal à 2.
Une quantité de cellules de levures appâts obtenues au stade 1)a)
correspondant à 50 unités DO6ooõm est mélangée aux levures proies
obtenues au stade 1)b). Après centrifugation, le culot est resuspendu dans
un milieu YPGIu, étalé sur des boîtes de culture YPGIu et incubé 4 heures
à 30 C. La sélection des levures conjuguées contenant un appât et
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
18
une proie capables d'interagir ensembles est réalisée sur un milieu DO-
Leu-Trp-His : l'absence de leucine et de tryptophane permet de maintenir
une pression de sélection ne permettant qu'aux levures contenant les deux
types de plasmides ( appâts / proies ) de pousser ; l'absence
d'histidine dans le milieu permet de sélectionner les levures conjuguées
contenant un plasmide appât et un plasmide proie capables
d'interagir ensembles : cette complémentation permet d'activer le gène
HIS3, en tant que gène rapporteur codant pour une enzyme impliquée dans
la biosynthèse de l'histidine.
3) Identification des clones positifs
Les fragments proies d'une colonie de levures sélectionnées selon la
méthode de conjugaison décrite au paragraphe 2) sont amplifiés par PCR à
partir d'un lysat brut de cette colonie, en utilisant des amorces spécifiques
du vecteur proie :
ABSI 5'-GCTTTGGAATCACTACAGG-3' (SEQ ID NO.3)
ABS2 5'-CACGATGCACGTTGAAGTG-3' (SEQ ID NO.4).
Les produits de PCR sont ensuite séquencés et les séquences obtenues
sont identifiées par comparaison avec des banques de données.
4) Identification du peptide décrit Figure 1
Pour chaque fragment appât testé, le système du double hybride permet
d'identifier plusieurs fragments proies . Cette identification se fait par
comparaison de séquences des proies sélectionnées à partir d'un
programme informatique tel que Blastwun disponible sur le site internet de
l'Université de Washington :
http://bioweb.pasteur.fr/seqanal/interfaces/blastwu.html.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
19
EXEMPLE 2: Validation de l'interaction entre le peptide décrit dans
l'Exemple 1 et Bcl-2, Bcl-XL et/ou Bcl-W
1) Détermination de Ki en polarisation de fluorescence (Figure 3)
La détermination de Ki en polarisation de fluorescence consiste à mesurer
l'effet compétitif du peptide Beclin sur l'interaction entre le peptide pro-
apoptotique Bak les membres anti-apoptotiques de la famille de protéines
Bcl-2 tels que BcI-XL, Bcl-2 ou Bcl-W.
Les réactifs suivants sont mélangés dans l'ordre précisé :
a) du peptide compétiteur à une concentration finale de 1 nM à 100 pM ;
b) du peptide ligand fluorescent (Bak BH3 carboxyfluoresceine) à une
concentration finale de 15 nM ;
c) du membre anti-apoptotique de la famille de protéines Bcl-2 à une
concentration finale de 100 nM pour BcI-XL, 1 pM pour Bcl-2 et Bcl-W.
Ces réactifs sont en solution dans le tampon d'interaction (Na2HP04 20
mM pH 7.4, EDTA 1 mM, NaCI 50 mM et acide pluronique F-68 0.05%).
Le mélange est ensuite incubé 30 minutes à température ambiante et la
polarisation de fluorescence déterminée sur l'appareil (Packard) Fusion
(excitation à 485 nm et lecture à 530 nm). Les valeurs sont données en mP
(unité de polarisation de fluorescence).
Ces analyses en polarisation de fluorescence ont mis en évidence l'effet
compétitif du peptide Beclin sur l'interaction peptidique entre Bak et BcI-XL,
Bcl-2 ou Bcl-W. Les Ki obtenus au cours de ces tests en polarisation de
fluorescence sont les suivants
BcI-XL/ Bak / Beclin Ki = 1,15 M
Bcl-2 / Bak / Beclin Ki = 1,8 M
Bcl-W / Bak / Beclin Ki = 7,4 M
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
Ces analyses démontrent l'affinité élevée du peptide Beclin vis à vis des
membres anti-apoptotiques de la famille de protéines Bcl-2.
2) Détermination de Ki en polarisation de fluorescence avec le peptide
Beclin muté (L116A)
5 La détermination de Kin en polarisation de fluorescence consiste à mesurer
l'effet compétitif du peptide Beclin muté, de leucine en alanine en position
116 de la séquence complète de la protéine Beclin (L116A), sur l'interaction
entre le peptide pro-apoptotique BAK les membres anti-apoptotiques de la
famille de protéines Bcl-2 tels que BCI-XL, Bcl-2 ou Bcl-W.
10 La séquence du peptide muté (L116A) est la suivante :
GTMENLSRRAKVTGDLFDIMSGQTDV (SEQ ID NO.5).
Le protocole de détermination de Ki en polarisation de fluorescence est
identique au protocole décrit supra.
On observe, par comparaison des résultats d'analyses en polarisation de
15 fluorescence, une perte d'effet compétitif du peptide Beclin muté (L116A)
par rapport au peptide Beclin selon l'invention dans l'interaction peptidique
entre le peptide pro-apoptotique Bak et les membres anti-apoptotiques de
la famille de protéines Bcl-2 tels que BcI-XL, Bcl-2 ou Bcl-W.
3) Co-immunoprécipitation (Figure 4)
20 Des cellules HeLa sont co-transfectées (kit Effectene, Qiagen) par un
vecteur
d'expression codant pour la protéine BcI-XL portant un épitope flag et un
vecteur d'expression codant pour la protéine Beclin sauvage ou muté (L116A).
Vingt-quatre heures après transfection les cellules sont reprises dans le
tampon de lyse (Hepes 10 mM pH 7.5, KCI 150 mM, MgC12 5 mM, EDTA 1
mM, Triton 0.4%, antiprotéases et antiphosphatases), incubées dans la
glace et centrifugées à 10000 rpm.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
21
Le surnageant (lysat cellulaire) est ensuite incubé en présence de billes
d'agarose conjuguées à des anticorps anti-Flag (Flag M2 agarose, sigma)
pendant 2 heures.
Les billes d'agarose sont ensuite centrifugées et lavées dans le tampon de
lyse puis reprises dans du tampon de Laemli et analysées par western-
blots avec des anticorps anti-Beclin
La co-immunoprécipitation de la protéine anti-apoptotique BCI-XL avec la
protéine entière Beclin par interaction protéine/protéine a confirmé
l'interaction structurelle existant réellement entre la protéine Bcl-XL et la
protéine Beclin.
EXEMPLE 3: Test de criblage de molécules capables d'inhiber
l'interaction entre Bcl-2 et/ou Bcl-XL et le peptide
obtenu dans l'Exemple 1
1) Détermination du KD entre le peptide obtenu dans l'Exemple 1 et
Bcl-XL (Figure 5)
Le peptide obtenu dans l'Exemple 1 fiuorescent (couplé à la fluorescéine)
en solution dans le tampon contenant Na2HPO4 20 mM pH 7,4, de I'EDTA
1 mM, NaCI 50 mM, de l'acide pluronique F-68 0,05% à une concentration
de 15 nM est incubé en présence de concentrations croissantes de la
protéine de fusion GFT-Bcl-XL (10'9 à 10-5 M) et la polarisation de
fluorescence est ensuite mesurée par l'appareil En Vision (Packard
Perkin-Elmer).
Un KD de 0,2 pM pour cette interaction a ainsi pu être déterminé.
CA 02596672 2007-08-01
WO 2006/082303 PCT/FR2006/000205
22
2) Identification d'inhibiteur de l'interaction Bcl-XL-peptide
Les produits à tester sont distribués dans des plaques 384 puits (Corning
Flat Bottom) à une concentration finale de 10 g/ml. Un puits est rempli
avec une quantité équivalente de tampon/solvant sans composé à tester et
constituera le témoin. Le peptide obtenu dans l'Exemple 1 marqué à la
fluorescéine est ajouté dans chaque puits de manière à obtenir une
concentration finale allant de 1 à 100 nM. La protéine de fusion GST-Bcl-XL
ou GST-Bcl-2 ou encore GST-Bcl-W est ensuite ajoutée de façon à obtenir
une concentration finale de 0,1 à 1 M dans un tampon contenant
Na2HPO4 20 mM pH 7,4, de I'EDTA 1 mM, NaCI 50 mM, de l'acide
pluronique F-68 0,05%. La polarisation de fluorescence est ensuite
mesurée par l'appareil En Vision (Packard Perkin-Elmer). Une diminution
significative de la polarisation de fluorescence enregistrée dans l'essai
réalisé avec le composé à tester comparée à celle obtenue sans le
composé à tester (puits témoin) permet de conclure à une activité inhibitrice
de la molécule. A l'inverse, une augmentation significative de la polarisation
de fluorescence dans l'essai avec le produit à tester comparée au témoin
permet de conclure à une activité activatrice de la molécule.
La Figure 6 montre le résultat obtenu avec un composé de référence
antagoniste de Bcl-XL (Ref 1) : composé 4 de A.D. Hamilton et al., J. Am.
Chem. Soc., 2002, 124, 11838-11839.
Une IC50 de 3,4 pM a pu être déterminée pour ce composé.